TPT1-AS1靶向miR-30c对肺癌细胞发生发展的影响
符国奋 梁海梅 王志峰 颜洪顺 符之月
肺癌是全球常见且病死率较高的恶性肿瘤,分子靶向治疗是新的治疗方式,也是未来研究的热点和重点,其可针对性的通过特异性靶点进行治疗[1]。因此,寻找特异性靶点是分子靶向治疗的关键和重点。研究表明,lncRNA参与肺癌的发生发展过程,可作为肺癌的分子标志物[2]。肿瘤翻译调控蛋白1(tumor protein translationally-controlled 1,TPT1)反义RNA1(TPT1 antisense RNA 1,TPT1-AS1)是一种lncRNA,研究报道TPT1-AS1在非小细胞肺癌中高表达,与TNM分期、淋巴转移及患者生存率相关,可作为临床预后判断的参考指标[3]。TPT1-AS1在上皮性卵巢癌转移组织和细胞系中也高表达,与FIG0分期,肿瘤大小和肿瘤分化密切相关;TPT1-AS1通过诱导TPT1表达促进细胞增殖,迁移和侵袭[4]。然而TPT1-AS1对肺癌细胞发生发展的影响及机制尚不清楚。研究报道miRNA也参与了肿瘤的发生发展,研究报道miR-30c的低表达通过诱导非小细胞肺癌的上皮间质转化(epithelial mesenchymal transition,EMT)促进细胞侵袭[5]。lncRNA DLEU2通过下调miR-30c-5p可促进非小细胞肺癌细胞的增殖和侵袭[6]。但TPT1-AS1是否通过调控miR-30c影响肺癌的发生发展还不清楚。因此,本实验旨在研究TPT1-AS1对肺癌细胞发生发展的影响及机制是否与miR-30c有关。
1 材料与方法
1.1 标本来源 选取琼海市人民医院2017年1月至2019年1月收治的肺癌患者34例,患者经手术切除癌组织,距离癌组织边缘2~5 cm处切除的为癌旁组织。
1.2 纳入与排除标准
1.2.1 纳入标准:①经病理组织切片检测确诊为肺癌;②术前未进行过放化疗;③临床病理及随访资料完整;④患者均知情且同意。
1.2.2 排除标准:①心、肝脏、肾等功能不齐全者;②患有严重精神疾病者;③合并其他肿瘤者。
1.3 材料 肺癌细胞A549购自上海酶研生物科技有限公司;胎牛血清、RPMI-1640培养基均购自美国Gibco公司;Trizol试剂、荧光定量试剂盒购自北京百奥莱博科技有限公司;二辛可宁酸(bicinchoninic acid,BCA)试剂盒、RIPA蛋白裂解液购自上海羽朵生物科技有限公司;吉姆萨染色液购自北京华迈科生物技术有限责任公司;Transwell小室购于美国BD公司;双荧光素酶报告基因检测试剂盒购自北京Solarbio公司。
1.4 细胞培养与分组 肺癌细胞A549用含10%胎牛血清的RPMI-1640培养液在37℃、5% CO2条件下培养,2 d换液1次,取对数生长期细胞进行实验,将pcDNA3.1、pcDNA3.1-TPT1-AS1、anti-miR-NC、anti-miR-30c分别转染至A549细胞中,记为pcDNA3.1组、pcDNA3.1-TPT1-AS1组、anti-miR-NC组、anti-miR-30c组。
1.5 实时荧光定量PCR(Real-time quantitative PCR,RT-qPCR)检测TPT1-AS1和miR-30c表达水平 各组细胞培养48 h,提取总RNA,将RNA反转录成cDNA,按照荧光定量试剂盒使用说明进行PCR,每个样品设3个重复,循环条件为95℃ 5 min,95℃ 30 s,60℃ 30 s;72℃ 30 s,共40个循环;60℃延长5 min。相对表达量用2-△△Ct法计算。TPT1-AS1和miR-30c分别以GAPDH和U6为内参,TPT1-AS1上游引物序列:5’-CTCCCAA
AGTGCTGGGATTA-3’,下游引物序列:5’-TTTAGGAA
GATGGGCAAGGA-3’;GAPDH上游引物序列:5’-TGTTGCCATCAATCACCCCTT-3’,下游引物序列:5’-CTCCACGACGTACTCAGCG-3’;miR-30c上游引物序列:5’-TGTAAACATCCTACACTCTCAGCAA-3’,下游引物序列:5’-GCTGTCAACGATACGCTACGTAACG-3’;U6上游引物序列:5’-CTCGCTTCGGCAGCACA-3’,下游引物序列:5’-AACGCTTCACGAATTTGCGT-3’;引物由上海生工生物工程公司合成。
1.6 流式细胞仪检测细胞周期 2组细胞培养48 h后收集细胞,并制备单细胞悬液,加入3 ml预冷的70%乙醇固定,用缓冲液洗涤后加入核糖核酸酶A(RNase A)于37℃水浴30 min,加入碘化啶(PI),避光30 min,上机检测,重复3次。用流式细胞仪和DNA细胞周期分析软件对细胞周期进行检测分析。
1.7 克隆形成实验检测细胞克隆形成数 取对数生长期A549细胞,制成1×104个/ml细胞悬液,以每孔100个细胞接种于六孔板中,每组设3个复孔,培养2周出现肉眼可见克隆时终止培养,PBS清洗2遍,甲醇固定15 min,吉姆萨染色30 min,在低倍光学显微镜下计数>50个细胞的集落。
1.8 蛋白质印迹(Western blot)法检测Ki67、E-cadherin、N-cadherin蛋白表达 适量RIPA裂解液提取总蛋白,BCA法测定蛋白浓度。将蛋白样品进行SDS-PAGE、转膜、封闭,加入将稀释好的一抗(1∶500稀释),室温摇床孵育2 h,TBST洗膜,加入按照1∶3 000稀释的HRP标记山羊抗兔的二抗,室温摇床孵育2 h,TBST洗膜,ECL显色,暗室下显影、定影。Quantity-One软件分析蛋白条带灰度值。蛋白的相对表达量=目的蛋白灰度值/内参GAPDH灰度值。实验重复3次。
1.9 Transwell检测细胞迁移 Transwell小室上室加100 μl细胞悬液,下室加500 μl含血清培养液,37℃培养24 h,取出培养板,0.1%结晶紫染色30 min,PBS漂洗2遍,棉签擦拭掉上层细胞,光学显微镜(×200)下随机选择5个视野,拍照记录并进行细胞计数。实验重复3次。
1.10 荧光素酶报告实验检测TPT1-AS1对miR-30c的靶向调控 构建含miR-30c结合位点的TPT1-AS1的野生型和突变型荧光素酶表达载体WT-TPT1-AS1和MUT-TPT1-AS1,用LipofectamineTM 2000将WT-TPT1-AS1和MUT-TPT1-AS1分别与miR-NC和miR-30c共转染至A549细胞中。按照说明书检测荧光素酶活性,实验重复3次。

2 结果
2.1 TPT1-AS1在肺癌中的表达 与癌旁组织比较,肺癌组织中TPT1-AS1表达水平显著升高(P<0.05)。见表1。

表1 TPT1-AS1的表达
2.2 过表达TPT1-AS1对A549增殖的影响 与pcDNA3.1组比较,pcDNA3.1-TPT1-AS1组G0期细胞所占比例显著降低(P<0.05),S期细胞所占比例显著升高(P<0.05),G2期细胞所占比例差异无统计学意义(P>0.05);细胞克隆形成数显著升高(P<0.05),Ki67表达水平显著升高(P<0.05)。见图1,表2。

图1 Ki67蛋白的表达
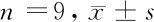
表2 过表达TPT1-AS1对A549增殖的影响
2.3 过表达TPT1-AS1对A549迁移的影响 与pcDNA3.1组比较,pcDNA3.1-TPT1-AS1组TPT1-AS1表达水平显著升高,迁移细胞数显著升高,E-cadherin表达水平显著降低,N-cadherin表达水平显著升高(P<0.05)。见表3,图2。
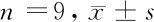
表3 过表达TPT1-AS1对A549迁移的影响

图2 E-cadherin、N-cadherin蛋白的表达
2.4 TPT1-AS1靶向miR-30c Starbase数据库预测显示TPT1-AS1与miR-30c存在结合位点。荧光素酶报告实验显示,与miR-NC组比较,miR-30c组中转染野生型表达载体WT-TPT1-AS1的细胞荧光素酶活性显著降低(P<0.05);而转染突变型表达载体MUT-TPT1-AS1的细胞荧光素酶活性差异无统计学意义(P>0.05)。与pcDNA3.1组比较,pcDNA3.1-TPT1-AS1组miR-30c表达水平显著降低(P<0.05)。见图3,表4、5。

图3 TPT1-AS1靶向miR-30c
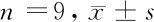
表4 TPT1-AS1靶向miR-30c
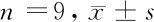
表5 TPT1-AS1调控miR-30c
2.5 抑制miR-30c对A549增殖、迁移的影响 与anti-miR-NC组比较,anti-miR-30c组miR-30c表达水平显著降低,G0期细胞所占比例显著降低,S期细胞所占比例显著升高(P<0.05),G2期细胞所占比例变化差异无统计学意义(P>0.05);细胞克隆形成数显著升高,迁移细胞数显著升高,Ki67、N-cadherin表达水平显著升高,E-cadherin表达水平显著降低(P<0.05)。见图4,表6、7。

图4 Ki67、E-cadherin、N-cadherin蛋白的表达
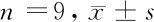
表6 抑制miR-30c对A549增殖、迁移的影响
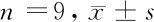
表7 Ki67、E-cadherin、N-cadherin蛋白的表达
3 讨论
随着分子生物学的发展,肿瘤靶向药物逐渐成为肿瘤治疗的研究热点,越来越多的靶向药物进入临床;研究肺癌的发生发展机制有利于寻找新的靶点以用于开发新的靶向药物[7]。研究表明lncRNA与肿瘤的发生发展密切相关,深入研究lncRNA在肿瘤中的作用机制,可能为肿瘤诊疗提供新的方法[8]。研究报道lncRNA TPT1-AS1在胶质母细胞瘤中差异表达,是胶质母细胞瘤中临床相关的lncRNA生物标记[9]。神经胶质瘤细胞中TPT1-AS1上调表达,TPT1-AS1可以竞争性地结合miR-770-5p,从而调节STMN1的表达。以抑制神经胶质瘤细胞自噬并促进增殖[10]。TPT1-AS1在子宫颈癌组织和细胞系中表达上调,高表达的TPT1-AS1与患者不良预后特征和不良生存率显著相关,TPT1-AS1的过表达通过充当miR-324-5p的海绵可促进子宫颈癌细胞的细胞集落形成、增殖、迁移、侵袭和EMT进程[11]。本实验结果表明肺癌组织中TPT1-AS1高表达,说明TPT1-AS1可能参与了肺癌的进展。为进一步研究TPT1-AS1对肺癌的影响,转染TPT1-AS1过表达载体,结果显示,G0期细胞所占比例显著降低,S期细胞所占比例显著升高,G2期细胞所占比例无显著变化;细胞克隆形成数显著升高,迁移细胞数显著升高,Ki67、N-cadherin表达水平显著升高,E-cadherin表达水平显著降低。Ki67是细胞增殖标志物,N-cadherin、E-cadherin是EMT过程的标志物,其表达水平与细胞迁移有关。因此,本实验结果表明,TPT1-AS1过表达可促进肺癌细胞从G0期到S期转化,促进细胞的克隆形成和迁移。
研究表明miRNA参与调控肿瘤的侵袭转移等进展[12]。研究报道胰腺癌组织中miR-30c低表达,高表达可抑制胰腺癌细胞的增殖,并预示预后不良[13]。miR-30c过表达直接靶向BCL9抑制了大肠癌的增殖[14]。miR-30c通过靶向Y染色体上的性别决定区相关高迁移率族盒蛋白9(sex determining region Y-related high mobility group box protein 9,SOX9)可抑制胶质母细胞瘤细胞的增殖和迁移[15]。miR-30c的下调通过靶向转移相关蛋白1(metastasis-associated protein 1,MTA1)促进非小细胞肺癌的侵袭[16]。本实验转染miR-30c抑制表达载体后,G0期细胞所占比例显著降低,S期细胞所占比例显著升高,G2期细胞所占比例无显著变化;细胞克隆形成数显著升高,迁移细胞数显著升高,Ki67、N-cadherin表达水平显著升高,E-cadherin表达水平显著降低。说明抑制miR-30c表达可促进肺癌细胞增殖和迁移,与前人研究结果相符。且本实验还发现TPT1-AS1可靶向调控miR-30c的表达。
提示,过表达TPT1-AS1可能通过下调miR-30c促进肺癌细胞从G0期到S期转化,促进细胞的克隆形成和迁移。

