高原地区胃癌病人组织低氧诱导因子表达与临床特征及预后相关性研究
李欣 林明哲 赵久达
胃癌是一种恶性肿瘤。在肿瘤增长的过程中,由于内部血流灌注不足,导致细胞内氧消耗大于供给,从而产生缺氧,形成低氧微环境。细胞对于低氧应激的关键信号通路是低氧诱导因子(hypoxia inducible factor,HIF)信号通路[1-3]。HIF与肿瘤的血管生成、增殖、侵袭及产生耐药性等都具有紧密的联系[4-8]。HIF家族主要由HIF-1、HIF-2和HIF-3构成。HIF家族主要是由α和β亚基组成的异源二聚体,其中调控低氧的的主要功能亚基是α亚基(HIF-1α、HIF-2α、HIF-3α)[9-13]。本文选取HIF-1α代表HIF家族来研究HIF在胃癌病人中的表达以及与预后的相关性。
对象与方法
一、对象
2015年9月~2017年7月在我院治疗的胃癌病人62例,均行胃癌根治术。其中男性36例,女性26例,年龄56~68岁,平均年龄(58.0±5.8)岁,均为开腹手术。由外科医生提供胃癌原发灶组织以及距胃癌原发灶边缘5 cm的癌旁组织。纳入标准:(1)手术之前均未进行过化疗和放疗;(2)肿瘤组织标本均经病理学检查确诊为胃癌。排除标准:其他恶性肿瘤、免疫系统疾病、血液系统疾病、心脑血管疾病病人;严重肝肾功能障碍。
二、方法
1.免疫组织化学染色:采用免疫组织化学染色链霉菌抗生物素蛋白-过氧化物酶连结(streptavidin peroxidase,SP)法检测HIF-1α在胃癌组织及正常胃组织中的表达情况。石蜡切片常规脱水后进行抗原修复,采用H2O2阻断内源性过氧化物酶的活性,封闭非特异性位点;滴加一抗,4 ℃孵育过夜置于室温,磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗后滴加生物素标记的二抗,37 ℃温箱内孵育35分钟;PBS冲洗后滴加SP复合物,37 ℃温箱内孵育30分钟;PBS冲洗,二甲基联苯胺显色5分钟;自来水冲洗,苏木素复染10分钟;自来水冲洗10分钟,盐酸酒精分化2~3秒;自来水冲洗,温水浸泡返蓝30分钟;脱水;二甲苯Ⅰ、Ⅱ各浸泡5分钟;中性树脂封片。采用已知的HIF-1α阳性表达的胃癌切片作为阳性对照,采用PBS代替一抗作为阴性对照。
2.高效液相色谱法:将胃癌和癌旁组织的经过苯酚/氯仿/异戊醇(25∶24∶1,体积比) 法提取组织 DNA,再将DNA经过酶解后采用色谱柱为Ultimate Polar-RP(4.6 mm×250.0 mm,5 μm);流动相为0.2%(体积分数)磷酸;流速为1.3 ml/min;检测波长为273 nm;进行HPLC分析,计算得出DNA甲基化水平。
3.表达分析:采用独立样本t检验以及bootstrap方法检验比较胃癌组织与癌旁组织之间HIF-1αmRNA及DNA甲基化的表达差异,并用Pearson对两者差异进行相关性分析。
4.生存分析:以接受者操作特性(receiver operating characteristiccurve,ROC)曲线的约登指数最小值(总生存分析和无复发生存分析分别为1.421和3.386)作为HIF-1αmRNA表达的分割点,将胃癌病人分为HIF-1α高表达组和低表达组;绘制出总生存生存曲线和无复发生存曲线,采用Kaplan-Meier法;再分别比较两组之间的总生存率和无复发生存率,方法选择采用对数秩和检验(Log-rank)。
5.免疫组织化学染色结果判定:HIF-1α蛋白表达主要位于细胞质和细胞膜,呈棕黄色颗粒状。由两名病理医师采用双盲法对切片进行观察,每张切片随机选择10个高倍视野(×400),每个高倍视野计数100个细胞。采用半定量积分法判断HIF-1α蛋白的表达情况。依据染色强度评分:不显色或显色不清为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。依据阳性细胞所占百分比评分:阳性细胞<5%为0分,5%≤阳性细胞<25%为1分,25%≤阳性细胞<50%为2分,阳性细胞≥50%为3分。染色强度评分与阳性细胞所占百分比评分相加,0分为阴性(-),1~2分为弱阳性(+),3~4分为中等阳性(++),5~6分为强阳性(+++),其中弱阳性(+)、中等阳性(++)及强阳性(+++)均为阳性。
6.观察指标:比较胃癌组织和正常胃组织中HIF-1α蛋白的表达情况,比较不同临床特征胃癌病人胃癌组织中HIF-1α蛋白的表达情况。随访3年,第1次入院便开始随访,第1年每3个月随访1次,以后2年每6个月随访1次。统计病人生存情况。病人总生存期是指对病人进行随访期间病人死亡或者随访结束。比较胃癌组织中HIF-1α蛋白阳性表达和阴性表达病人的生存率。根据随访情况,将病人分为生存组与死亡组,比较两组病人胃癌组织中HIF-1α蛋白的表达情况。分析胃癌组织中HIF-1α蛋白表达情况与胃癌病人临床特征及预后的相关性。
三、统计学处理
采用SPSS 22.0软件对数据进行统计分析,采用Graphad Prism 5.0软件作图。HIF-1α蛋白以及DNA甲基化的表达水平采用独立样本t检验,相关性分析采用Pearson法;对数秩和检验(Log-rank)分析组间生存率差异。检验水准双侧α=0.05。
结果
1.HIF-α的mRNA表达水平与DNA甲基化水平:HIF-1α在胃癌组织中的表达及DNA甲基化情况与癌旁组织相比,HIF-1α在胃癌组织中的表达水平较低,癌旁组织与癌组织的表达量分别为(4.80±0.29)和(3.09±0.09),差异有统计学意义(t=5.369,P<0.05)(图1,表1),而其中DNA甲基化水平则偏高,正常与癌组织的表达量分别为(0.158±0.010)和(0.362±0.009),差异有统计学意义(t=6.806,P<0.05)(图2,表1)。说明DNA甲基化水平与癌组织的扩散转移具有密切关系。再通过Pearson分析法分析HIF-1α蛋白表达与其DNA甲基化水平之间的相关性,发现二者呈负相关关系(r=-0.46,P<0.05)(图3)。结果表明,胃癌中HIF-1α表达下降,推测应该与其DNA甲基化水平升高具有一定的相关性,同时,HIF-1α的表达与DNA甲基化水平的表达水平的高低在临床方面可以体现出肿瘤的侵袭程度。
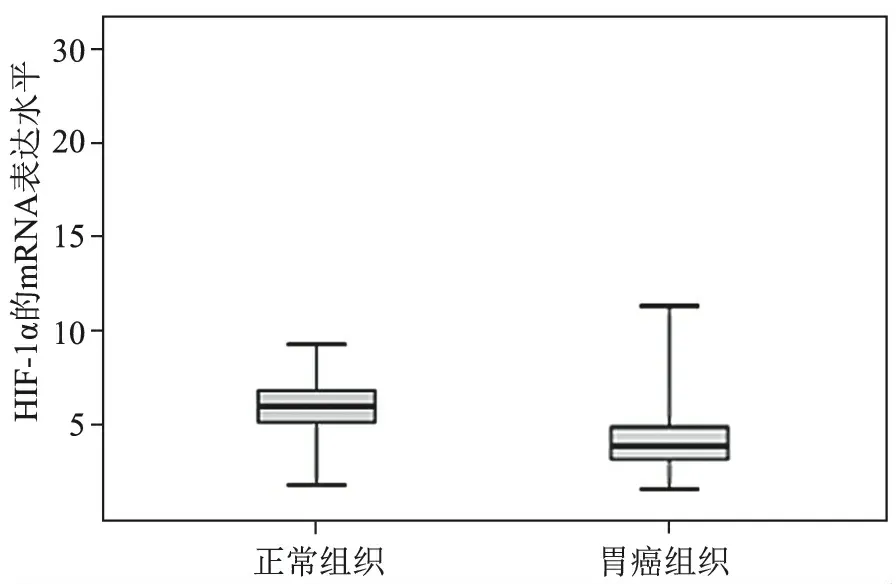
图1 HIF-1α在癌旁组织和胃癌组织中的mRNA表达水平
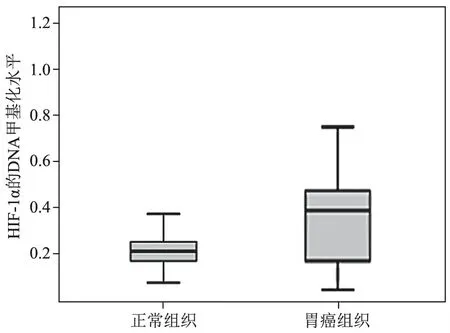
图2 HIF-1α在癌旁组织和胃癌组织中的DNA甲基化水平
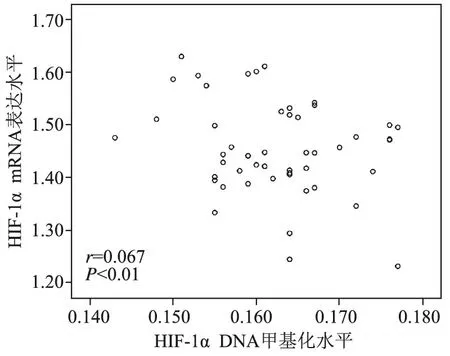
图3 HIF-1α的表达水平与DNA甲基化表达水平的关系

表1 HIF-1α与DNA甲基化水平在胃癌组织和癌旁组织中的表达
2.胃癌组织和癌旁组织中HIF-1α因子表达情况的比较:免疫组化结果显示HIF-1α因子主要定位于胃细胞核及核周,呈棕色颗粒状或灶性分布;胃癌组织大部分能被染色,癌旁组织只有少部分被染色,且胃癌组织胃细胞均着色较深,呈深棕色。提示胃癌组织中HIF-1α因子的表达量均高于癌旁组织。在所收集的62例胃腺癌组织和癌旁组织中,与癌旁组织相比,有70.97%(44 /62)胃癌组织存在不同程度的HIF-1α因子表达水平的上调。
3.不同临床特征胃癌病人胃癌组织中HIF-1α因子表达情况的比较:对免疫组化结果进行统计,结果显示,62例胃癌病例的胃癌组织中HIF-1α因子的表达水平与病人的年龄及性别无显著性相关(P>0.05),但是与肿瘤直径和胃癌不同的发病部位以及TNM分期有显著相关(P<0.05)。HIF-1α因子表达率的越高,肿瘤越大,并且HIF-1α因子在胃体部肿瘤的高表达率要显著高于胃窦和贲门(表2)。以上结果提示HIF-1α因子在胃癌组织中的表达对肿瘤的发展、浸润程度有促进作用,并且在不同部位的胃癌中可能存在表达差异。
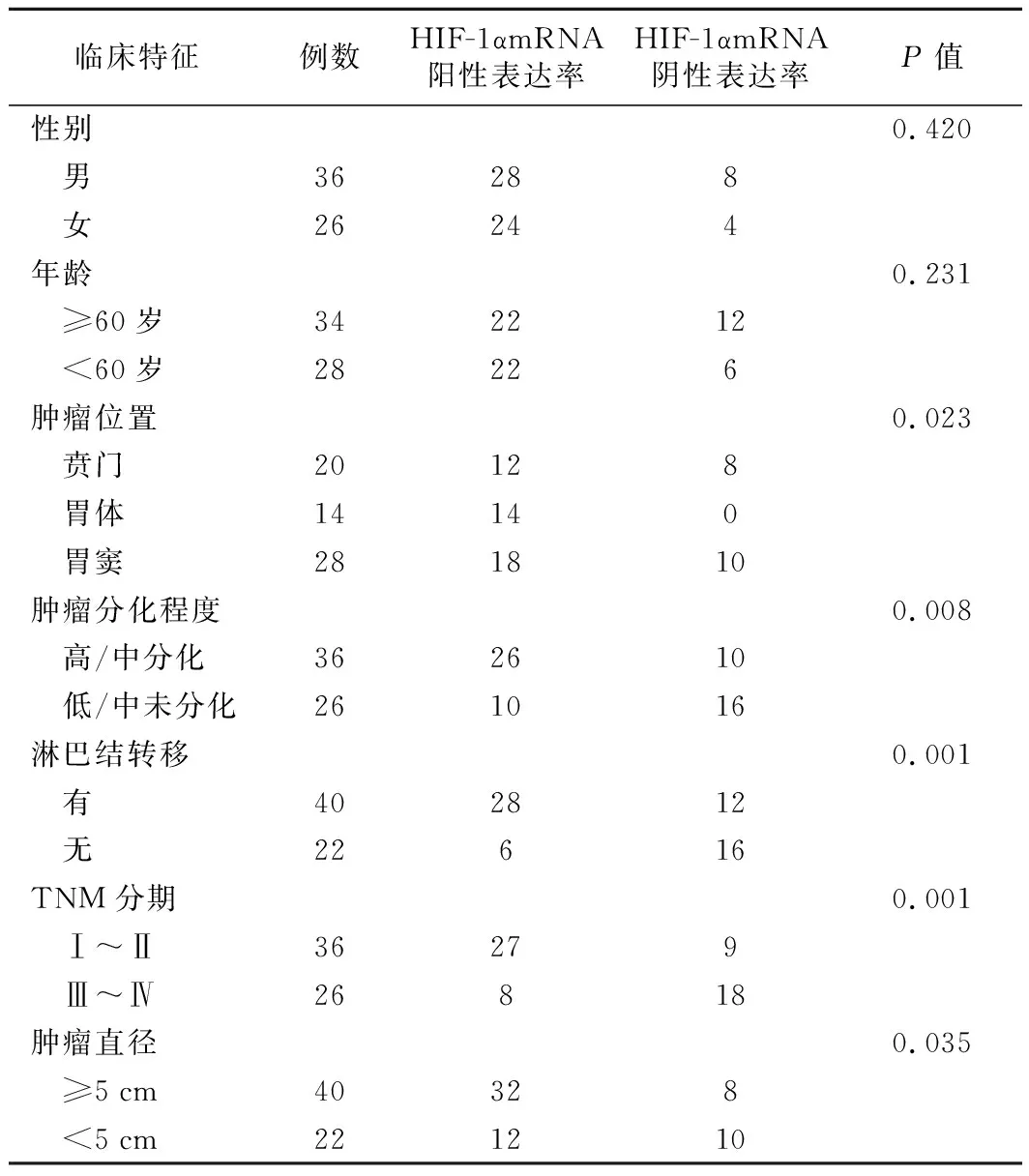
表2 HIF-1αmRNA的表达与胃癌临床病理特征的关系
4.HIF-1α表达与胃癌病人预后的相关性:62例病人均获得随访资料。本研究将胃癌病人分为HIF-1α高表达组和低表达组;采用Kaplan-Meier法绘制总生存曲线及无复发生存曲线;对数秩和检验(Log-rank)分别比较HIF-1α高表达组和低表达组的总生存率和无复发生存率。结果表明,HIF-1α低表达组的总生存率(HR=0.601,P=0.002)(图4)和无复发生存率(HR=0.498,P=0.003)(图5)均显著高于HIF-1α高表达组。结果显示,HIF-1α高表达可以作为胃癌病人的不良预后的参考指标。
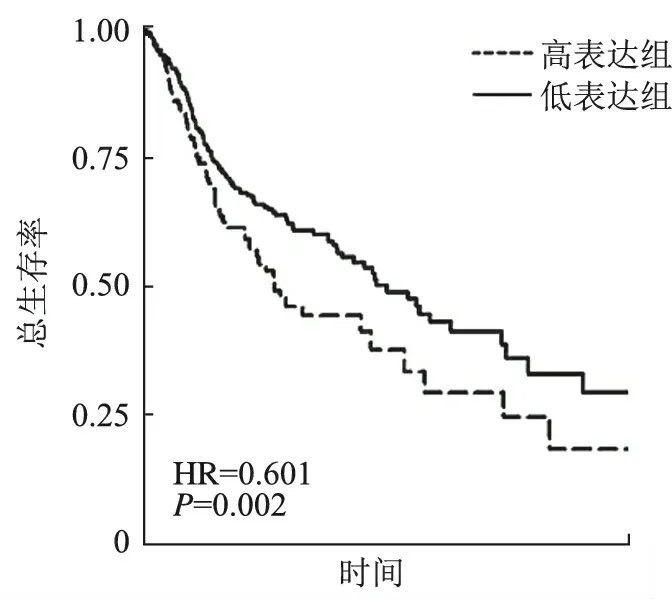
图4 HIF-1α高表达组和低表达组的总生存率
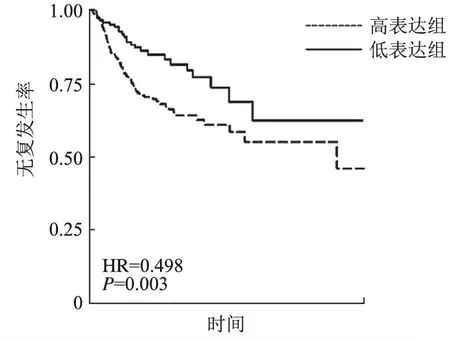
图5 HIF-1α高表达组和低表达组的无复发生率
讨论
胃癌是一种常见的恶性肿瘤,在肿瘤恶化的过程中耗氧量比较大,肿瘤组织处于缺氧状态,而HIF-1α对其有一定的调节功能[14]。本研究结果表明,胃癌组中HIF-1α基因表达量高于癌旁组织,所以在临床方面可以通过HIF-1α的表达水平来推测出肿瘤的侵袭程度[15-18]。有研究表明,肿瘤局部浸润和淋巴结转移离不开低氧微环境的作用。普遍认为,低氧微环境是肿瘤生长的最终结果。以低氧调控因子为代表,可通过调控血管生成、免疫应答和糖酵解等信号,使得在低氧微环境中肿瘤细胞侵袭及转移能力提高,并对放化疗产生抵抗作用。也有研究表明,低氧条件下存在小部分低氧诱导蛋白可以抑制肿瘤生长[19-20]。
免疫组化结果显示,HIF-1α主要定位于胃细胞核及核周,相比于癌旁组织的表达量较大,对免疫组化结果进行统计显示,胃癌组织中HIF-1α的表达水平与病人的年龄及性别无明显相关,但是与肿瘤直径和胃癌不同的发病部位有显著相关。HIF-1α蛋白表达率越高,肿瘤越大,并且HIF-1α在胃体部肿瘤的高表达率要显著高于胃窦和贲门。以上结果提示,HIF-1α在胃癌组织中的表达对肿瘤的发展、浸润程度有促进作用,并且在不同部位的胃癌中可能存在表达差异。
由于选择样本数量较小,参照bootstrap方法检验统计是否显著,需要根据bootstrap方法得到的95%置信区间来判断。本研究结果表明,HIF-1α在胃癌组织和癌旁组织比较,差异有统计学意义,两者间DNA甲基化水平比较,差异有统计学意义。分析HIF-1α表达与其DNA甲基化水平的相关性发现,二者呈负相关关系,由此推测,HIF-1α表达降低,可能与其DNA甲基化水平升高有关。通过ROC曲线分析可知,HIF-1α高表达可预示胃癌病人不良预后,还可以判断出肿瘤的发展以及浸润程度。
有研究表明,在肿瘤细胞的扩散及血管形成中HIF-1α发挥着重要的作用,HIF-1α的高表达与肿瘤的恶化还有淋巴结的转移有密切关联。对病人近3年的观察表明,胃癌病人HIF-α高表达者生存率为79.8%,而HIF-1α低表达者生存率仅为56.2%,低表达率病人明显生存率偏高。临床研究还发现,在幽门螺杆菌(helicobacter pylori,HP)相关胃炎和胃腺癌中检测HIF-1α的表达发现,在正常胃黏膜中HIF-1α不表达,而由HP相关胃炎转变成胃癌的胃黏膜中,HIF-1α的染色强度增强,密度增加。这表明胃癌的演变可能伴随着HIF-α的参与。伴随胃癌演变的恶劣,HIF-1α的表达也在不断增加,同时,HIF-1α在胃癌中的表达提高,也会加剧胃癌的恶化程度。因此,对HIF-1α的表达进行检测可以帮助了解胃癌的的发展程度,对预后的判断可以提供有效的参考价值。
综上所述,HIF-1α在人体的不同种类肿瘤细胞中都有表达,在维持肿瘤细胞的代谢过程、肿瘤血管的形成、还有促进肿瘤细胞转移扩散中扮演着重要的角色。并且在胃癌组织中高表达,可能会加速胃癌扩散转移,可以作为治疗肿瘤的一项参考指标,同时对病人的预后也可以提供有效的参考价值。所以,研究HIF-1α对研究肿瘤转移扩散、以及治疗方案还有对胃癌病人的预后判断等方面具有良好意义。

