结直肠癌肝转移病人原发灶切除的临床意义及其预后影响因素分析
——基于SEER数据库的倾向得分匹配分析
侯松林 谢兴江 彭强 李利发 周何 周彤
结直肠癌(colorectal cancer,CRC)作为消化系统最常见的恶性肿瘤之一,其发病率和死亡率分别高居恶性肿瘤第3和第2位,给人们的生命健康安全带来了重大的威胁[1]。肝脏是CRC最常见的转移器官,约50%的病人会发生肝转移,其中只有约10%~20%的病人适合手术切除转移灶,是导致病人死亡的主要原因[2-3]。目前,对于不可切除肝转移灶的结直肠癌肝转移(colorectal liver metastasis,CRLM)病人而言,对原发灶的处理方式有争议。多数学者倾向于手术切除的方式以改善病人预后[4-7],另一部分学者则持相反的观点[8-9]。本研究以美国国立癌症研究所监测、流行病学和结果数据库(surveillance epidemiology and end results,SEER)中大量的循证医学资料为基础,分析原发灶切除在不可切除转移灶的CRLM病人中的临床价值以及其预后影响因素。
资料与方法
一、资料
SEER数据库是北美地区最具代表性的大型肿瘤登记注册数据库之一,该数据库详细记录了1973年以来美国部分州县28%的癌症病人发病、病理、治疗及预后等信息[10]。本研究通过SEER*Stat 8.3.6软件,提取并筛选有关2010~2015年经病理确诊为CRLM病人的病例资料。纳入标准:(1)就诊时间为2010~2015年;(2)初诊时原发肿瘤位于结直肠;(3)辅助检查或病理检查证实为伴肝转移,且无其他部位转移;(4)未行转移灶手术;(5)有完整的临床、病理、随访资料。排除标准:多源性肿瘤;原发性肝癌;非原发性结直肠癌;伴肝外其他部位转移;已对转移灶进行过处理;经尸检或死亡证明确诊;临床、病理及随访资料不完整。治疗方式:纳入的3 920例病人中,接受全身化疗联合原发灶切除的病人3 232例(联合组),仅接受单纯全身化疗的病人688例(化疗组)。
二、统计方法
采用SPSS 26.0 软件对数据进行统计分析。应用X-tile软件分析确定最佳分组截点,完成连续性变量到分类变量的转化。采用χ2检验比较病人的临床基线特征差异。利用Kaplan-Meier法计算病人总体生存率(OS)和肿瘤特异性生存率(CSS),生存率比较采用Log-rank法。倾向性匹配评分采用R3.6.3软件的MatchIt、tableone、cobalt等语言包实现,校正阈值设定为0.02,采用near neighbor matching方法等比例匹配两组基线特征差异。利用COX比例风险回归模型进行单因素和多因素分析各变量对联合组中病人的预后影响。以α=0.05作为检验水准。
结果
1.匹配前截点分析及两组病人生存资料的比较:经过筛选,本文研究共纳入3 920例病人资料(图1),经过截点分析,将年龄段分为18~55岁、56~75岁以及76~95岁;肿瘤大小分段为4~49 mm、50~75 mm以及≥77 mm。倾向得分匹配(propensity score matching,PSM)前分别对两组病人生存资料进行分析,结果显示,化疗组病人总体中位生存时间为21个月(95%CI:19.50~22.49),肿瘤特异性中位生存时间为21个月(95%CI:19.36~22.64);而联合手术组病人总体中位生存时间为33个月(95%CI:31.88~34.12),肿瘤特异性中位生存时间为35个月(95%CI:33.69~36.31)。Kaplan-Meier生存曲线分析显示,两组生存率比较差异有统计学意义(P<0.01),化疗组病人的OS和CSS均低于联合组。见图2。
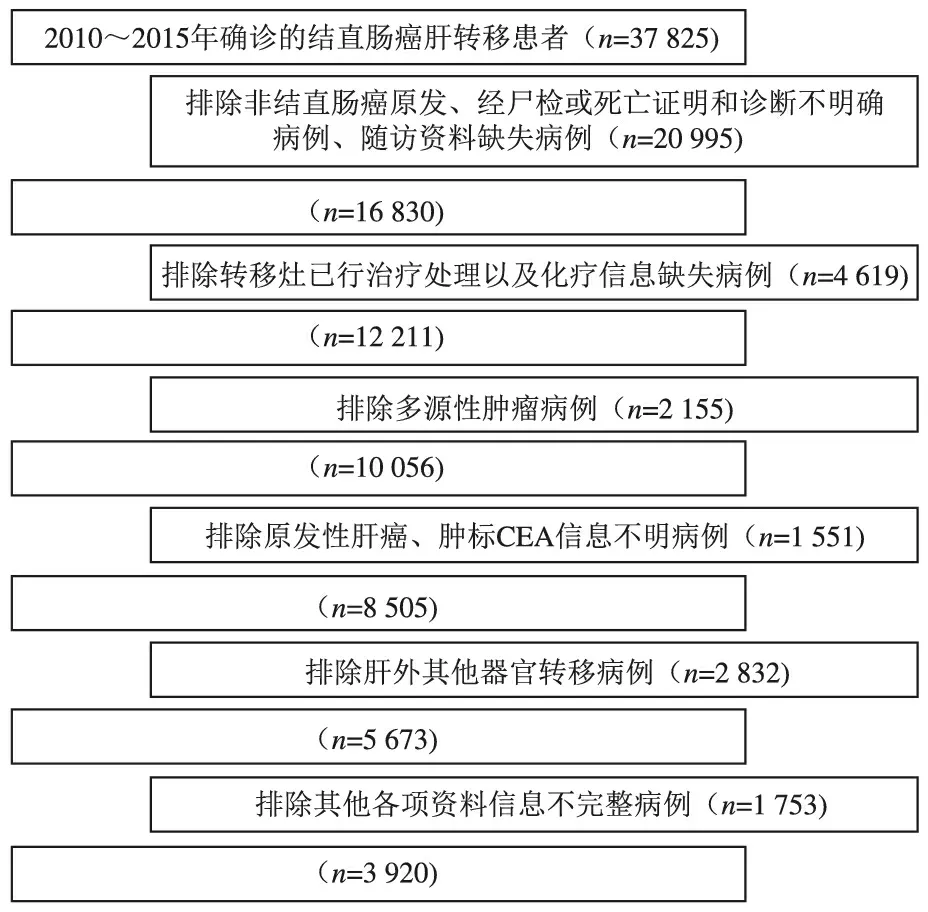
图1 病例筛选流程图
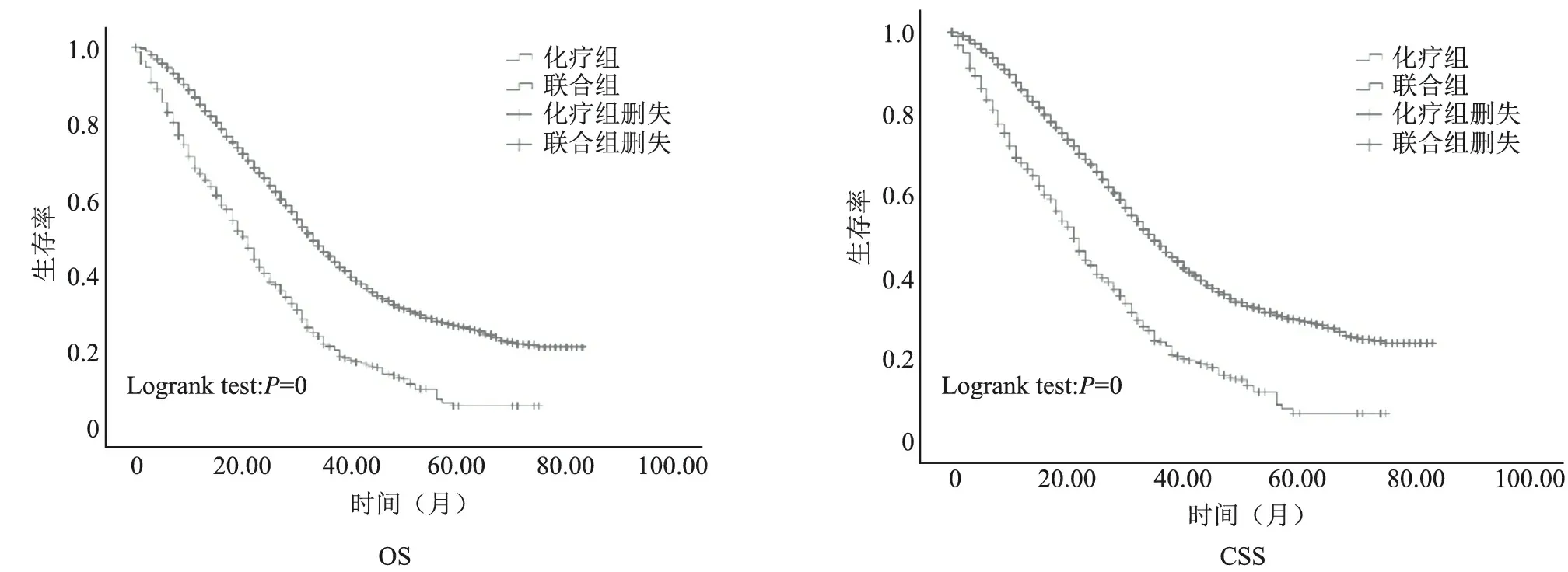
图2 匹配前两组病人的OS和CSS比较
2.匹配前后两组病人基线特征比较:在纳入研究的两组病人中,病人性别、肿瘤分级、肿瘤部位、肿瘤大小、种族、婚姻状态、T分期、N分期、CEA等比较,差异有统计学意义(P<0.05)。采用PSM匹配方法平衡两组基线特征差异后,最终按1∶1比例匹配筛选出1 168例病人,其中化疗组和联合组分别584例。对匹配后两组病例特征进行分析后显示,两组病例的倾向性评分分布具有一致性,并且匹配评分效果稳定可靠,这说明匹配后两组的病例数据具有更好的可比性。基于此基础,比较匹配后的两组病人基线特征差异情况,结果显示,两组病人基线特征差异明显缩小(表1)。
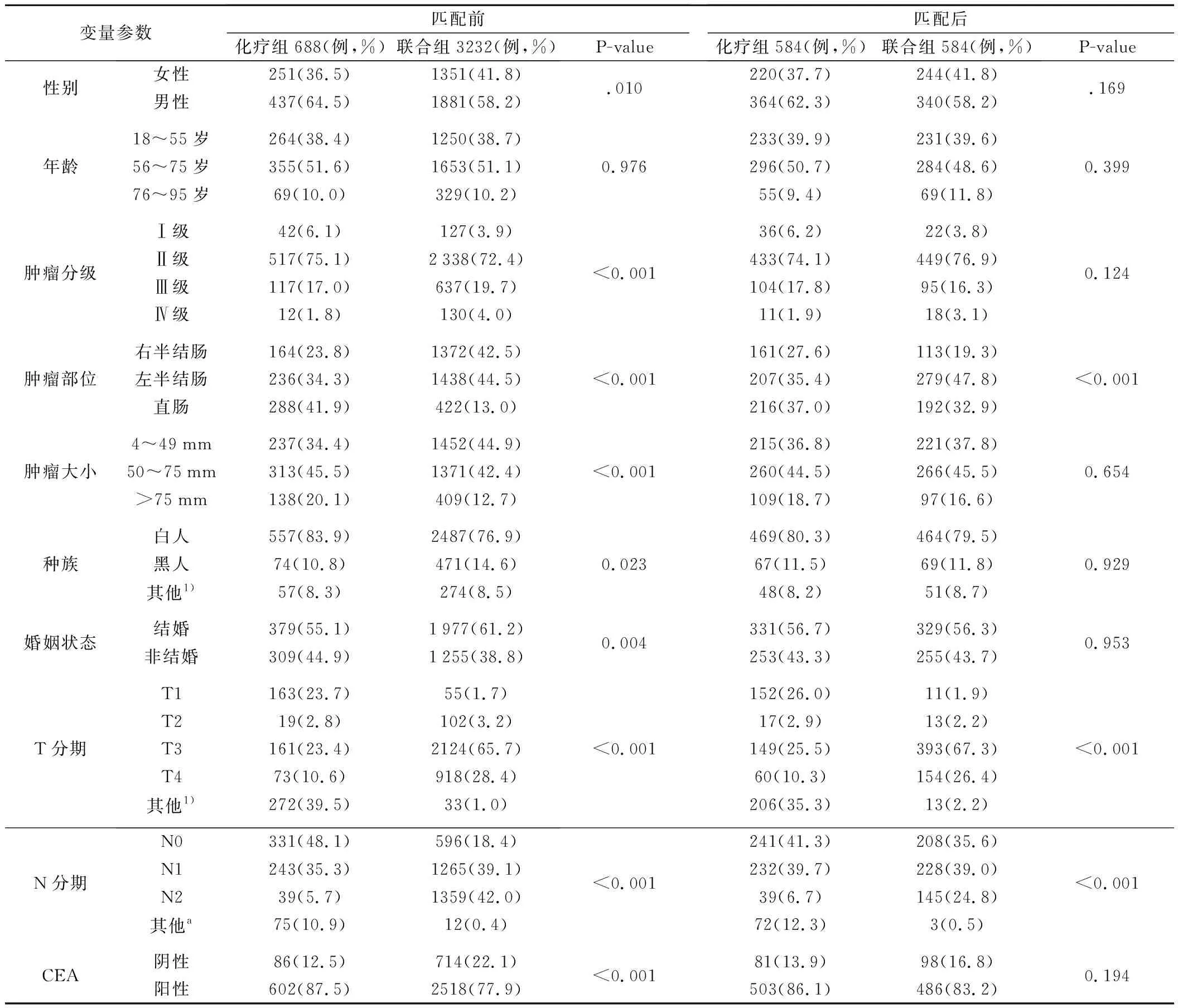
表1 两组匹配前后人口学及肿瘤基线特征比较
3.匹配后两组病人生存资料的比较:匹配后分别对两组病人预后情况进一步验证分析,结果显示:化疗组病人总体中位生存时间为21个月(95%CI:19.32~22.68),肿瘤特异性中位生存时间为21个月(95%CI:19.12~22.88);联合组总体中位生存时间为35个月(95%CI:31.59~38.40),肿瘤特异性中位生存时间为38个月(95%CI:34.25~41.75)。Kaplan-Meier生存曲线分析显示,两组差异均有统计学意义(P<0.05),结果进一步肯定CRLM病人采用联合原发灶切除的治疗较单纯化疗具有更高的临床应用价值(图3)。

图3 匹配后两组病人OS和CSS的比较
4.匹配后联合组病人的预后影响因素分析见表3。在PSM匹配改善两组病人基线特征差异后,利用Cox风险回归模型对联合组中病人的生存预后进行单因素分析,纳入变量包括性别、年龄、肿瘤分级、肿瘤部位、肿瘤大小、种族、婚姻状态、肿瘤T分期、肿瘤N分期、放疗和CEA等11个主要指标(表2)。筛选其中具有统计学意义的变量纳入多因素分析,最终结果显示,年龄、肿瘤N分期、肿瘤部位、放疗和婚姻状态等5个因素是影响CRLM病人化疗联合原发灶手术切除后生存预后的独立危险因素。
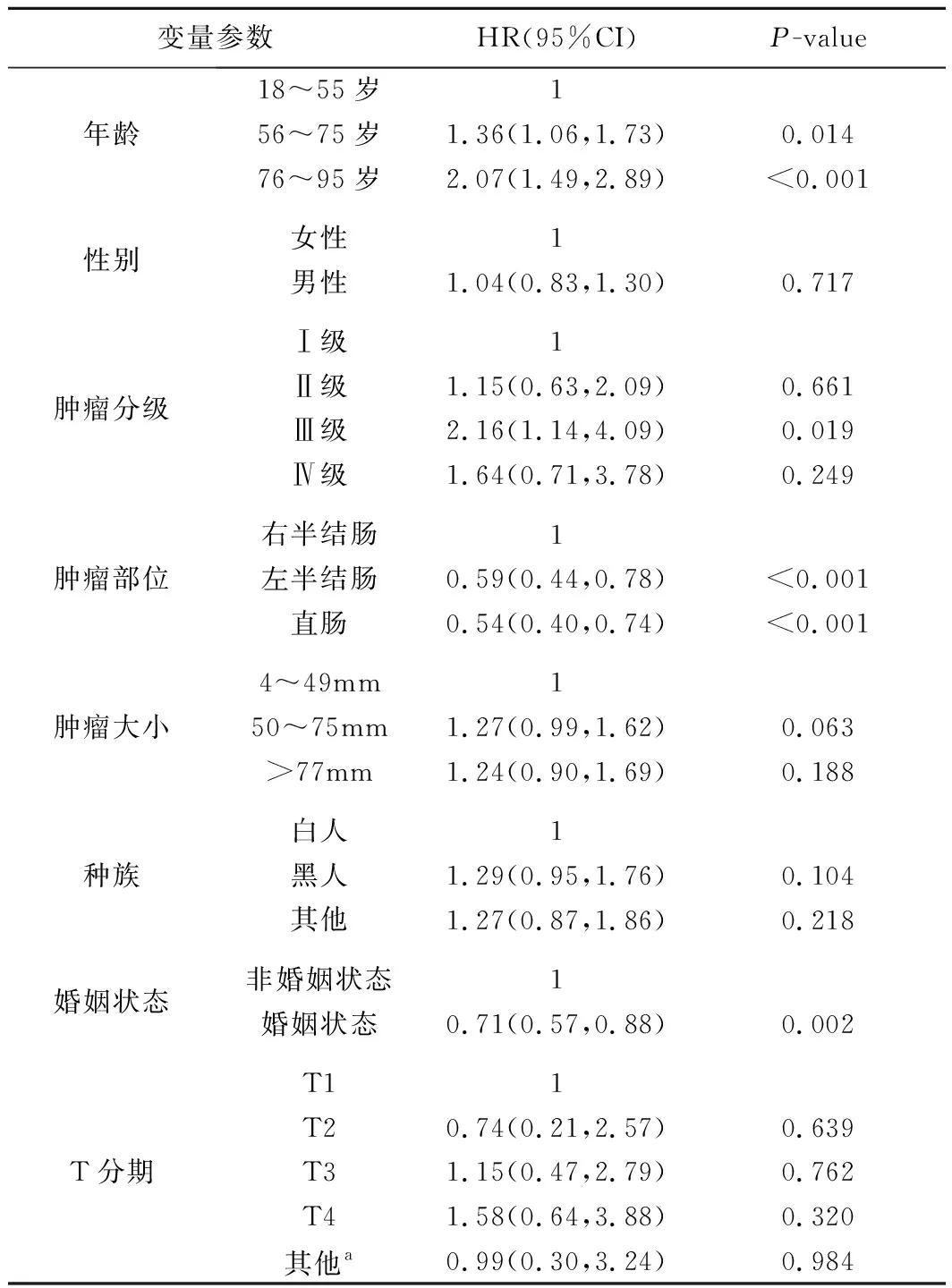
表2 CRLM病人化疗联合手术治疗的单因素分析
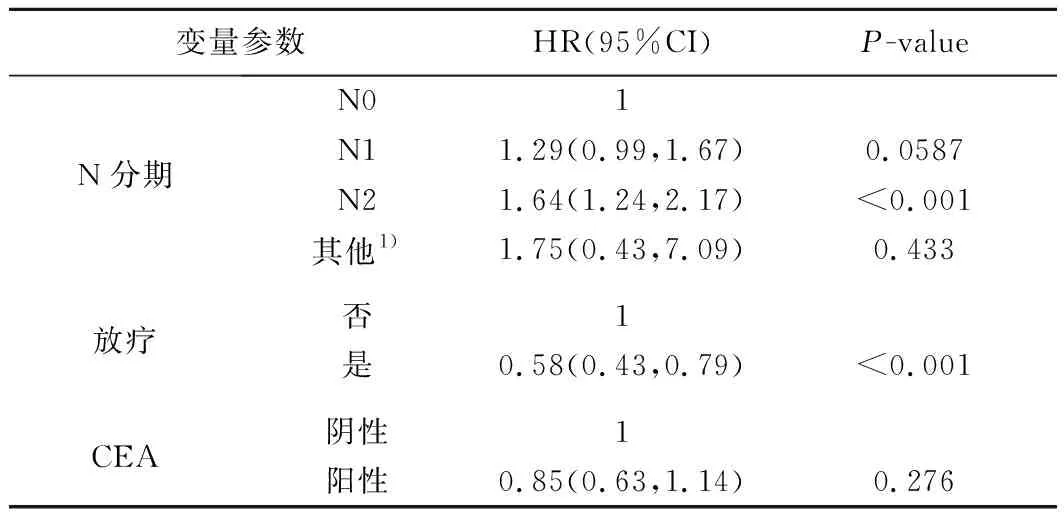
续表2
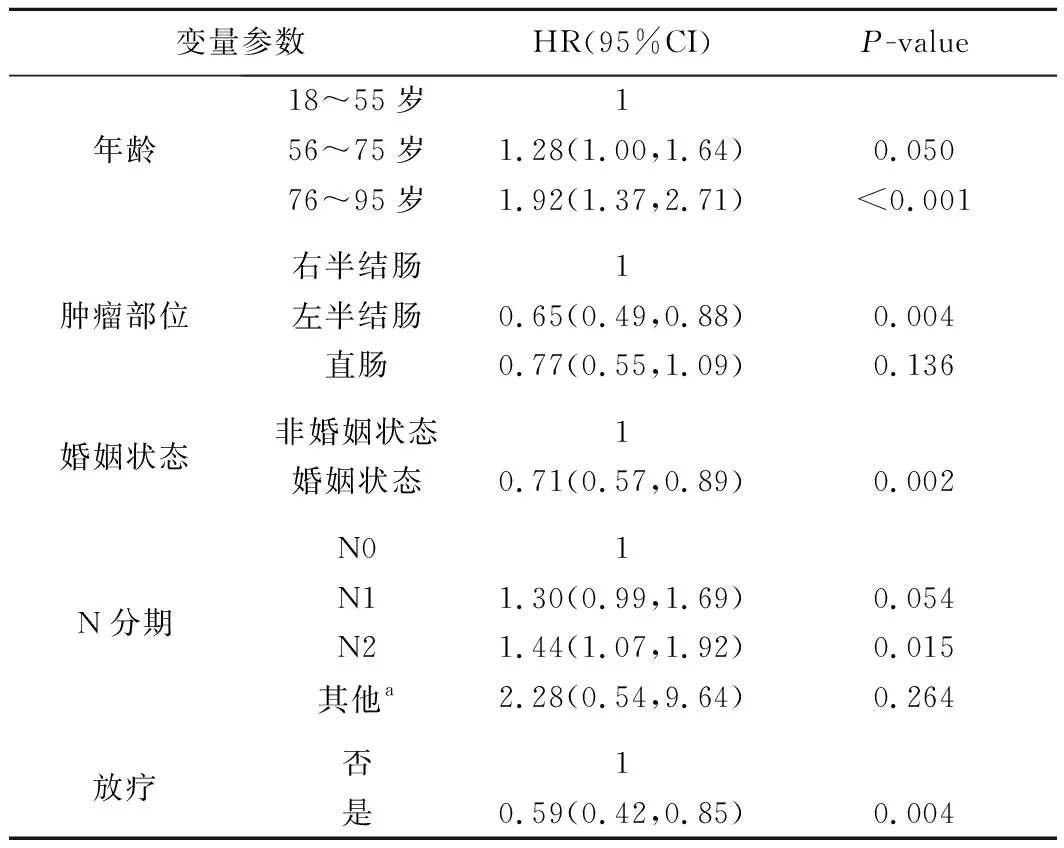
表3 CRLM病人化疗联合手术治疗的多因素分析
讨论
目前,CRLM病人的治疗一直是普通外科学者关注的重点,该疾病较差的临床预后,使得病人有效的治疗受到严重挑战。对于转移灶的处理,多主张在条件允许的情况下采取同时性切除术以改善病人预后[11],但对于不可手术切除转移灶的病言,治疗方案则多根据多学科诊疗团队协商完成,而其中对于结直肠癌原发病灶的处理目前仍然未获得一致意见。因此,在当前CRLM治疗进展的背景下,对原发灶手术切除进行大样本的研究将具有重要的价值。
SEER数据库样本量大、结论说服力强,目前已被广大临床研究者采纳。PSM减少了各混杂因素和选择性倾向对研究结果的影响,是一种能够同时匹配多个变量因素从而平衡基线差异的方法[12-13]。在本研究中,我们利用SEER数据库中的大量真实临床数据,利用PSM方法研究了结直肠癌的原发灶切除对不可切除转移灶的CRLM病人预后生存的影响。结果显示,匹配前后联合手术组均较单纯化疗组病人的OS和CSS显著延长,说明原发灶切除对病人的长期生存预后具有明显的优势。其可能原因:一方面,有研究显示血管内皮生长因子(VEGF)和表皮生长因子受体(EGFR)在结直肠癌肝转移的形成和发展过程中具有重要作用,原发肿瘤中VEGF和EGFR表达的增加不利于病人预后,手术的切除抑制了其表达[14-15]。同时研究发现,原发病灶的存在可能还具有诱导转移灶癌旁组织产生有利于肿瘤细胞侵袭、转移和生长繁殖等所需要的肿瘤微环境的作用,并且原发灶中肿瘤干细胞的存在也增加了VEGF的表达,从而诱导血管的新生,共同促进肿瘤的发展[16-17]。除此之外,结直肠癌原发灶中炎症因子的持续存在也可影响肿瘤的发展,其中以IFN-γ、IL-10等为代表的炎症因子,通过发挥抗肿瘤免疫或诱导肿瘤免疫耐受等过程调节肿瘤的发展[18]。因此,结直肠癌原发灶的切除可能转变了上述各种不利影响因素,从而改善CRLM病人的预后。另一方面,随着现代微创理念的不断深入,各种微创技术如腹腔镜辅助手术、机器人辅助手术的逐步发展成熟,这提高了肿瘤原发灶的手术切除效果、减少了不良反应、缩短了术后恢复时间,这使得病人具有较高的生活质量并且也能够较早地开始全身的系统性化疗,从而提高病人预后[19-20]。
针对病人的独立预后因素分析中,肿瘤原发部位对病人的预后影响目前仍具有争议。有学者认为,肿瘤原发位置对CRLM病人术后的长期生存预后改善无明显差异[21],而部分学者却认为,与左侧原发病灶相比,右侧原发病灶的病人预后不良因素较多且预后较差[22-23]。本研究结果支持后者的观点,右半结肠病灶病人OS和CSS均较左半结肠病人更短,同时还展示出原发灶位于直肠的病人预后风险也相对较低。近年来研究发现,婚姻状态可能对结直肠癌病人的预后具有重要影响[24]。本次研究初次探讨了婚姻状态对CRLM病人生存预后的影响,结果显示,较非婚姻状态的病人而言,处于婚姻状态的病人均可在OS和CSS方面获益。除此之外,本研究结果还展示出病人高龄、较晚的N分期以及未行放疗等因素是影响CRLM病人生存预后的独立危险因素。
综上所述,对于转移灶不可切除而能耐受手术的CRLM病人,结直肠癌原发灶的切除对于病人的生存预后是有益的。但是,本研究也存在着一定的不足之处,尽管本研究以SEER数据库中大量的真实数据为基础,但比如病人的具体手术方式、化疗方案及疗程、放疗剂量和时间、肿瘤转移时间和数目以及其他更多的检验指标等数据还有所缺乏。另一方面,虽然利用PSM法对病人的基线特征差异进行了平衡,但是由于存在多种因素的相互影响,仍有部分参量无法取得平衡。因此,未来仍需要多中心的、大样本的循证医学证据进行进一步的验证。

