超早期和早期血管内介入治疗Hunt-Hess高分级颅内动脉瘤破裂的临床疗效
张 泉,徐剑峰,韩华强,徐庆余,何 鑫
颅内动脉瘤是一种由于脑动脉管壁缺陷或血管内压力增高引起动脉壁瘤状膨出,主要并发症为蛛网膜下腔出血[1]。颅内动脉瘤早期无明显症状,若合并高血压,病情持续进展,导致病人陷入危险。颅内动脉瘤病情较重时主要临床表现为剧烈头痛、呕吐、视力视野障碍等,若不及时就诊,延误诊断及治疗,导致动脉瘤破裂,引发颅内大出血,将严重威胁病人生命安全[2-3]。临床常采用Hunt-Hess分级表示动脉瘤破裂病情轻重程度,Ⅰ~Ⅲ级病人病情较轻,出血较少,保守治疗一般效果显著;Ⅳ级或Ⅴ级动脉瘤破裂病人,病情较复杂,治疗方式、治疗时间窗尚未明确[4]。动脉介入栓塞术是治疗颅内血管动脉瘤的有效方法,相较于传统外科夹闭手术,疗效明显,病人预后恢复好[5]。选择动脉介入栓塞术的手术时机说法不一,娄永利等[6]研究认为早期、晚期优于中期介入栓塞;郑春秀等[7]研究认为早期介入预后良好,并发症少;顾大群等[8]研究认为超早期有利于改善预后。本研究观察超早期和早期血管内介入治疗Hunt-Hess高分级颅内动脉瘤破裂的临床疗效,现报道如下。
1 资料与方法
1.1 一般资料 采用回顾性病例对照研究,选取2016年10月—2019年12月绵阳市人民医院、绵阳市第三人民医院、绵阳四○四医院、绵阳市中医院神经外科确诊的Hunt-Hess高分级颅内动脉瘤破裂并行动脉介入栓塞术的病人144例,其中超早期(<48 h)组病人83例,早期(48~96 h)组病人61例。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。详见表1。
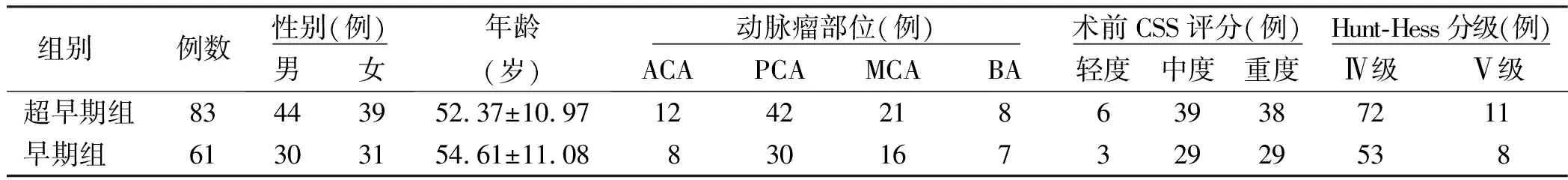
表1 两组一般资料比较
1.1.1 纳入标准 数字减影血管造影明确为动脉瘤破裂;Hunt-Hess分级Ⅳ级或Ⅴ级;入院时动脉瘤破裂≤24 h;年龄>18岁;所有病人或家属均签署手术知情同意书,病人同意并配合随访。
1.1.2 排除标准 既往由于其他疾病(脑梗死、心肌梗死等)行介入手术病人;动脉瘤巨大,因介入无法止血后行开颅手术病人;动脉瘤破裂后出血有巨大血肿需要行开颅手术清除的病人;合并颅内恶性肿瘤病人;肝、肾功能无法耐受手术病人;凝血功能异常无法手术病人。
1.2 治疗方法 超早期组发病后<48 h完成动脉介入栓塞术,早期组发病后48~96 h内完成动脉介入栓塞术,两组术前、术中及术后治疗措施一致。动脉血管栓塞术前准备:根据数字减影血管造影及临床症状等,评估病人是否需要介入辅助支架技术,需要支架治疗的病人口服负荷剂量抗血小板药物,阿司匹林300 mg(上海上药信谊药厂有限公司生产,国药准字H31020967,规格:每片300 mg)+氯吡格雷225 mg[赛诺菲(杭州)制药有限公司生产,国药准字H20056410,规格:每片0.075 g]。手术步骤:病人取平卧位,全身麻醉后气管插管,肝素化,持续泵入尼莫地平(瑞阳制药有限公司生产,国药准字H20070194,规格:每支2 mg)防止脑血管痉挛。取右侧股动脉常规消毒铺巾,根据Seldinger技术行股动脉穿刺,根据情况选择性地行血管造影并3D旋转,确定动脉瘤位置、大小、与截瘤动脉关系和弯度情况、重要穿支血管及瘤体周围血管分叉情况,根据瘤体情况选择弹簧圈栓塞动脉瘤或支架植入。术后处理:术后继续口服尼莫地平(每次60 mg,每日3次,连续治疗3周),同时给予抗感染、营养神经等对症支持治疗;若病人术中植入支架,术后24 h内行颅脑CT,明确无出血后给予双抗治疗(阿司匹林100 mg+氯吡格雷75 mg,每日1次),3个月后改为单抗治疗(阿司匹林100 mg或氯吡格雷75 mg,每日1次)3个月。
1.3 观察指标 记录两组术前及术后7 d CSS评分;术前及术后7 d检测血清神经生长因子(NGF)、脑源性神经营养因子(BDNF)和神经营养因子(NTF);术后格拉斯哥预后评分(GOS);术中血压波动及术后并发症发生情况。
2 结 果
2.1 两组手术前后NGF、BDNF及NTF比较 术后7 d,超早期组NGF、BDNF及NTF高于早期组,差异均有统计学意义(P<0.05)。详见表2及图1~图3。
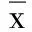
表2 两组手术前后NGF、BDNF及NTF比较(±s)

图1 两组术后NGF水平比较 图2 两组术后BDNF水平比较 图3 两组术后NTF水平比较
2.2 两组术后CSS评分及GOS评分比较(见表3)

表3 两组术后CSS评分及GOS评分比较 单位:例(%)
2.3 两组术中血压波动及术后并发症发生情况比较 超早期组术中收缩压差及舒张压差低于早期组,差异有统计学意义(P<0.01),即超早期介入治疗术中血压稳定;超早期组术后并发症发生率低于早期组,差异无统计学意义(P>0.05)。详见表4、图4。
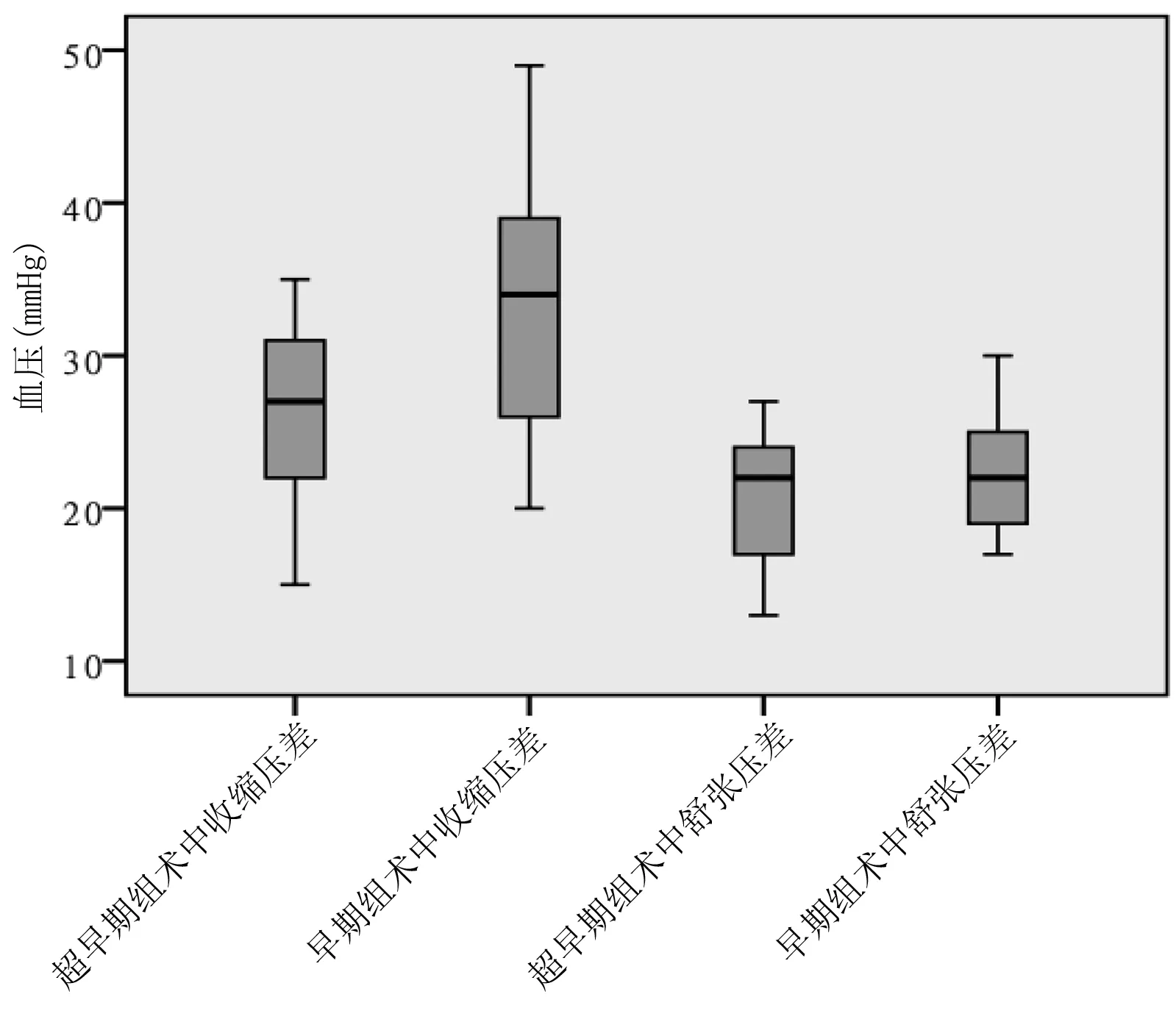
图4 两组术中血压波动情况

表4 两组术中血压波动及术后并发症发生情况比较
3 讨 论
颅内动脉瘤是指颅内动脉壁局部病理性膨胀,主要好发于颅内动脉分叉处[9],是临床常见的颅脑疾病之一。流行病学研究显示,我国颅内动脉瘤发病率为6/10万~10/10万[10],仅次于脑梗死、脑出血。我国35~75岁人群中,未破裂颅内动脉瘤患病率为7.0%[11]。目前颅内动脉瘤发病机制尚未明确,有研究发现其可能是多因素作用导致的[12],其中一个重要因素是颅内动脉中层薄弱且无外弹力层,导致血压波动易发生动脉壁膨胀畸形,其他因素包括先天性因素、动脉硬化、感染、创伤等[13]。颅内动脉瘤常见、危险的并发症为突发破裂引起蛛网膜下腔出血,其破裂发生风险为10%~20%,死亡率在50%以上,通常毫无征兆突然发病,快速加重,对病人健康造成极大威胁[14]。
颅内血管瘤传统的治疗方法为开颅动脉瘤夹闭术,但存在创伤大、术后并发症多等缺点[15]。随着医用材料[16]、微导管技术、神经影像学、显微技术不断发展,颅内血管瘤的治疗手段逐步由开放性手术转为微创手术,使较多不可治血管瘤可治。目前,临床治疗手段以颅内血管内介入疗法及显微神经外科手术较多[17]。颅内血管瘤破裂出血急性期行显微神经外科手术治疗可降低病人致残率及致死率[18-19]。相关研究显示,颅内血管瘤破裂出血超早期及早期病人行血管内介入治疗是有效的,且该方法创伤较小,有利于促进病情恢复,相较于外科手术更安全,同时存在复发率较高的缺点[20-21]。目前主要的操作方法为经股动脉Seldinger法穿刺植入导管鞘及造影导管,之后在透视下沿微导管在动脉瘤内放置合适的弹簧圈对瘤体进行填充,术后予以腰椎穿刺预防脑积水等并发症。经过不断发展,颅内动脉瘤的血管内介入治疗已从动脉瘤腔内栓塞发展至载瘤动脉重建阶段,血流导向装置的使用逐渐成为载瘤动脉重建技术的治疗热点。
血管内介入治疗颅内血管瘤的时机及术中血压的控制是重要的,尤其是对Hunt-Hess高分级颅内动脉瘤破裂合并高血压病人而言。关于Hunt-Hess高分级颅内动脉瘤破裂出血超早期及早期血管内介入治疗术中血压变化研究较少。本研究结果表明,超早期组术后CSS评分重度及GOS评分5分病人比例较早期组均改善(P<0.05),超早期组术后7 d的NGF、BDNF及NTF较早期组均升高(P<0.05),表明尽早行动脉介入栓塞术有助于改善和恢复病人神经功能,减轻颅内血性液体对脑组织的理化刺激,且超早期组术中血压波动低于早期(P<0.05)。超早期组术后并发症发生率低于早期组(P>0.05)。分析并发症减少的原因可能是由于早期控制出血,可减轻颅内血性液体对脑组织的理化刺激;控制血压一方面减轻动脉痉挛,改善血管壁弹性,可减少再出血风险,另一方面可减少血压对动脉分叉处血管壁的剪切力,减弱动脉扩张,有利于术后恢复并减少复发。相关研究报道,合并高血压是颅内动脉瘤血管内介入治疗预后不良的影响因素[22-23]。
综上所述,超早期动脉血管介入栓塞治疗Hunt-Hess高分级颅内动脉瘤破裂较早期有助于改善和恢复病人术后神经功能,减轻颅内血性液体对脑组织的理化刺激,避免颅内迟发性脑血管痉挛,减轻脑灌注不足后出现脑缺血症状,且超早期介入栓塞术术中血压稳定状况均优于早期组。因此,有手术条件行颅内动脉瘤破裂后介入栓塞病人,尽量在48 h内完成手术。

