恒清Ⅱ号方联合盐酸多奈哌齐治疗阿尔茨海默病并发睡眠障碍的临床研究
孟胜喜,霍清萍,王 兵,陈慧泽,李文涛,潘卫东,曹健美
阿尔茨海默病是发生在老年期或老年前期的一种慢性进行性中枢神经系统变性疾病,以进行性智力减退、情感和人格改变为主要特征。约44%的阿尔茨海默病病人伴发睡眠障碍[1]。越来越多的证据表明,睡眠障碍是阿尔茨海默病的危险因素之一。本研究应用中药恒清Ⅱ号方联合盐酸多奈哌齐治疗阿尔茨海默病并发睡眠障碍,探讨其临床作用机制。
1 资料与方法
1.1 临床资料 选取2019年1月—2020年1月上海市第六人民医院收治的阿尔茨海默病并发睡眠障碍病人105例,采用随机数字表法分为对照组和观察组,其中对照组52例,观察组53例。两组临床资料比较,差异均无统计学意义(P>0.05),具有可比性,详见表1。本研究经上海市第六人民医院伦理委员会审核批准。

表1 两组临床资料比较
1.2 病例选择标准
1.2.1 诊断标准 阿尔茨海默病诊断标准参照美国《神经疾病诊断和统计手册》第4版[2];睡眠功能障碍及睡眠质量采用匹兹堡睡眠质量指数量表(PSQI)评定,评分0~21分,得分越高提示睡眠质量越差,>7分为睡眠功能障碍[3]。
1.2.2 纳入标准 所有病人均严格按照《精神障碍诊断与统计手册》(第5版,DSM-5)[4]关于“痴呆”和“痴呆性睡眠障碍”确诊;年龄60~85岁;对本研究使用药物无过敏及使用禁忌证;病人和(或)家属对本研究知情并签署知情同意书。
1.2.3 排除标准 其他原因导致的认知功能障碍;年龄<60岁或>85岁;患有导致睡眠障碍的疾病如夜尿症等;有心血管、肝、肺、肾基础疾病较重的病人以致无法配合量表检查;服用影响睡眠的药物或接受影响睡眠的治疗,可能对研究结果产生影响;依从性差;有精神疾病。
1.3 方法
1.3.1 基础治疗 根据病人基础疾病给予相应的降压、降糖、调脂、抗血小板聚集等治疗,进行读书、看报等活动,适当体育锻炼,调节情志,饮食指导等。
1.3.2 对照组 除了基础治疗,给予盐酸多奈哌齐片[商品名:安理申,卫材(中国)药业有限公司生产,国药准字H20050978;批号:1705080,规格:每片5 mg],起始剂量每日5 mg,每晚睡前口服,4周后增至最大剂量每日10 mg,疗程为3个月。
1.3.3 观察组 除了基础治疗,给予恒清Ⅱ号方+盐酸多奈哌齐片治疗,恒清Ⅱ号方组方:益智仁30 g,黄芪15 g,菟丝子10 g,川芎10 g,熟地黄15 g,桑寄生10 g,煅石决明10 g,杜仲10 g,地龙10 g,天麻10 g,钩藤10 g。中药由上海市第六人民医院中药房提供,水煎250 mL(其中地龙研磨成粉,加入汤剂冲服),早晚分服,每日1剂。盐酸多奈哌齐片用法同对照组,疗程为3个月。
1.4 观察指标
1.4.1 简易精神状态量表(MMSE) 应用MMSE评定病人精神状态,MMSE包括定向力、记忆力、回忆力、语言能力、注意力与计算力5个部分,共30道题,得分越高提示精神状态越好。
1.4.2 阿尔茨海默病认知功能评定量表(ADAS-cog) ADAS-cog评定病人认知功能,包括12个条目,评分范围0~75分,得分越高提示认知受损越严重。
1.4.3 日常生活活动能力量表(ADL) 采用ADL[5]评定病人日常生活能力,共20个条目,得分越高提示日常生活能力越差。
1.4.4 社会表现量表(PSP)评分和激越行为量表(CMAI)评分 PSP得分越高提示社会表现能力越强;CMAI得分越高提示激越行为越严重。
1.4.5 PSQI PSQI[6]是由19个自评条目和5个他评条目组成,其中18个条目组成7个睡眠因子,包括入睡时间、睡眠质量、睡眠时间、睡眠效率、睡眠障碍、催眠药使用、日间功能障碍。每项因子按0~3分评定,7个睡眠因子累计评分为PSQI总分,范围为0~21分。
1.4.6 睡眠日记 包括入睡潜伏期、总觉醒时间、总睡眠时间及睡眠效率等。
1.4.7 失眠严重指数量表(ISI) ISI共7个条目,包括睡眠满意度、日间功能、因睡眠引起的注意力受损、失眠的痛苦程度及对失眠的关注程度。采用0~4分5级评分,总分0~28分,得分越高提示失眠越严重。
1.4.8 睡眠个人信念与态度量表(DBAS-16) DBAS-16[7]包括4个分量表:睡眠要求、失眠恐惧、害怕失眠后果、担心药物。总评分16~90分,评分越低提示错误的信念越严重。
1.4.9 贝克抑郁量表(BDI) BDI[8]评定抑郁症状严重程度,共13个条目,每个条目分为0~3级评分,BDI得分越高提示抑郁越严重。
1.4.10 贝克焦虑量表(BAI) BAI[9]用于评估焦虑症状严重程度。共21个项目,采用1~4级评分,BAI得分越高提示焦虑越严重。
1.4.11 阿森斯失眠量表(AIS) AIS[10]包括入睡时间、夜间苏醒、比期望的时间早醒、总睡眠时间、总睡眠质量、白天情绪、白天身体功能、白天思睡,共8个条目,每项从无到严重按0~3分4级评分,各项自评累积评分即为AIS总分,总分范围0~24分。AIS总分越高提示睡眠质量越差。
1.4.12 血清5-羟色胺(5-HT)、脑源性神经营养因子(BDNF)、P物质(SP)、多巴胺(DA)水平 5-HT、SP、BDNF于治疗前后抽取病人清晨空腹静脉血5 mL,采用酶联免疫吸附法(ELISA)检测血清5-HT、BDNF、SP水平,严格按照说明书进行操作。DA含量测定:分别于治疗前后抽取晨起空腹肘静脉血3~5 mL,以3 200 r/min离心5 min后取上清液,置于低温冰箱-40 ℃保存备用。DA采用RF1540 荧光分光光度计(日本岛津公司)。
1.4.13 血清炎性因子白细胞介素-1β(1L-1β)、白细胞介素-6(IL-6)、白细胞介素-10(IL-10)、C-反应蛋白(CRP)及肿瘤坏死因子α(TNF-α)水平 分别于治疗前后抽取清晨外周静脉血5 mL,常规离心抗凝提取血清样本,采用ELISA检测IL-1β,严格按照试剂盒说明书进行操作。检测IL-6、IL-10、TNF-α及CRP,采用ELISA检测,试剂盒购于R&D公司(USA)。
1.4.14 不良反应发生情况 观察两组治疗过程中不良反应发生情况,比较不良反应发生率。
2 结 果
2.1 两组MMSE、ADAS-cog、ADL、PSP及CMAI评分比较 治疗前,两组MMSE、ADAS-cog、ADL、PSP及CMAI评分比较,差异均无统计学意义(P>0.05)。治疗后,两组MMSE及PSP评分较治疗前均升高,ADAS-cog、ADL及CMAI评分较治疗前均降低,差异均有统计学意义(P<0.05或P<0.01);与对照组治疗后比较,观察组MMSE及PSP评分均升高,ADAS-cog、ADL及CMAI评分均降低,差异均有统计学意义(P<0.05或P<0.01)。详见表2。
表2 两组MMSE、ADAS-cog、ADL、PSP及CMAI评分比较(±s) 单位:分
2.2 两组PSQI总分及各因子评分比较 治疗前,两组PSQI总分及各因子评分比较,差异均无统计学意义(P>0.05)。治疗后,两组PSQI总分及各因子评分较治疗前均降低,差异均有统计学意义(P<0.05或P<0.01);与对照组治疗后比较,观察组PSQI总分及各因子评分均降低,差异均有统计学意义(P<0.05或P<0.01)。详见表3。
表3 两组PSQI总分及各因子评分比较(±s) 单位:分
2.3 两组睡眠日记各因子评分比较 治疗前,两组睡眠日记各因子入睡潜伏期、总觉醒时间、总睡眠时间及睡眠效率比较,差异均无统计学意义(P>0.05)。治疗后,两组入睡潜伏期及总觉醒时间较治疗前均缩短,总睡眠时间延长,睡眠效率提高,差异均有统计学意义(P<0.05或P<0.01);与对照组治疗后比较,观察组入睡潜伏期及总觉醒时间均缩短,总睡眠时间延长,睡眠效率提高,差异均有统计学意义(P<0.05或P<0.01)。详见表4。
表4 两组睡眠日记各因子评分比较(±s) 单位:分
2.4 两组ISI、BDI、BAI、AIS、DBAS-16总分及各因子评分比较 治疗前,两组ISI评分、DBAS-16总分及各因子评分、BDI、BAI、AIS评分比较,差异均无统计学意义(P>0.05)。治疗后,两组ISI、BDI、BAI及AIS评分较治疗前均降低,DBAS-16总分及各因子评分较治疗前均升高,差异均有统计学意义(P<0.05或P<0.01);与对照组治疗后比较,观察组ISI、BDI、BAI及AIS评分均降低,DBAS-16总分及各因子评分均升高,差异均有统计学意义(P<0.05或P<0.01)。详见表5。
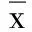
表5 两组ISI、BDI、BAI、AIS、DBAS-16总分及各因子评分比较(±s) 单位:分
2.5 两组血清5-HT、SP、BDNF、DA、IL-1β、IL-6、IL-10、CRP、TNF-α、BDNF水平比较 治疗前,两组血清5-HT、BDNF、SP、IL-1β、IL-6、IL-10、CRP及TNF-α水平比较,差异均无统计学意义(P>0.05)。治疗后,两组血清5-HT、BDNF及DA水平较治疗前均升高,SP、IL-1β、IL-6、IL-10、CRP及TNF-α水平较治疗前均降低,差异均有统计学意义(P<0.05或P<0.01);与对照组治疗后比较,观察组血清5-HT、BDNF及DA水平均升高,SP、IL-1β、IL-6、IL-10、CRP及TNF-α水平均降低,差异均有统计学意义(P<0.05或P<0.01)。详见表6。
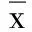
表6 两组血清5-HT、BDNF、SP、IL-1β、IL-6、IL-10、CRP、BDNF及TNF-α水平比较(±s)
2.6 两组不良反应发生情况比较 观察组不良反应发生率低于对照组(1.89%和7.69%,P>0.05)。详见表7。

表7 两组不良反应发生情况比较 单位:例(%)
3 讨 论
阿尔茨海默病属于中医学“痴呆”“呆症“健忘”等范畴,病理性质为本虚标实,以肾虚为本,痰浊、瘀血为标。病位主要在脑,涉及心、肝、脾、肺及肾各脏,根本病机为肾虚痰瘀。本课题组遵循中医理论,经过长期临床探索并总结治疗阿尔茨海默病疗效明确的中药复方恒清Ⅱ号方[11-13],并获得国家专利(No.ZL201910371018.5)。
由表2可知,与对照组治疗后比较,观察组MMSE及PSP评分均升高,差异均有统计学意义(P<0.05或P<0.01);ADAS-cog、ADL及CMAI评分均降低,差异均有统计学意义(P<0.05或P<0.01)。表明恒清Ⅱ号方联合盐酸多奈哌齐片可改善阿尔茨海默病病人精神状态、认知功能、生活能力、社会表现能力及激越行为。
由表3~表5可知,与对照组治疗后比较,观察组PSQI总分及各因子评分均降低,观察组入睡潜伏期及总觉醒时间均缩短,总睡眠时间延长,睡眠效率提高,差异均有统计学意义(P<0.05或P<0.01);观察组ISI、BDI、BAI及AIS评分均降低,DBAS-16总分及各因子评分均升高,差异均有统计学意义(P<0.05或P<0.01)。由表7可知,观察组不良反应发生率低于对照组(P>0.05)。表明恒清Ⅱ号方联合盐酸多奈哌齐片可改善阿尔茨海默病并发睡眠障碍病人临床症状。
5-HT可调节大脑智能[14-15],也可调节睡眠-觉醒周期[16]。DA可调节额叶记忆功能[17],也可维持觉醒和行为兴奋[18]。5-HT和DA在机体睡眠-觉醒过程中发挥着重要作用[19]。BDNF在维持损伤后修复与再生及缓解神经元应激后反应中发挥重要作用[20]。脑缺血后病人BDNF可保护神经元[21]。BNDF可诱导睡眠和维持睡眠[22]。SP可延缓老年斑的病理进展,与单胺类神经递质相互协调,共同参与昼夜生物节律的调控[23]。炎症反应在痴呆的发生与发展、脑梗死及之后的继发性神经损伤过程中均发挥着重要作用[24-26]。失眠病人体内存在明显的持续性低度炎症反应,部分炎性因子如CRP、IL-6、TNF-α与睡眠相关[27-29]。血清IL-1β、IL-6及TNF-α均具有调节睡眠的作用[30-32]。由表6可知,与对照组治疗后比较,观察组血清5-HT、BDNF及DA水平均升高,血清SP、IL-1β、IL-6、IL-10、CRP、TNF-α水平均降低,差异均有统计学意义(P<0.05或P<0.01)。
综上所述,恒清Ⅱ号方联合盐酸多奈哌齐片治疗阿尔茨海默病并发睡眠障碍,不仅可改善病人精神状态、认知功能、生活能力、社会表现能力及激越行为,还可改善睡眠障碍,且安全性高,其机制可能与升高血清5-HT、BDNF及DA水平,降低SP、IL-1β、IL-6、IL-10、CRP、TNF-α水平有关。

