响应面法优化纳豆芽孢杆菌发酵制备多肽螯合钙工艺
孙晓富,董 超*,李文静,张丰文
(河北省科学院生物研究所,河北 石家庄 050000)
钙元素是人体骨骼和牙齿的重要组成部分,在人体生物代谢活动中有着重要作用,当钙摄入量不足或生物利用率低时,可使机体造成钙的缺乏,导致佝偻症、骨质疏松等疾病的发生[1]。据最新中国居民营养与健康状况监测数据显示[2-3],我国城乡居民人均日摄入钙366.1 mg,不足推荐摄入量(800 mg)的50%,达到适宜摄入量的人群不足5%,国民对补钙的健康需求较大[4]。我国补钙产品的发展历程大概分为三代:一代碳酸钙为无机钙,二代是以柠檬酸钙、乳酸钙和葡萄糖酸钙等有机盐钙为主,这两代补钙产品的溶解性差、对胃有强烈刺激、生物利用率低,摄入不当会对人体有一定程度的副作用,如引发动脉粥样硬化痉挛或肾结石等疾病;氨基酸及多肽螯合钙作为第三代补钙制剂具有易吸收、稳定性好、安全性高等优点[5-7],市场发展前景广阔。
大豆是人体所需蛋白质的重要来源之一,含有18种氨基酸,包括9种人体必需氨基酸[8]。牛骨粉中60%~65%为矿物质,几乎包含了人体所需的全部矿物质成分,其中钙含量达到19%,具有人体吸收的最佳钙磷比,但牛骨粉中的钙主要以羟基磷灰石钙为主要存在形式,并且与胶原蛋白形成紧密结构,不易被人体吸收[9-10]。纳豆芽孢杆菌(Bacillus natto)在发酵过程中分泌蛋白酶,可以将大豆蛋白分解成更易人体吸收的小分子肽和氨基酸,也可以将牛骨粉中的胶原蛋白分解为多肽[11-12],有利于其中钙的析出和溶解。
本研究以牛骨粉和大豆粉为主要原料,选用纳豆芽孢杆菌SWS-001发酵制备多肽螯合钙,并以螯合钙含量为响应值,采用单因素试验及响应面试验对其制备工艺进行优化,为多肽螯合钙的工业化生产提供理论依据和技术支持。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
大豆:黑龙江大豆生产基地;牛骨粉(宏越7710X):市售;纳豆芽孢杆菌(Bacillus natto)SWS-001(CGMCC No.17226):河北省生物所微生物室保存。
1.1.2 试剂
乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)(分析纯):北京化工厂;无水乙醇(分析纯):天津永大化学试剂有限公司;其他试剂均为国产分析纯。
1.1.3 培养基
种子培养基[13]:蛋白胨1%,牛肉浸膏0.5%,NaCl 0.5%,pH值7.5,121 ℃高压灭菌30 min。
液体发酵培养基[14-15]:牛骨粉3%,大豆粉5%,葡萄糖0.5%,KH2PO40.2%,K2HPO4·3H2O 0.52%,MgSO4·7H2O 0.1%,pH值7.5,121 ℃高压灭菌30 min。
1.2 仪器与设备
75004250 Heraeus Multifuge X1R离心机:美国Thermo Fisher Scientific公司;MLS-3020高压蒸汽灭菌锅:日本SANYO公司;SKY-2102C恒温培养振荡器:上海苏坤实业有限公司。
1.3 方法
1.3.1 螯合钙的制备工艺
将斜面保存的纳豆芽孢杆菌(Bacillus natto)SWS-001接种于种子培养基,于33 ℃、200 r/min条件下发酵8 h;将种子液按4%(V/V)的接种量接种于液体发酵培养基,于33 ℃、200 r/min条件下发酵60 h。
1.3.2 螯合钙制备工艺优化单因素试验
以液体发酵培养基为基础,通过单因素试验依次分别考察牛骨粉(2%、3%、4%、5%、6%)、大豆粉(1%、3%、5%、7%、9%)、葡萄糖(0.1%、0.3%、0.5%、0.7%、0.9%)、KH2PO4(0.10%、0.15%、0.20%、0.25%、0.30%)、K2HPO4·3H2O(0.26%、0.39%、0.52%、0.65%、0.78%)、MgSO4·7H2O(0.05%、0.10%、0.15%、0.20%、0.25%)添加量对纳豆芽孢杆菌SWS-001发酵产螯合钙的影响,确定最佳培养基组成。
1.3.3 螯合钙制备工艺优化Plackett-Burman试验
结合单因素试验结果,选取各因素适宜的水平范围,采用Plackett-Burman(PB)法[16]对影响螯合钙生成的6种因素进行评估。PB试验因素与水平见表1,各因素设计高低(1和-1)2个水平,以螯合钙含量(Y)为响应值,对6个试验因素进行显著性分析,筛选出具有显著影响的因素。

表1 螯合钙制备工艺优化Plackett-Burman试验因素与水平Table 1 Factors and levels of Plackett-Burman tests for chelated calcium preparation process optimization
1.3.4 螯合钙制备工艺优化响应面分析
结合单因素试验和PB试验的结果,根据Box-Behnken试验设计原理[17-18],以螯合钙(Y)含量为响应值,牛骨粉含量(A)、大豆粉含量(B)、葡萄糖含量(C)为自变量,进行3因素3水平的响应面试验优化,试验设计因素与水平见表2。

表2 螯合钙制备工艺优化响应面试验因素与水平Table 2 Factors and levels of response surface tests for chelating calcium preparation process optimization
1.3.5 螯合钙的测定方法
发酵液在4 ℃、4 000 r/min条件下离心10 min,取上清液5 mL逐滴加入45 mL无水乙醇中充分混匀振荡,静置30 min后于4 ℃、8 000 r/min条件下离心20 min,弃上清,沉淀即为螯合钙粗提物[19]。沉淀中加入10 mL 2 mol/L的盐酸进行水解,参考文献[20]的EDTA络合滴定法测定螯合态钙的含量。
2 结果与分析
2.1 发酵工艺优化单因素试验
2.1.1 不同牛骨粉含量对螯合钙产量的影响
不同牛骨粉含量对纳豆芽孢杆菌SWS-001发酵产螯合钙的影响见图1。由图1可知,随着牛骨粉含量的增加,螯合钙产量呈先升高后降低的趋势,当牛骨粉含量为4%时,螯合钙的产量达到最高,为(600.89±13.44)mg/L。因此,确定最佳牛骨粉含量为4%。

图1 不同牛骨粉含量对螯合钙产量的影响Fig.1 Effect of different bovine bone powder contents on the yield of chelated calcium
2.1.2 不同大豆粉含量对螯合钙产量的影响
由图2可知,螯合钙产量呈先升高后降低的趋势,当大豆粉含量为5%时,螯合钙的产量达到最高,为(565.97±6.72)mg/L。因此,确定最佳大豆粉含量为5%。

图2 不同大豆粉含量对螯合钙产量的影响Fig.2 Effect of different soybean powder contents on the yield of chelated calcium
2.1.3 不同葡萄糖含量对螯合钙产量的影响
由图3可知,随着葡萄糖含量的升高,螯合钙产量呈先升高后降低的趋势。当葡萄糖含量为0.5%时,螯合钙的产量达到最高,为(554.33±13.44)mg/L。因此,确定葡萄糖的最佳含量为0.5%。

图3 不同葡萄糖含量对螯合钙产量的影响Fig.3 Effect of different glucose contents on the yield of chelated calcium
2.1.4 不同KH2PO4含量对螯合钙产量的影响
由图4可知,随着KH2PO4含量的升高,螯合钙产量呈先升高后降低的趋势;当KH2PO4含量为0.20%时,螯合钙的产量达到最高,为(573.73±29.30)mg/L。因此,确定KH2PO4的最佳含量为0.20%。

图4 不同KH2PO4含量对螯合钙产量的影响Fig.4 Effect of different KH2PO4 contents on the yield of chelated calcium
2.1.5 不同K2HPO4·3H2O含量对螯合钙产量的影响
由图5可知,随着K2HPO4·3H2O含量的增加,螯合钙产量呈先升高后降低且整体平缓的趋势,可见K2HPO4·3H2O含量对螯合钙的生成影响不大[21]。当K2HPO4·3H2O含量为0.52%时,螯合钙的产量达到最高,为(577.61±6.72)mg/L。因此,确定K2HPO4·3H2O的最佳含量为0.52%。

图5 不同K2HPO4·3H2O含量对螯合钙产量的影响Fig.5 Effect of different K2HPO4·3H2O contents on the yield of chelated calcium
2.1.6 不同MgSO4·7H2O含量对螯合钙产量的影响
由图6可知,随着MgSO4·7H2O含量的增加,螯合钙产量整体呈现降低的趋势,当MgSO4·7H2O含量>0.10%之后,螯合钙的产量随MgSO4·7H2O含量的增加而降低;这可能是由于金属离子在一定浓度范围内对发酵有促进作用,过高则会抑制菌体的生长代谢[22],进而影响螯合钙的生成。当MgSO4·7H2O含量为0.10%时,螯合钙的产量达到最高,为(562.09±17.78)mg/L。因此,确定MgSO4·7H2O的最佳含量为0.10%。

图6 不同MgSO4·7H2O含量对螯合钙产量的影响Fig.6 Effect of different MgSO4·7H2O contents on the yield of chelated calcium
2.2 Plackett-Burman试验结果
由表3及表4可知,6个因素对螯合钙生成的影响由高到低依次为牛骨粉、大豆粉、葡萄糖、MgSO4·7H2O、KH2PO4、K2HPO4·3H2O,其中牛骨粉、大豆粉、葡萄糖影响极显著(P<0.01),因此选择牛骨粉、大豆粉和葡萄糖含量作为3个主要因素进行响应面分析。

表3 Plackett-Burman试验设计与结果Table 3 Design and results of Plackett-Burman tests

表4 Plackett-Burman模型方差分析Table 4 Variance analysis of Plackett-Burman model
2.3 响应面试验结果
2.3.1 Box-Behnken试验设计及结果
Box-Behnken试验设计及结果见表5,方差分析见表6。
通过对表5数据的多元回归拟合,获得螯合钙(Y)的二次多元回归模型方程:

表5 Box-Behnken试验设计及结果Table 5 Design and results of Box-Behnken tests

由表6可知,此模型的P值<0.001,极显著,失拟项P值=0.123 2>0.05,不显著,说明试验中未考虑的因素对结果影响不显著。决定系数R2=0.993 8,调整系数R2Adj=0.982 7,说明该模型可准确反映各因素对螯合钙生成的影响,模型对实际情况拟合良好[23]。一次项A、B、C及二次项A2、C2对结果影响极显著(P<0.01),交互项AC对结果影响显著(P<0.05),而其他项对结果不显著(P>0.05)。
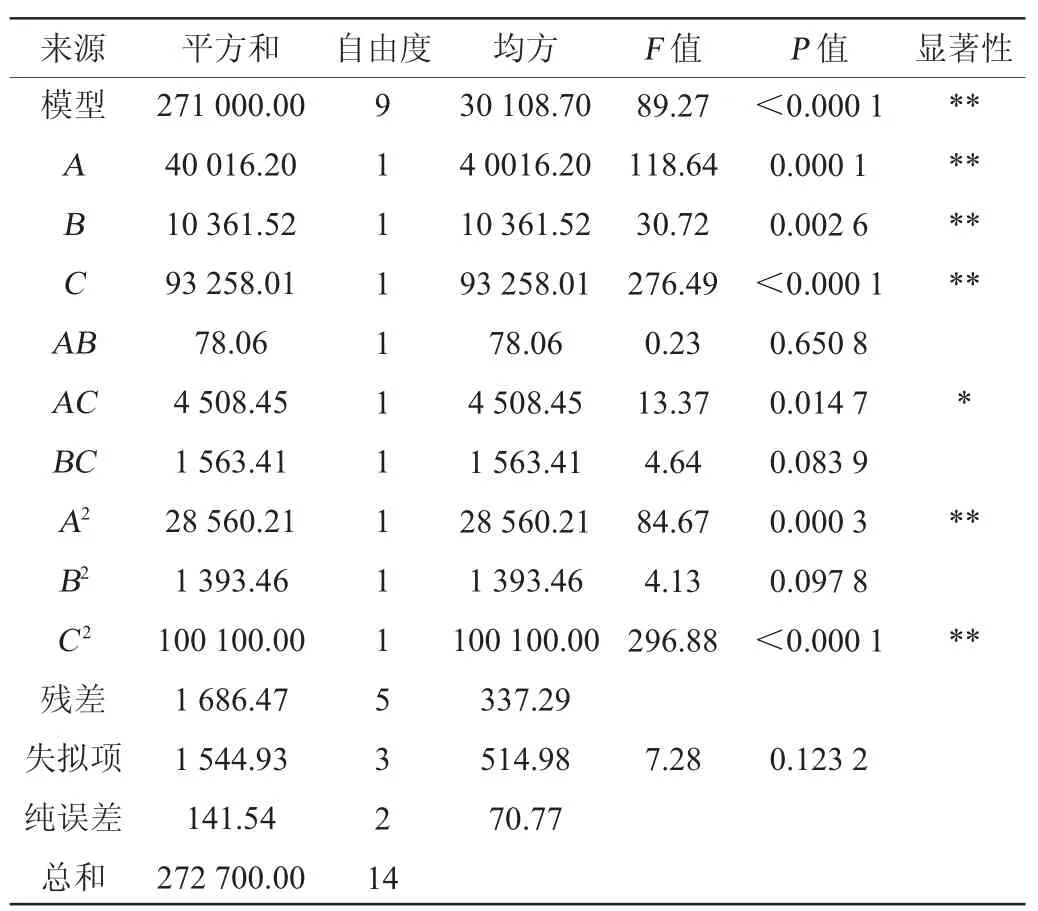
表6 Box-Behnken模型方差分析Table 6 Variance analysis of Box-Behnken model
2.3.2 响应面试验结果分析
由Design-Expert10.0软件分析得到各因素间交互作用对纳豆芽孢杆菌SWS-001发酵生产螯合钙的影响的响应面及等高线见图7。响应面坡面越陡峭,说明在控制一个因素不变时,其余两个因素间的交互作用对响应值影响越显著[24-25],由图7可知,牛骨粉、大豆粉和葡萄糖两两因素之间均有交互作用,其中A(牛骨粉)和C(葡萄糖)的交互作用对响应值螯合钙影响显著。

图7 牛骨粉、大豆粉和葡萄糖含量间交互作用对螯合钙产量影响的响应面及等高线Fig.7 Response surface plots and contour lines of effect of interaction between bovine bone powder,soybean flour and glucose contents on chelated calcium yield
2.3.3 响应面结果验证性试验
根据响应面试验模型结果计算可知,3个因素的最佳配比为牛骨粉3.49%,大豆粉4.81%,葡萄糖0.47%,在此条件下预测得到发酵液中螯合钙含量为692.35 mg/L。为实际称量考虑,3个因素添加量分别为牛骨粉3.5%,大豆粉4.8%,葡萄糖0.5%进行发酵制备螯合钙,重复3次,发酵液中螯合钙含量为(707.47±32.16)mg/L,与预测值接近。这说明该回归模型可以为实际操作提供指导。
3 结论
本研究通过单因素试验及响应面试验确定了纳豆芽孢杆菌发酵制备螯合钙的最优培养基为牛骨粉3.5%,大豆粉4.8%,葡萄糖0.5%,KH2PO40.2%,K2HPO4·3H2O 0.52%,MgSO4·7H2O 0.1%,在此条件下,发酵液中螯合钙的含量达到(707.47±32.16)mg/L,与优化前相比提高了29.42%,可以为螯合钙的进一步研究与工业化生产提供数据支持和理论依据。

