山苍子油对糟辣椒贮藏期品质的影响
殷 勇,王雪雅,蓬桂华,陆 敏,陈 菊,陆 宽
(1.贵州省农业科学院 辣椒研究所,贵州 贵阳 550006;2.贵州省生物技术研究开发基地,贵州 贵阳 550002)
糟辣椒是一种贵州腌制辣椒加工产品中独具特色的发酵产品,以酸、辣、鲜、香为特点,酸辣适宜,风味醇厚,深受消费者喜爱[1-3],其制作方式是将新鲜红辣椒洗净去蒂、沥干水分,辅以姜、蒜、盐等辅料剁至碎块放入发酵坛中加盖液封至发酵成熟[4-7]。发酵后成品既保留鲜椒原有的色泽、脆度、辣味,又具有发酵辣椒制品独有的风味,色泽鲜红,口感爽脆[8]。
糟辣椒是一类以乳酸菌为优势菌发酵而成的辣椒制品,然而糟辣椒容易受到细菌、霉菌、酵母菌微生物的污染,造成糟辣椒变色、变味、发黏等异常现象[9-10]。因此,糟辣椒产品安全问题是关乎产品质量安全的共性技术难题。目前,糟辣椒的保质技术主要集中在添加化学合成防腐剂和物理灭菌方面,这两种技术有一定的弊端[11-13],其中,化学合成防腐保鲜剂存在药剂残留、毒副作用等问题;物理灭菌可通过高温灭活微生物,但高温处理会在一定程度上影响糟辣椒的口感[14-15]。因此寻找新型、绿色、安全的生物防腐保鲜技术是今后糟辣椒的研究方向。
山苍子(Litsea cubeba)属于樟科木姜子属的小乔木,也叫赛樟树、山鸡椒、木姜子等,山苍子具有似柠檬味的香气,风味纯正、独特,同时含有锌、硒等微量元素,是一种对健康有益的食物[16-17]。山苍子既可鲜食,又可提纯出山苍子油后加工制成调味品,具有良好食用品质及安全性[18]。山苍子油的主要成分为萜烯类化合物及其含氧衍生物,化学组成赋予了其具有较好的抗菌活性,山苍子油及其主要成分柠檬醛具有广谱的抗真菌效果[19]。山苍子油对许多常见的革兰氏阴性和阳性菌都有不同程度的抑制作用,有抗菌、抗氧化等作用[20]。近年来,对山苍子油的抑菌机理研究进行了不同的探索,取得相关研究成果。如发现柠檬醛通过其α,β-不饱和键与某些酶结合而降低酶活性,从而导致代谢障碍发挥其抑菌作用[21]。山苍子油与菌体作用,导致细胞壁疏松、膜密度降低、细胞内容物减少、干扰蛋白质和细胞壁的合成等[22]。
本研究为了探讨山苍子油对糟辣椒的防腐保鲜效果,以山梨酸钾为阳性对照,将不同用量山苍子油添加至发酵成熟的糟辣椒中,研究不同山苍子油添加量(0.1%~0.5%)对糟辣椒贮藏品质的影响,并对糟辣椒的感官指标、色泽及外观变化、菌落总数、pH值及总酸品质和风味进行评价,旨在提升糟辣椒产品的品质和安全水平,开发山苍子油高附加值产品及对天然防腐技术进行应用。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
山苍子油(柠檬醛含量72.74%):江西亿森源植物香料有限公司;新鲜辣椒、生姜、大蒜:购于贵阳市花溪区金竹镇农贸市场。
1.1.2 化学试剂
氢氧化钠、无水乙醇(均为分析纯):成都科龙化学试剂厂;山梨酸钾(分析纯):安徽长逸生物科技有限公司。
1.1.3 培养基
平板计数琼脂(plate count agar,PCA)培养基:胰蛋白胨5.0 g,酵母浸粉2.5 g,葡萄糖1.0 g,琼脂15.0 g,蒸馏水1 000 mL,pH 7.0±0.2。121 ℃高压灭菌15 min。
1.2 仪器与设备
FA2004电子分析天平:上海良平仪器仪表有限公司;DHG-9240A 3000W电热鼓风干燥箱:上海煜南仪器有限公司;Hunter Lab Ultra Scan Pro全自动多功能色差仪:美国亨特立公司;YXQ-280MD高压蒸汽灭菌锅:上海申安医疗器械厂;CRH-150生化培养箱:上海一恒科技有限公司;PEN3电子鼻:北京盈盛恒泰科技有限公司;PB-10赛多利斯pH计:赛多利斯科学仪器(北京)有限公司。
1.3 方法
1.3.1 糟辣椒的制备
根据贵州省地方标准DB52T982—2015《发酵辣椒酱及糟辣椒加工技术规程》制备糟辣椒,其加工工艺流程如下:

1.3.2 贮藏性实验
将200 g糟辣椒置于已灭菌的干燥瓶子中,共设置7组样品,以未添加山苍子油及山梨酸钾组为空白组(CK),山苍子油添加量为0.1%、0.2%、0.3%、0.4%、0.5%的处理组为实验组(分别编号为S1、S2、S3、S4、S5),添加1 g/kg山梨酸钾组作为阳性对照组,编号为S6,所有实验组均于28 ℃条件下密封避光贮藏50 d,每10 d取1次样,共5次。每次取样前需对取样工具作灭菌处理,上中下部分混匀后取样,每次取3个平行。
1.3.3 测定方法
菌落总数:参照国标GB 4789.2—2016《菌落总数测定》;pH值:参照国标GB 5009.237—2016《食品pH值的测定》;总酸:参照国标GB/T 12456—2008《食品中总酸的测定》;色差值(△E)测定:参照文献[23]方法,△E表示总色差。感官评价:参照文献[24]方法,添加山苍子油5 d后,对糟辣椒进行感官评分,满分100分,糟辣椒感官评分标准见表1。
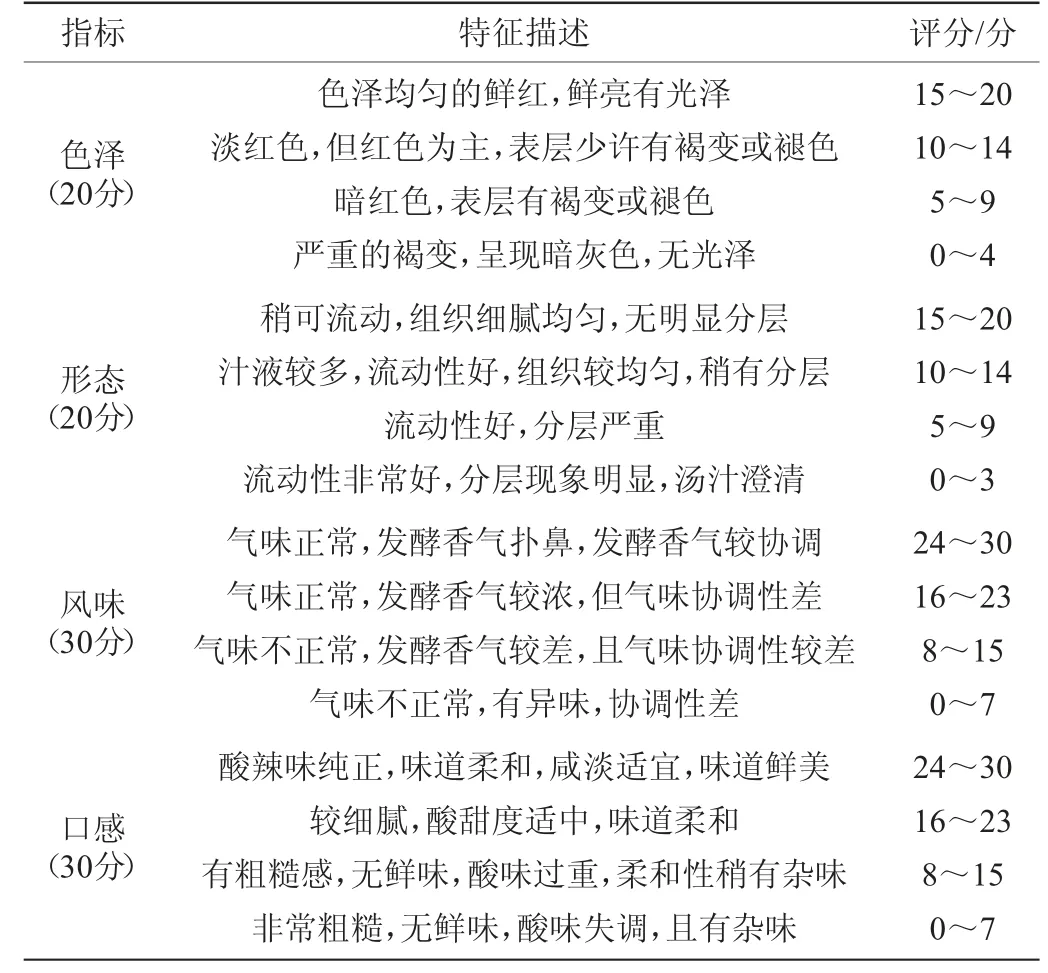
表1 糟辣椒的感官评分标准Table 1 Sensory scoring criteria of fermented pepper
风味物质的检测:参照文献[25]的方法。不同传感器的性能描述如表2所示。
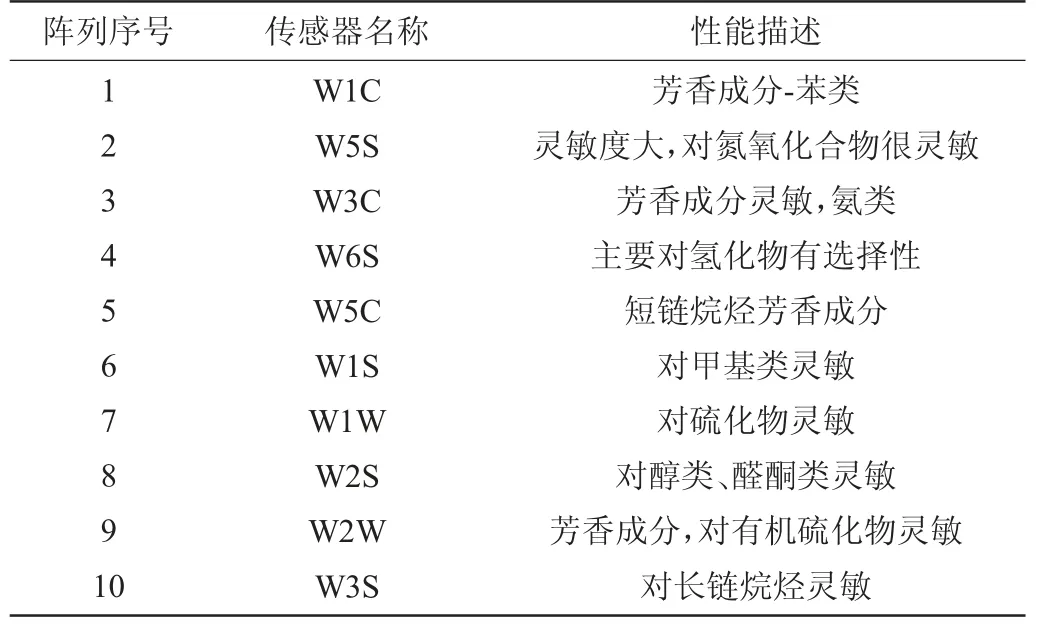
表2 电子鼻系统传感器类型及性能描述Table 2 Sensor type and performance description of electronic nose system
1.3.4 数据处理
用Excel 2016进行数据记录并初步处理、绘制图表;采用SPSS 17.0软件进行数据统计分析。
2 结果与分析
2.1 不同处理组对糟辣椒感官评分的影响
不同处理组对糟辣椒感官评分的影响见表3。由表3可知,各处理组对糟辣椒的感官品质影响不同,其中CK组感官评分为88.1分,S2组感官评分为91.4分,在色泽和形态方面表现较好,说明添加0.2%的山苍子油使糟辣椒品质表现较好,糟辣椒风味相协调,风味更有层次,由于山苍子油带有柠檬香味,赋予糟辣椒清新愉悦的风味[26]。S4和S5组感官评分较低,分别为58.2分、50.2分,主要表现为口感和风味不佳,山苍子油在密封环境下,柠檬香味比较强烈且不易排出[27],随着山苍子油添加量的增加,逐渐破坏糟辣椒风味协调性,口感出现苦涩味,且添加量越高苦涩味越浓。综上,S2处理组(即山苍子油添加量为0.2%)为最优组。

表3 不同处理组对糟辣椒感官评分的影响Table 3 Effect of different treatment groups on sensory scores of fermented pepper
2.2 不同处理组对贮藏期内糟辣椒总色差的影响
不同处理组对糟辣椒贮藏期总色差的变化如图1所示,在贮藏0 d时,各组之间△E值无显著差异(P>0.05),随着贮藏时间的变化,各组之间△E开始呈现不同趋势的下降,具体表现为:CK组在贮藏期内△E呈显著差异(P<0.05),相对其他处理组变化范围最大,从0~50 d的△E差值为8.01,30 d时(不仅是30 d,还包括40 d、50 d)△E相对其他组出现明显的下降,CK在26 d时表面因酵母菌等微生物快速繁殖造成“生花”,说明随着时间的推移,糟辣椒中腐败微生物快速繁殖生长,破坏糟辣椒形态,环境中的氧化还原电势较高而使辣椒中的多酚类物质发生褐变,颜色变深[25]。S1组在贮藏期间△E值有显著差异(P<0.05),在0~30 d变化趋势相对平缓,在30~50 d之间△E值下降速度加快,整个贮藏期△E差值为6.52,原因在于0~30 d时山苍子油有一定的抑菌能力,但由于浓度较低,导致抑菌能力不足,造成S1在41 d时已腐败“生花”,最终△E值为42.71。S6组在贮藏期间△E值有显著差异(P<0.05),与S1相差不大,最终△E值为42.39,结合外观分析,S6在37 d时已腐败,说明添加1 g/kg山梨酸钾抑菌防腐能力较差。S2~S5组在整个贮藏期中△E变化幅度相对最小,但与各处理组之间的变化均呈显著性差异(P<0.05),整个贮藏期中,除了色泽轻微变暗外,组织形态较好,无褐变现象,其中变化最小的为S5组,△E差值为3.48,表明山苍子油浓度越高,色泽变化越小,△E相对稳定,表明高浓度下的山苍子油针对糟辣椒中的酵母腐败菌有较强抑菌效果。通过添加不同浓度的山苍子油发现,S5处理组的护色效果最佳,浓度越高,糟辣椒的色泽变化越小,稳定性越好。从色差变化结果来看,当山苍子油添加量为0.2%以上时,对糟辣椒有较好的护色效果。

图1 不同处理组对贮藏期内糟辣椒总色差的影响Fig.1 Effect of different treatments on the total color difference of fermented pepper during the storage
2.3 不同处理组对贮藏期内糟辣椒菌落总数的影响
不同处理组对贮藏期内糟辣椒菌落总数的影响见表4。由表4可知,在添加山苍子油和山梨酸钾后菌落总数呈现下降的趋势,但随着时间的延长,不同处理组的糟辣椒中菌落总数均持续增加,其中CK增长速率最快,且与其他处理组差异显著(P<0.05),糟辣椒贮藏期CK菌落总数变化差异显著(P<0.05)。10 d后,各处理组菌落总数在1.53~4.77×103CFU/g之间,而CK组为1.27×104CFU/g(P<0.05)。贮藏20 d,CK菌落总数为2.19×104CFU/g,较10 d增长近2倍,至50 d时菌落总数达到6.58×106CFU/g。S1、S6组中微生物繁殖相对其他山苍子油处理组快,50 d时菌落总数分别达到3.52×105CFU/g、3.75×105CFU/g,由此可初步判断S1与S6组抑菌能力较弱,从而导致糟辣椒中微生物繁殖较快。S2~S5组菌落总数一直保持低水平,S2组在后期有所增加,至50 d时菌落总数为3.31×104CFU/g,S3、S4、S5在整个贮藏期中,菌落总数相对较低,到50 d时,三组菌落总数分别为9.09×103CFU/g、4.55×103CFU/g、2.55×103CFU/g。由此可见,山苍子油在糟辣椒抑菌有很好的效果,且浓度越高,抑菌效果越好,能有效抑制糟辣椒各种微生物生长。在贵州省地方标准DB 52T982—2015《发酵辣椒酱及糟辣椒加工技术规程》中没有对菌落总数作出要求。从菌落总数变化结果来看,山苍子油添加量在0.2%以上就能有效的抑制各种微生物的生长。

表4 不同处理对糟辣椒菌落总数的影响Table 4 Effect of different treatments on the total bacterial count of fermented pepper
2.4 不同处理组对糟辣椒贮藏期pH值及总酸含量影响
不同处理组对贮藏期糟辣椒pH值的影响见图2。由图2可知,贮藏期内不同处理组呈现出pH值逐渐升高趋势,CK组pH值变化呈显著性异差(P<0.05)。至30 d,CK的pH值3.29,因其未加入抑菌成分,乳酸菌为优势菌群,pH值在一定时间内保持在较低水平;在30~50 d,pH值上升至4.12,pH值快速升高,酸度降低,与其他各组差异显著(P<0.05),其原因是贮藏中后期,CK组内微生物大量繁殖生长,其他菌占主导地位。S1、S6组在贮藏期内上升较快,与其他组呈差异显著(P<0.05),原因在于糟辣椒中其他微生物生长迅速。S2组在50 d时,pH值为3.41,变化同CK、S1、S6相比,pH值保持在一个较为稳定的范围,从而使糟辣椒的pH值上升趋势较缓,同菌落总数分析结论相符。S3~S5组pH值上升慢,S2组pH变化比其他组小,原因是随着山苍子油浓度增高,不仅抑制了主要腐败菌的生长,同时也抑制了乳酸菌的生长。由此可见,从pH值变化来看,在山苍子油0.2%添加量下糟辣椒不仅能抑制微生物的生长,防止腐败,而且能有效防止糟辣椒发酵过酸,使糟辣椒保持在一个合适的酸度。
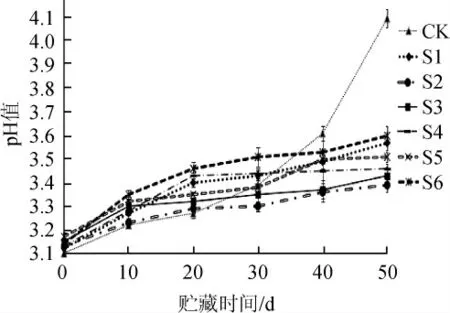
图2 不同处理组对贮藏期糟辣椒pH值的影响Fig.2 Effect of different treatments on pH of fermented pepper during the storage
不同处理组对贮藏期总酸含量的影响如图3所示,在整个贮藏期间,随着糟辣椒中pH值的升高,各组总酸含量呈不断下降趋势。CK组在贮藏期间总酸变化最大,与其余处理组呈显著性差异(P<0.05),在0~20 d中,CK组总酸含量均高于各处理组(P<0.05),含量从1.44%仅下降到1.34%,30 d后下降趋势明显(P<0.05),速度较其他组快,这是由于CK组糟30 d之前乳酸菌占主导地位,产酸多,总酸含量处于较高水平,随着pH上升,产酸能力变弱,总酸含量下降较快。S1、S6组的总酸在贮藏期下降相对其余处理组较快(P<0.05),贮藏50 d后总酸含量分别为0.735%、0.701%,表明山梨酸钾与0.1%山苍子油在稳定糟辣椒总酸下降的效果相近。S2组的总酸含量变化在贮藏期内差值为0.51,同CK、S1、S6相比,总酸变化较小,由于山苍子油的抑菌作用,使糟辣椒处于一个较为稳定的pH环境中,所以能较好的保持总酸含量。S3~S5的总酸下降相对较慢,整个贮藏期内总酸含量同0 d相比差值分别为0.503、0.489、0.434。说明山苍子油浓度越高,越能稳定糟辣椒pH值,对稳定总酸含量效果越明显。由此可见,从总酸含量变化来看,在山苍子油0.2%添加量下糟辣椒有效稳定总酸含量。
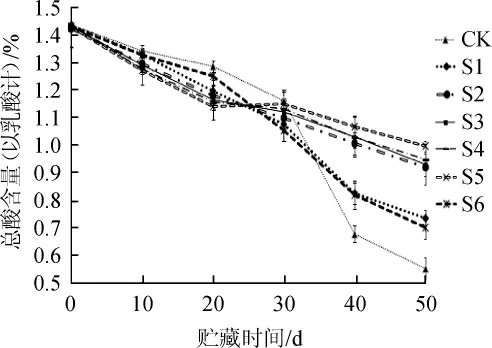
图3 不同处理组对贮藏期总酸含量的影响Fig.3 Effects of different treatments on total acid contents of fermented pepper during the storage
2.5 贮藏期糟辣椒风味成分电子鼻分析
不同浓度山苍子油对糟辣椒风味成分的影响,可通过电子鼻的不同传感器在特定时间点的响应值变化来表示,糟辣椒贮藏0 d、50 d电子鼻传感器信号雷达图见图4。
由图4A可知,在0 d时,各处理组的W5S、W3C、W6S及W3S传感器响应值较低且变化不大,表明此时糟辣椒各组的挥发性成分在氮氧化合物、氨类、氢化物和烷烃类的含量上没有明显变化;其中CK对W1S(甲基类)、W1W(硫化物)、W2W(有机硫化物)3个传感器变化相对明显,表明正常糟辣椒中硫化物香气特征明显,含硫化合物多为大蒜、洋葱等食物的代表性物质,与其他挥发性物质混合后,形成了辣椒发酵后独特的风味[28]。S1~S5对W1C(芳香成分)、W5C(短链烷烃类)、W1S(甲基类)、W1W(硫化物)、W2S(醇类、醛酮类)变化比较明显,除了糟辣椒正常具有的气味外,还具有更为丰富的风味,醛类物质香气浓烈,多为花香及果香气味,这与样品中添加山苍子油相关,说明电子鼻传感器能较好的区分不同处理方式的糟辣椒。
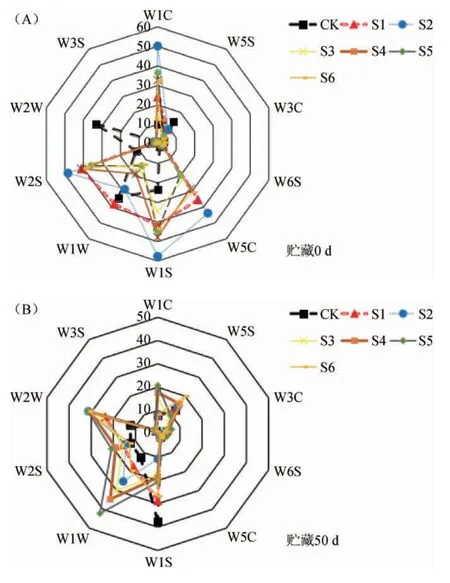
图4 糟辣椒贮藏0 d(A)和50 d(B)电子鼻传感器信号雷达图Fig.4 Radar map of electronic nose sensor signal at storage 0 d (A)and 50 d (B) of fermented pepper
由图4B可知,在贮藏50 d时,各传感器的响应值明显小于0 d,说明各类气味随着贮藏时间的增长而减弱。其中CK对W1S(甲基类)响应较0 d明显,其余均减弱,可能与贮藏后期糟辣椒腐败有关。S1与S6变化趋同与CK,对W1S(甲基类)响应比较明显,说明贮藏后期糟辣椒中甲基类物质增多。S2~S5组中对W1C(芳香成分)、W1W(硫化物)、W2S(醇类、醛酮类)、W2W(有机硫化物)4个传感器上变化明显,说明贮藏后期添加山苍子油的糟辣椒气味差异主要体现在芳香成分、硫化物、醇类与醛酮类化合物上。由此可推断,糟辣椒的腐败可能与甲基类物质增长有关,而山苍子油的加入使糟辣椒风味更佳丰富。
2.6 贮藏期糟辣椒风味物质的线性判别分析
不同处理组对糟辣椒贮藏0 d、50 d风味影响的LDA结果见图5。由图5可知,线性判别函数LD1和LD2的方差贡献率分别为66.171%和22.666%,累积方差贡献率有88.837%,很好的反映了样品总体信息。从各组风味圈分布来看:贮藏0 d时,CK在LD1的条件下,与其他组之间相隔较远,区别明显,是因为S1~S5处理组添加了不同量的山苍子油,对糟辣椒的风味影响大,导致CK组与各组的风味圈相距最远;在5个处理组中,S1、S2组风味圈能很好分离,而S3、S4、S5组风味重叠,表明当山苍子油添加量较低时,通过电子鼻能快速区分,在添加量高时,即为0.3%、0.4%、0.5%时,通过LDA不能将其很好的分开,可能是由于添加量低,各风味物质的差异性较为明显,通过电子鼻能区分,添加量高山苍子油的各风味物质浓度高,不能很好的区分。

图5 糟辣椒贮藏0 d、50 d风味物质线性判别分析结果Fig.5 Linear discriminant analysis results of flavor components in fermented pepper at storage 0 d and 50 d
贮藏50 d与0 d相比,CK差距最大,说明贮藏期内,CK气味变化最大,CK在贮藏期内色差、菌落总数、pH差异较大,从而在风味上变化也最大;其次为S1、S6组,风味圈的距离也较远,说明在整个贮藏期,两个处理组气味变化比较显著,与贮藏初期相比变化较大。S2在LD1条件下距离较远,风味变化比较明显,但通过外观观察,S2变化不明显,可能由于在此浓度下,S2到贮藏后期,糟辣椒内微生物数量增多,代谢产物增多,导致S2在风味上有着更丰富的表现。S3、S4、S5在0 d时重叠,50 d三组也较接近,说明三组风味相近,整个贮藏期中,风味圈距离也最近。可见,贮藏50 d时,CK在LD2的条件下,与其他组距离较远,区别明显。由此可知,当山苍子油添量为0.2%时,可以丰富其风味,也说明电子鼻在区分不同山苍子油含量对糟辣椒贮藏期的气味具有可行性,对于评价糟辣椒品质变化有着重要实用意义。
3 结论
在发酵成熟的糟辣椒中添加不同量的山苍子油,对贮藏期糟辣椒品质指标进行分析,结果表明,山苍子油最佳添加量为0.2%,在此条件下,贮藏期内糟辣椒可得,感官评分91.4分,色差值(△E)为4.48,菌落总数为3.31×104CFU/g,pH值为3.41,总酸含量为0.921%。本研究不仅能在贮藏期保持糟辣椒品质,而且使产品风味更丰富协调、稳定,可为糟辣椒的产业化生产提供理论依据,对提升糟辣椒发酵工艺的工业化应用具有重要的指导意义。

