老年左房前壁自发性瘢痕相关心房扑动的电生理特征及分析
宗小娟, 尹桂芝, 陆 益, 杭燕雯, 胡 伟, 朱文青, 程 宽*
1. 复旦大学附属闵行医院心内科,上海 201100 2. 复旦大学附属中山医院心内科,上海 200032
房性心律失常在老年患者中发生率较高[1],其中心房颤动(房颤)是常见类型。有报告[2]显示,在65岁以上的人群中,每年新发房颤的风险约为2%。老年房颤患者多合并左房电解剖基质改变[3-4]。房颤消融术后复发可表现为左房起源的心房扑动(房扑)和房性心动过速(房速),多与消融导致的消融圈、线不完整以及局部低电压区有关[5-6],但部分老年患者既无心脏手术史也无消融史,左房却存在自发性瘢痕和低电压区,成为引起房扑的潜在基质。目前对此类房扑的相关研究报道较少,对其电生理特点认识不深。本研究回顾性分析左房前壁自发性瘢痕相关房扑的电生理特点、机制及消融预后,并就自发性瘢痕形成的相关因素进行探讨。
1 资料与方法
1.1 研究对象 回顾分析2018年1月至2020年1月复旦大学附属闵行医院收治的老年左房房扑患者5例,既往无外科心脏手术或房颤射频消融史,无器质性心脏病。所有患者术前均停用抗心律失常药物5个半衰期。术前均行心脏超声及食管超声等检查,排除左心房内血栓。纳入标准:年龄≥65岁;既往无房颤消融史或外科手术史;经电生理检查及电解剖标测为左房前壁瘢痕相关的房扑。排除标准:年龄<65岁;右房房扑。所有患者术前均知情并签署知情同意书。
1.2 电生理检查及电解剖标测 在局麻和镇静状态下进行。穿刺右股静脉二处置入6F鞘管后,送10极冠状窦导管于冠状窦(CS)、4极导管于右房。房扑发作状态下进行电生理检查操作,若转为窦性心律,予以心房程序刺激或快速起搏,必要时静脉滴注异丙肾上腺素诱发。根据以下标准初步判断其起源于左房:(1)冠状窦激动顺序中段或远段早于近段,若近段早于远段则通过拖带进一步帮助判断;(2)4极导管记录的右房激动晚于冠状窦导管记录的左房激动;(3)拖带标测:以短于心动过速周长10~30 ms起搏拖带,起搏后间期(post pacing interval,PPI)与心动过速周长(tachycardia cycle length,TCL)差值≤30 ms提示起搏位点位于折返环,冠状窦近、中、远段以及右房多部位拖带标测,提示右房不在折返环内。多导电生理仪(Labsystem pro,C.R.BARD, 美国)记录心内电图(100 mm/s),双极信号滤波为30~500 Hz。
诊断为左房房扑后,将4极导管的6F鞘置换为Swarts L1(SL1)长鞘,并再穿刺1处股静脉置入SL1长鞘,造影剂指示下穿刺房间隔2次,分别送pentaray星型标测电极(强生公司)和压力感知标测消融导管(强生公司,Smart touch)入左房。在CARTO3三维系统(强生公司)指导下,在心动过速时以pentaray星型标测电极均匀地行高精密度取点(1 000点以上)完成左房三维建模,并进行以下标测来确定左房瘢痕相关的房扑。(1)电压标测图:低电压区定义为双极电压振幅≤0.5 mV且>0.05 mV,瘢痕区定义为没有可记录电位的电静止区域或双极电压振幅≤0.05 mV的区域,并计算其面积所占百分比。心房电压图通过颜色显示(低电压为红色,最高电压为紫色);(2)激动标测图:以振幅稳定且清晰的冠状窦导管某一对电极A波作为激动参考,标测出左房激动时间占房扑周长90%以上,最早激动(红)和最晚激动(紫)呈“红接紫”表现;(3)将电压图和激动图进行对照,确定房扑周长主要集中于低电压区和瘢痕区附近且该处呈“红接紫”;(4)CARTO系统的激动图动态显示激动顺序和路径,提示缓慢传导区(关键峡部)位于低电压区;(5)以压力感知标测消融导管在左房多部位特别是低电压区和瘢痕区附近进行拖带标测,确定房扑机制为折返性且关键峡部位于低电压区。
1.3 射频消融 在房扑的关键峡部进行消融,并通过线性消融连接2个瘢痕区或将瘢痕区与解剖屏障(二尖瓣环)连接。温度上限43℃,功率30~35 W,灌注流速20~25 mL/min,每个消融点持续30~60 s。急性成功定义为房扑终止恢复窦律,消融线上局部形成电静止区,重复电生理刺激不能再次诱发。
1.4 术后处理及随访 所有患者消融术后行心电监护至少24 h,消融成功的患者停用所有抗心律失常药物,术后服用抗凝药物至少3个月。出院后进行电话及门诊随访,随访时间至少1年,每3个月随访1次心电图和动态心电图(Holter)。依据患者症状、心电图及Holter的随访结果进行判定是否复发。

2 结 果
2.1 一般资料分析 结果(表1)显示:5例房扑患者中男性3例,女性2例,平均年龄(76.6±10.5)岁,所有患者此前均未行射频消融术及外科心脏手术,冠脉造影或冠脉CTA均为阴性。5例患者左房内径增大,4例伴有高血压,其中3例伴升主动脉增宽。房扑类型均为持续性。

表1 左房前壁瘢痕相关心房扑动患者的临床特点 n=5
2.2 电生理检查及消融结果 结果(表2)显示:所有患者左房容积均增大且存在左房前壁自发性瘢痕,瘢痕面积占2.5%~6.9%(5.9~12.9 cm2),自发性瘢痕所在区域与左房肺静脉CT相应体位对照后,均位于左心房与主动脉压迹相对应的部位,有4例在低电压区可以标测到碎裂电位。5例房扑均为折返性,4例为绕二尖瓣环逆钟向折返,冠状窦激动顺序均为近段向远段,其关键峡部位于瘢痕与二尖瓣环之间的低电压区域,在该处可隐匿性拖带,在局部瘢痕区向二尖瓣环行线性消融后房扑终止(图1、图2);1例房扑为左房前上壁围绕左心耳的折返,在低电压区、左房顶部、后壁、二尖瓣峡部等部位拖带,排除了左房顶部依赖的前壁-后壁大折返房扑,其关键峡部位于前壁瘢痕之间的低电压区,在该处消融终止房扑,而试消融瘢痕与二尖瓣环之间的低电压区时不能终止房扑,但考虑该处有潜在形成峡部的可能,遂将该处低电压区消融至无电位并连接至二尖瓣环(图3)。消融后,反复行电生理检查均未再诱发心动过速。
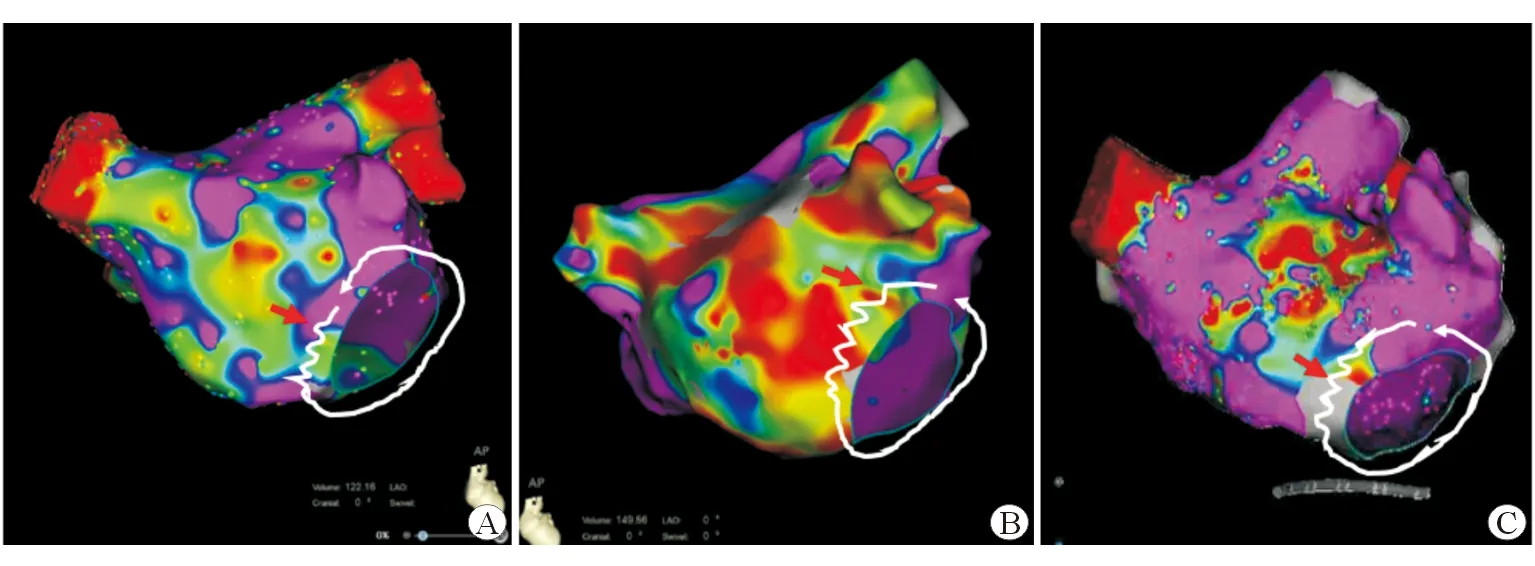
图1 3例二尖瓣环逆钟向折返的房扑患者CARTO电压图
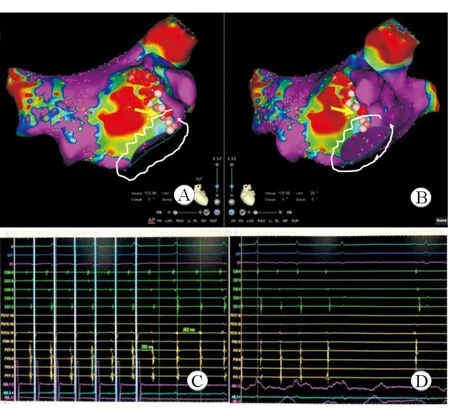
图2 二尖瓣环逆钟向折返房扑患者典型病例的标测和消融示意图

图3 典型病例CARTO标测图与多导腔内图

表2 左房前壁瘢痕相关心房扑动患者术中标测数据
2.3 随访预后 随访平均时间为(15.6±4.2)个月,1例房扑术后复发又行二次消融,再次在左房前壁低电压区消融后房扑转为窦性心律,因左房内径较大(53 mm),同时行双侧环肺静脉电隔离。随访中所有患者无房扑、房颤等房性心律失常发作。
3 讨 论
本研究描述5例与左房前壁自发性瘢痕相关的老年房扑患者的电生理特征及消融后随访情况,结果表明:(1)左房前壁自发瘢痕可能是部分老年患者房性心律失常的基质,对老年患者左房起源的房性心律失常,需关注左房前壁主动脉压迹区域的自发性瘢痕;(2)高血压、左房内径扩大、升主动脉内径增宽可能与左房前壁瘢痕及低电压区的形成相关;(3)对此种房扑行射频消融效果较好。
左房起源的房扑、房速常见于房颤导管消融术后的患者,在接受左房广泛消融的患者中发生率高达50%,其机制多为大折返性,少数为局灶性[7]。此外,涉及左房或房间隔的心脏手术后也可导致左房房扑、房速。然而,部分患者既往并没有房颤导管消融史或心脏手术史。Fukamizu等[8]曾报道6例自发瘢痕相关的左房房扑,均为老年患者(平均年龄76岁),所有瘢痕均在左房前壁,瘢痕与二尖瓣环之间的传导速度明显慢于二尖瓣环外侧壁,其消融径线并未选择传统的二尖瓣峡部(二尖瓣环至左下肺静脉),而是瘢痕至二尖瓣环之间的峡部区域,在此消融可使心动过速终止且不被诱发。
本研究中涉及的左房前壁瘢痕相关房扑均为折返性,病例的平均年龄及消融策略均与Fukamizu等[8]报道的病例类似。其关键峡部通常较短(0.8~1.6 cm),数个消融点即可达到峡部阻滞。不同的是,本研究中有1例患者的房扑关键峡部不在瘢痕与二尖瓣环之间,而是位于瘢痕之间的低电压区,极易遗漏,而利用CARTO三维系统的高密度标测和拖带标测有助于寻找鉴别该关键峡部,提高消融效率。本研究患者的消融策略与Fukamizut等[8]的报道均未行经典二尖瓣峡部线性消融,主要基于以下考虑:(1)二尖瓣峡部主要是作为解剖学峡部,并不一定是房扑折返依赖的关键峡部,而前壁低电压区是其电生理峡部并且较短,可能更适于作为消融靶点;既往文献[9]对右房瘢痕相关房扑时三尖瓣峡部和游离壁瘢痕低电压区有类似的理解和认识;(2)未对经典的二尖瓣峡部进行干预,虽然留有日后发生折返的可能,但考虑到患者的年龄较大,在以后的生命周期中形成潜在折返的概率被年龄较大所降低;(3)本研究患者干预前壁的电生理峡部后,已不能诱发房扑发作,不干预二尖瓣峡部,可降低过度消融可能形成新的心律失常基质和并发症的风险。平均随访15.6个月无复发也提示该消融策略可靠有效。本研究中还有1例患者左房内径明显增大,亦同时行环肺静脉消融。有研究[10]报道,左房自发瘢痕相关房扑的消融区域可能不仅局限于峡部,尚需要行肺静脉电隔离以预防房颤的发作。但此种消融方案延长了手术时间,增加了消融风险。鉴于左房自发瘢痕相关房扑的病例报道较少,因此在临床实践中如何针对特定患者选择个体化消融策略,仍需积累更多病例,甚至进行随机对照前瞻性研究来进一步探索才能提供更客观的证据。
心房瘢痕的形成原因和发病机制并不是特别清楚。有研究[11]提示,对左房前壁瘢痕相关的房性心律失常患者进行电解剖标测,在左房可检测到低电压或瘢痕区域作为中央障碍区或折返环中的障碍。这些区域一般分布在左房后壁(45%)、上顶部(28%)或前间壁(27%)。阵发性房颤患者左房壁变薄是局部存在低电压区的独立预测因素[12]。瘢痕区和低电压区形成的可能原因包括容积和压力负荷(二尖瓣瓣膜疾病、高血压病、心功能不全),缺血(心房支闭塞),感染后瘢痕形成(心肌炎),心房淀粉样变性,心房结构异常和心动过速相关的结构重塑[13-14]。同时,高血压也可以使左室的顺应性下降、舒张功能障碍,导致左房负荷加重及容积扩大,左房内小动脉增厚狭窄致心房肌供血不足,引起局部纤维化,从而导致房性心律失常[15]。也有研究[16-17]认为,左房前壁和主动脉根部贴靠部位的刚性接触可促进局部纤维化,从而导致瘢痕形成,亦是左房自发性瘢痕最常见的区域。本研究患者平均年龄较大,合并高血压及主动脉内径增宽的比例较高,推测左房前壁瘢痕形成与增龄性的左房增大、主动脉增宽共同作用导致左房前壁局部纤维化有关,从而最终导致局部心房肌电学功能的不均一性,形成致房性心律失常的基质。
综上所述,左房自发性瘢痕可能成为左房房性心律失常的基质。通过基于高精密度取点的电解剖标测和拖带标测等技术,有助于识别关键峡部进而指导导管消融,可获得满意效果。本研究的局限性在于病例数相对有限、随访时间不够长,尚需更多病例和检测方法来深入分析瘢痕形成原因、房性心律失常机制并探求最佳消融策略。

