冠状动脉CT血管成像在自发冠状动脉壁内血肿患者随访中的应用
常书福, 宋晓玥, 戴宇翔, 李晨光, 陆 浩, 黄浙勇, 马剑英, 钱菊英, 葛均波
复旦大学附属中山医院心内科,上海市心血管病研究所,上海 200032
冠状动脉(冠脉)壁内血肿(coronary intramural hematoma,CIH)由血液在冠脉血管壁中层或中层与外弹力膜间集聚膨大形成。CIH多由冠脉内膜破裂,血液进入中膜腔,因无出口或出口较小,内膜向内移位,外膜向外移位形成;还有少部分CIH由冠脉滋养血管破裂,内膜没有破口,血液聚集形成[1]。自发冠脉壁内血肿(spontaneous coronary intramural hematoma,SCIH)较为常见,是急性冠脉综合征(acute coronary syndrome,ACS)的原因之一,越来越受到临床重视[2]。
冠脉CT血管成像(computed tomography angiography,CTA)是冠脉病变无创检查手段,可应用于冠脉粥样硬化性心脏病(冠心病)的诊断和随访,但在SCIH患者中的随访价值尚不明确[3]。本研究回顾性分析本院10例SCIH患者行冠脉CTA随访的结果,探讨冠脉CTA在SCIH患者中的应用价值。
1 资料与方法
1.1 研究对象 选择2015年1月1日至2018年12年31日在复旦大学附属中山医院心内科经冠脉造影诊断为SCIH的患者10例,术后均行冠脉CTA随访。收集患者所有临床资料,包括冠脉造影和冠脉血管内超声(intravenous ultrasound,IVUS)检查及随访资料。对比初始冠脉造影和随访冠脉CTA检查结果,测量并比较病变处冠脉管腔直径。本研究经复旦大学附属中山医院伦理委员会批准,所有患者均知情并签署知情同意书。
1.2 诊断标准 SCIH参照欧洲冠脉自发夹层(spontaneous coronary artery dissection,SCAD)指南[2],根据冠脉造影和IVUS结果进行诊断。
1.3 冠脉CTA检查方法 采用320排Aquilion ONE(Canon公司,日本)CT或双源96排SOMATOM Force(Siemens公司,德国)进行检查。心率>70次/min的患者服用美托洛尔12.5~25 mg以降低心率。检查前患者舌下含服硝酸甘油0.5 mg以扩张冠脉。检查流程:先行定位图扫描,再行全心平扫以评价钙化积分,然后行全心增强扫描用于冠脉重建。扫描方法:采取阈值监测触发的扫描模式,监测点为气管隆突下1 cm水平处的降主动脉中心,监测阈值测定为260 HU(Aquilion ONE)或150 HU(SOMATOM Force),达到该阈值即启动屏气全心容积扫描。对比剂采用含碘(370 mg/mL)非离子型造影剂,根据体质量0.8 mL/kg注射,追加0.9%氯化钠液25 mL,速率均为5 mL/s。2种机器均可根据心率的变化灵活应用回顾性心电门控和前瞻性心电门控,选用最佳时相图行冠脉重建。320排和双源CT重建层厚分别为0.5 mm和0.6 mm,层间距均为0.3 mm,螺距依据检查时心率自动匹配。重建方法包括最大密度投影、多平面重建、容积重建和曲面重建。

2 结 果
2.1 一般资料分析 10例患者平均年龄(53.10±10.80)岁,均无糖尿病、心肌梗死、冠脉介入治疗史。10例患者中,高血压4例,高脂血症3例,有吸烟史2例,有猝死家族史1例。女性8例,75%已绝经。90%患者以ACS起病;30%患者为ST段抬高型心肌梗死。超声心动图检查发现节段性左室收缩活动异常2例,左室功能均正常。
2.2 冠脉相关检查及治疗 所有患者入院后均行冠脉造影检查,共累及11根冠脉,靶病变仅在前降支者6例、仅在右冠脉者3例,前降支和回旋支均累及1例。所有患者均无肉眼可见的明显冠脉夹层征象,均表现为局限性或弥漫性管腔狭窄,反复注射硝酸甘油后冠脉无扩张,排除冠脉痉挛。10例患者的SCAD分型以2型多见,占80%(8例),其中2A型1例、2B型3例、2A+2B型4例;3型占20%(2例)。6例患者行IVUS检查发现冠脉壁内血肿,无内膜撕裂、夹层,证实SCIH。9例患者冠脉心肌梗死溶栓(thrombolysis in myocardial infarction,TIMI)血流3级。累及的冠脉按近段、远段各取1处为测量部位,冠脉病变近段管腔直径为(1.54±0.18) mm,远段管腔直径为(0.78±0.17) mm。2型SCIH患者中,6例采用保守治疗,其余2例采用球囊扩张;3型患者采用支架植入术,术后冠脉TIMI血流均为3级。
2.3 药物应用情况 2例患者术后单用阿司匹林抗血小板治疗,其余8例患者采用阿司匹林及氯吡格雷(或替格瑞洛)进行双联抗血小板聚集治疗1年。6例患者服用美托洛尔。所有患者均服用血管紧张素转换酶抑制剂或血管紧张素受体阻滞剂。2例患者服用硝酸酯类药物;9例患者服用他汀类药物;2例患者服用非二氢吡啶类钙离子拮抗剂。
2.4 随访情况 平均随访(44.89±8.45)个月,术后所有患者均未出现胸闷、胸痛。4例患者1年后停用氯吡格雷(或替格瑞洛);6例患者停用阿司匹林。5例患者停用美托洛尔;5例患者停用血管紧张素转换酶抑制剂或血管紧张素受体阻滞剂;5例患者停用他汀类药物。无患者再服用硝酸酯类药物或非二氢吡啶类钙离子拮抗剂。末次随访时超声心动图较发病时无明显变化。
平均冠脉CTA随访时间为(8.2±5.2)个月,所有患者均无钙化、双轨征(冠脉夹层)、管壁低密度影(壁内血肿)、冠脉狭窄;所有患者冠脉管腔较前扩大。原病变近段未行支架植入处管腔直径为(2.60±0.14) mm、支架植入处管腔直径为(3.33±0.58) mm、原病变处远段管腔直径为(1.59±0.30) mm,均大于发病时(P<0.05)。1例行支架植入患者术后12个月复查冠脉造影,提示支架内再狭窄,行药物球囊治疗术,24个月后冠脉CTA示支架通畅。其余3例行支架植入术患者复查冠脉CTA(图1)显示支架均通畅,未见支架内狭窄,均无支架外低密度影,但受空间分辨率的影响,原受累冠脉末梢段和细小分支显示不清晰。
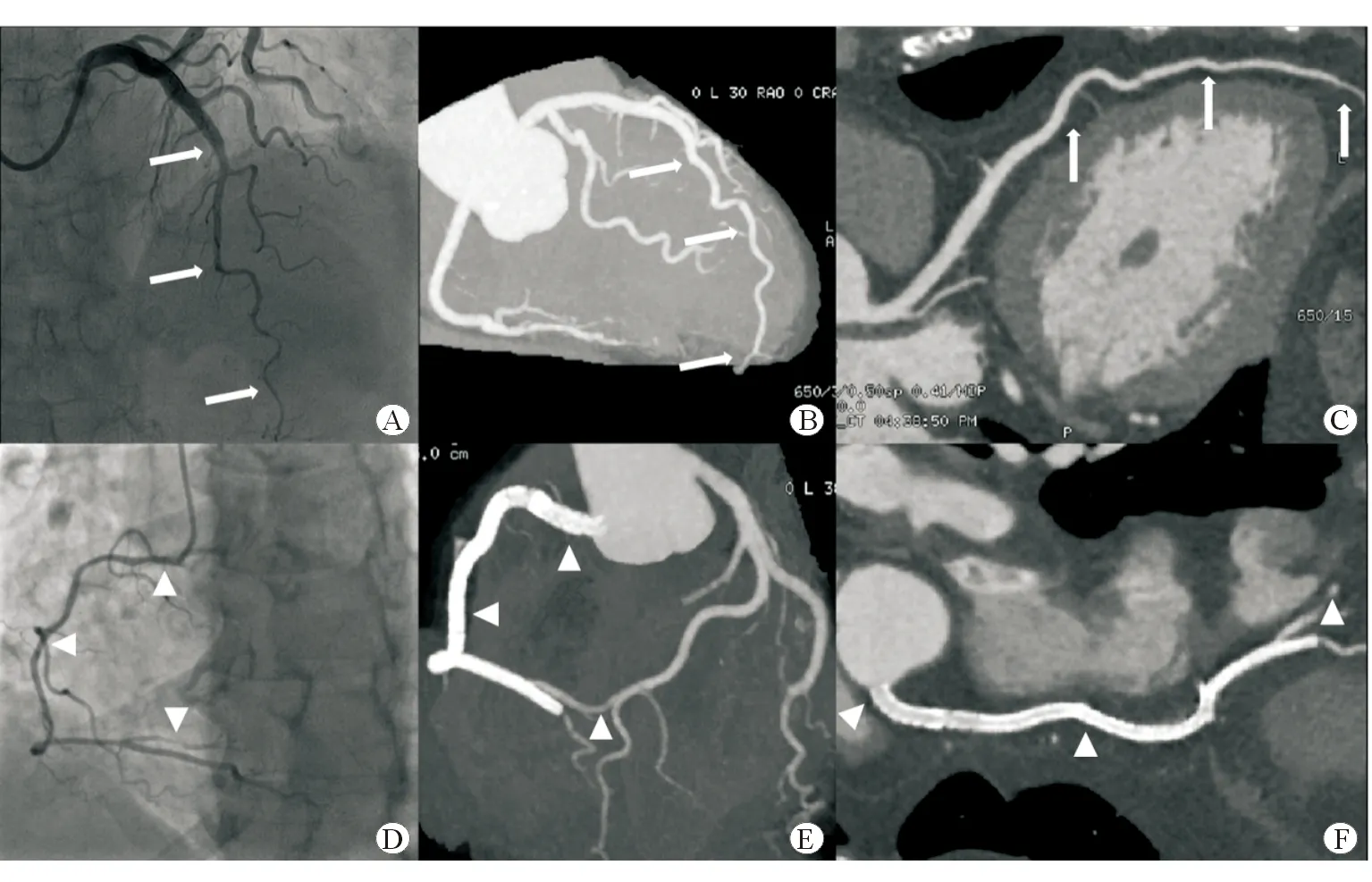
图1 典型SCIH病例冠脉造影及冠脉CTA随访结果
3 讨 论
SCIH是SCAD中的一种亚型,是无内膜夹层的SCAD[4]。欧洲共识[2]将SCAD分为4型:1型为经典的冠脉夹层;2型为冠脉中段至远段的长段弥漫性光滑的狭窄(累及中段时为2A型,延伸至远段时为2B型);3型为局限性狭窄;4型为冠脉完全闭塞。2型和3型无明显破裂内膜片,均为SCIH,其中以2型常见。SCAD多见于青中年女性,除高血压外,其他冠心病危险因素较少见。SCAD多以ACS起病,冠脉内IVUS和光学相干断层扫描(optical coherence tomography,OCT)影像学检查可确诊。但由于冠脉内操作可能破坏冠脉血肿及对远端血流的不良影响,临床常依据临床特征和冠脉表现诊断SCIH/SCAD[2]。SCIH患者冠脉造影影像并无典型冠脉夹层征象,极易漏诊或误诊;特别是3型,排除冠脉痉挛后,常需腔内影像学检查以明确诊断。因此,介入医师对ACS患者要仔细鉴别,必要时行IVUS或OCT辅助诊断。SCAD预后一般良好,目前首选保守治疗,但对于血流动力学不稳定、血肿快速进展的患者,需及时介入治疗或外科干预[2]。
冠脉CTA较冠脉造影检查方便、无创、不会导致医源性冠脉夹层或损伤,可作为冠脉病变检查的筛查手段[5],尤其适用于低危非ST段抬高型心肌梗死患者[6]。经典的1型SCAD表现为“双腔征”,即撕裂的冠脉内膜片位于冠脉真腔和假腔之间,冠脉CTA中并不多见[6]。大多数SCAD在冠脉CTA中表现为SCIH:破裂的内膜片不可见;低密度影的壁内血肿环绕冠脉管腔伴有管壁增厚或冠脉扩张、管径增大呈袖套样;管腔突然狭窄或呈锥形长段狭窄[7];易误诊为冠脉粥样硬化[6]。因此,冠脉CTA检查SCIH/SCAD有其局限性[8]:(1)空间分辨率、时间分辨率低[9];(2)冠脉CTA有时难以区分冠脉粥样斑块所致冠脉狭窄和冠脉壁内血肿,诊断SCIH的准确率更低[9];(3)对于边支和末梢的冠脉病变易漏诊[10],尤其是SCIH;(4)存在钙化病变时,不能清晰显示SCIH/SCAD[11];(5)不能同时行冠脉介入治疗[12]。所以,冠脉CTA阴性时不能排除SCIH[13],其诊断SCIH/SCAD的价值仍需进一步研究。
尽管有其局限性,冠脉CTA对SCIH/SCAD特别是SCIH的诊断并不是最佳手段,但对其随访很有价值[14]。绝大部分SCIH血肿均可自行吸收,因此仅采用冠脉CTA就可无创动态观察病情变化,判断夹层愈合情况、壁内血肿范围及厚度,测量管腔大小,对于SCIH 的随访有其独特优势[14]。本研究10例患者中,6例采用保守治疗、4例行支架植入术,所有患者随访冠脉CTA均无夹层、钙化表现。6例接受保守治疗的患者随访冠脉CTA发现,受累冠脉管腔无明显狭窄或斑块,与术前冠脉造影结果比较,冠脉壁内血肿、狭窄消失,冠脉结构明显恢复。4例患者行支架植入术,随访冠脉CTA发现冠脉支架内无明显内膜增生、支架外未见血肿征象。但由于空间分辨率低,冠脉CTA不能清晰显示末梢冠脉结构[10],因此难以准确判断2B型及分支SCIH末梢恢复情况,仅能根据同一冠脉中远段恢复情况来推断。
综上所述,冠脉CTA可无创显示冠脉管腔,可通过与术前冠脉造影结果比较了解SCIH的恢复情况,是SCIH的首选随访方法,特别适用于拒绝行冠脉造影术复查的患者。但对于累及末梢、细小分支的SCIH,冠脉CTA不能完整、清晰显示,有待于技术和设备的创新和改进。

