二种氧化体系中氯苯降解的响应面优化及中间体研究
徐向阳,唐华晨,张宏,徐新,李超,王殿二
(光大环境修复(江苏)有限公司,江苏 南京 211100)
氯苯(CB)化合物是化工产品加工过程中重要的原料和农药中间体,广泛应用于染料、农药、防腐剂、杀菌剂等精细化工生产领域[1]。由于CB常温常压下化学性质稳定,具有生物积累性和生物毒性,且难以被生物降解,环境中的CB会对水体、土壤和大气造成污染,给人类健康带来极大危害[2-4];因此,如何高效安全地处置环境中的CB污染物对于生态环境和谐稳定具有重要意义。
目前,生物法、物理吸附、化学氧化法等传统的处理方法难以实现CB的有效降解,而基于羟基自由基(·OH)或硫酸根自由基(4SO-·)的高级氧化技术(AOPs)[5]因其氧化性强、稳定性高、pH适用范围广等优点[6-8],在处理难降解有机废水领域具有巨大的应用潜力。·OH和 4SO-·具有强氧化性,可有效氧化CB[9-10],但在·OH和 4SO-·氧化CB的过程中,CB容易生成多种氯代酚类中间体[11-13],包括邻氯苯酚(o-CBOH)、间氯苯酚(m-CBOH)和对氯苯酚(p-CBOH),这些氯代中间体的毒性高于CB,属于高毒性物质,且在水中的溶解度远大于CB,这就造成了中间体的二次污染[14-16]。因此,在利用高级氧化技术降解CB废水的过程中,如何防治CB的二次污染是研究的重点与难点。
响应面法(RSM)是一种综合实验设计和数学建模的优化方法,可以采用二次回归方程拟合多个因素与多个响应值之间的函数关系,通过回归方程建立数学模型,寻求最佳工艺参数[17-18],现正越来越多地被应用于各种工艺条件的优化过程[19]。为此,以CB降解率和CB中间体产物为评价依据,运用响应面法并结合Box-Behnken设计方法[20]对氧化CB的主要影响因素进行建模优化,以获得最佳的降解条件,从而达到CB污染物被降解及其中间体得到控制的目标。但是该法在 4SO-·氧化降解废水的工艺优化中应用较少。
基于此,本研究采用响应面法对芬顿(Fe2+/H2O2)和亚铁离子活化过硫酸钠(Fe2+/PS)二种氧化体系降解CB的影响因素(包括初始pH、催化剂投加量及氧化剂投加量)进行建模优化,并以CB降解效果和中间体副产物产生量为评价依据,以期得到最佳的降解条件,实现CB污染物高效去除及中间体二次污染减少的目标。
1 实验
1.1 仪器与试剂
Agilent8860型气相色谱仪、Agilent5977B型质谱仪,美国安捷伦科技公司;SAH-C型水平振荡器,常州金瑞尔电器有限公司;HJ-6A型数字恒温磁力搅拌器,金坛市医疗仪器厂;ME204/02型分析天平,梅特勒托利多有限公司。
氯苯、对氯苯酚、七水合硫酸亚铁(FeSO4·7H2O)、过硫酸钠(Na2S2O8)、双氧水(H2O2)、氢氧化钠(NaOH)、硫酸(H2SO4)、甲醇(CH3OH)、叔丁醇(C4H9OH)和硫代硫酸钠(Na2S2O3)均购自国药集团化学试剂有限公司,且均为分析纯。实验用水为超纯水。
1.2 降解实验
地下水样品取自常州市某污染场地,其CB质量浓度为154.86 mg/L。为了使模拟实验与实际场地的地下水污染物浓度一致,配制质量浓度为154.86 mg/L的CB溶液。
1.2.1 Fe2+/H2O2体系降解CB实验
向装有1000 mL质量浓度为154.86 mg/L的CB溶液的棕色螺口瓶中添加一定量的FeSO4与H2O2。用0.1 mol/L的H2SO4或NaOH调节反应溶液的pH后,每到预定的时间(0、20、40、60、120、180、240、300、360和420min)就取出20 mL反应液,向其中加入Na2S2O3终止反应,然后置于4 °C冰箱中待气相色谱-质谱联用仪(GC-MS)检测。
1.2.2 Fe2+/PS体系降解CB实验
向装有1000 mL质量浓度为154.86 mg/L的CB溶液的棕色螺口瓶中添加一定量的FeSO4与PS,用0.1 mol/L的H2SO4或NaOH调节反应溶液的pH后,每到预定的时间(0、1、2、3、4、5、6和7 d)就取出20 mL反应液,向其中加入Na2S2O3终止反应,然后置于4 °C冰箱中直至用GC-MS进行检测。
以上所有实验每组设3个平行样,取平均值,实验数据的标准相对偏差不超过8%。按式(1)计算CB的去除率 CBη。

式中 tρ表示反应t时间后CB的质量浓度,0ρ表示反应之初CB的质量浓度。
1.3 检测方法
样品中CB和CB中间体产物的浓度使用配备有DB-5型色谱柱的Agilent 8860-5977B型GC-MS进行分析。进样口温度220 °C,分流进样(分流比10∶1),氦气流量为1.0 mL/min。升温程序:35 °C恒温2min,然后以15 °C/min的速率升温至150 °C,并恒温5min,再以3 °C/min升温至290 °C,在290 °C下保持2min。质谱设置条件为:离子源温度230 °C,离子化能力70 eV,接口温度280 °C,质量扫描范围35~450 amu。
采用液液萃取法对反应液中的CB及CB中间体产物进行萃取。用量筒移取20 mL反应溶液,加入少量硫代硫酸钠,并用1∶20的稀硫酸溶液调节溶液呈酸性,而后加入20 mL二氯甲烷。在水平振荡器中以300 r/min的速率恒温振荡30min进行萃取。萃取完成后,萃取液经有机滤膜过滤后上机检测。
配制质量浓度分别为0.00、10.00、20.00、50.00、80.00、100.00和180.00 mg/L的CB和质量浓度分别为0.00、5.00、10.00、20.00、50.00、80.00和100.00 mg/L的p-CBOH混标标准溶液,使用GC-MS进行检测分析,以响应值为纵坐标,分别以CB、p-CBOH浓度为横坐标绘制标准曲线,如图1和2所示。CB在质量浓度(x)为0.0~180.0 mg/L的范围内与响应值(y)的线性关系良好,其回归方程为y=11512.7742x,决定系数(R2)为0.999;p-CBOH的质量浓度(x′)与响应值(y′)的线性范围是0.0~100.0 mg/L,其回归方程为y′ =7991.7081x′,决定系数为0.993。

图1 CB的标准曲线 Figure 1 Standard curve for CB

图2 p-CBOH的标准曲线 Figure 2 Standard curve for p-CBOH
1.4 实验设计及数据分析方法
选择影响CB降解速率常数的3个主要因素——溶液初始pH、氧化剂(H2O2或Na2S2O8)投加量和催化剂FeSO4投加量进行考察,以溶液中CB质量浓度和p-CBOH质量浓度为响应值,采用响应面法在三因子三水平实验基础上对降解条件进行优化。
2 结果与讨论
2.1 Fe2+/H2O2体系氧化降解CB的参数优化
由前期的单因素实验结果得知,H2O2投加量、FeSO4投加量和溶液pH对CB的降解效果及中间体p-CBOH的生成影响较大,因此分别在低(-1)、中(0)、高(1)3个水平上对降解实验进行中心组合设计(见表1),共有17个实验点。轴向点代表每个独立变量的极值水平,中心点代表中心水平,重复5次使拟合方程具有旋转性和通用性,并评估实验误差,从而筛选出主效因子及确定因子的交互作用。实验结果见表2。

表1 Fe2+/H2O2体系响应面分析因子及其水平 Table 1 Factors and their levels in response surface analysis of Fe2+/H2O2 system

表2 响应面设计与结果 Table 2 Response surface design and test result
设CB和p-CBOH质量浓度的预测模型为:

式中N为预测值,0β、iβ、iiβ分别是常数项、线性回归系数和二次项回归系数,ijβ是交互作用系数,为自变量实际取值。
由Design-Expert软件对数据进行回归分析,得出p-CBOH的回归方程为:N= 3.86771X1+ 1.51750X2+ 4.94167X3- 0.50583X1X2- 1.64722X1X3+ (1.42504 × 10-15)X2X3- 11.43846。相关的方差分析见表3。
由表3可以看出,用上述回归方程描述各因素与响应值之间的关系时,因变量与全体自变量之间的线性关系有一定的显著性(r= 106.75 ÷ 164.79 = 0.648),此回归方差模型是较为显著的。
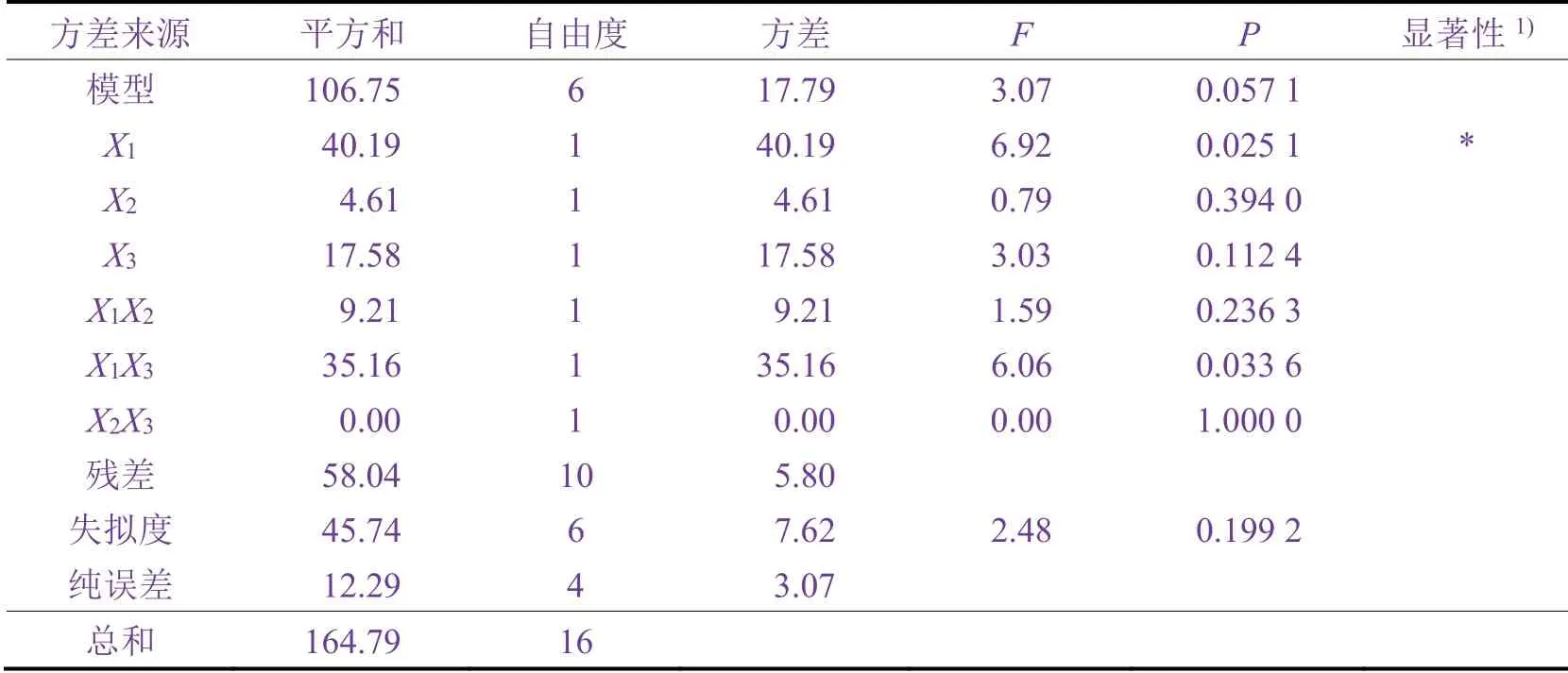
表3 p-CBOH的方差分析表 Table 3 Analysis of variance table of p-CBOH
由表3还可看出,3个因子对p-CBOH生成的显著性影响顺序为:溶液pH > FeSO4投加量 > H2O2投加量。选择显著性较大的因子进一步作响应面实验,将其他因子固定在较好的水平上。由于污染场地的CB质量浓度为154.86 mg/L,因此根据表2的响应面设计结果在该条件下进行实际实验,将所得实验结果输入响应面软件,得到了H2O2投加量、FeSO4投加量和溶液pH对中间体p-CBOH生成量影响的响应面图,分别如图3、4、5所示。
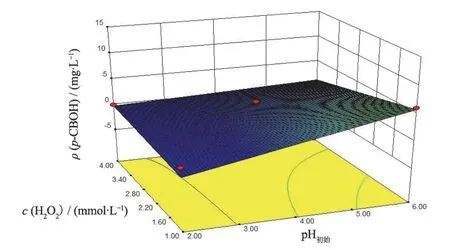
图3 H2O2投加量和pH对p-CBOH产量的影响 Figure 3 Effects of H2O2 dosage and pH on production of p-CBOH
可以看出,p-CBOH产量随着pH和FeSO4投加量的增加而增大,而随着H2O2投加量的增加先增大后减小。pH对p-CBOH产量的影响最为显著,表现为曲线较陡,H2O2和FeSO4投加量次之,表现为曲线较为平滑。p-CBOH质量浓度响应存在最小值,通过软件预测得到p-CBOH质量浓度最小值的条件为:pH 2.40,H2O2投加量1.31 mmol/L,FeSO4投加量1.41 mmol/L。在此条件下,p-CBOH的响应预测值为0.36 mg/L,CB的响应预测值为0 mg/L。
为验证该模型预测的准确性,按照优化后的降解条件进行实验,所得p-CBOH的3次平均产量为0.30 mg/L,CB的去除率为100%,与预测较吻合,表明该模型能很好地预测实际情况。

图4 FeSO4投加量和pH对p-CBOH产量的影响 Figure 4 Effects of FeSO4 dosage and pH on production of p-CBOH
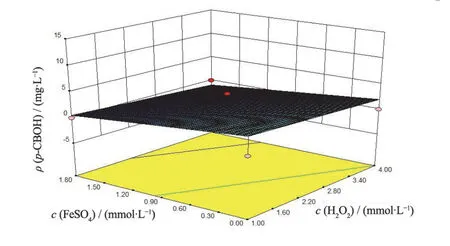
图5 FeSO4投加量和H2O2投加量对p-CBOH产量的影响 Figure 5 Effects of FeSO4 and H2O2 dosages on production of p-CBOH
2.2 Fe2+/PS体系氧化降解CB的参数优化
与2.1节类似,对Na2S2O8投加量、FeSO4投加量和溶液pH分别取低(-1)、中(0)、高(1)3个水平(见表4),按中心组合设计进行CB降解实验并考察中间体p-CBOH的生成,结果列于表5。

表4 Fe2+/PS体系响应面分析因子及水平表 Table 4 Response surface analysis factors and levels of Fe2+/PS system

表5 响应面设计与试验结果 Table 5 Response surface design and test result
同样按式(2),用Design-Expert软件对表5的数据进行回归分析,p-CBOH质量浓度的回归方程为:N=91.81020 -24.55725+3.50690-33.72283+1.16350+2.23917+0.3321.970875-0.29080+4.81444。p-CBOH的方差分析见表6。

表6 p-CBOH的方差分析表 Table 6 Analysis of variance table of p-CBOH
由表6可以看出,用上述回归方程描述各因素与响应值之间的关系时,因变量与全体自变量之间的线性关系有一定的显著性(r= 2731.52 ÷ 2983.04 = 0.916),此回归方差模型是较为显著的。
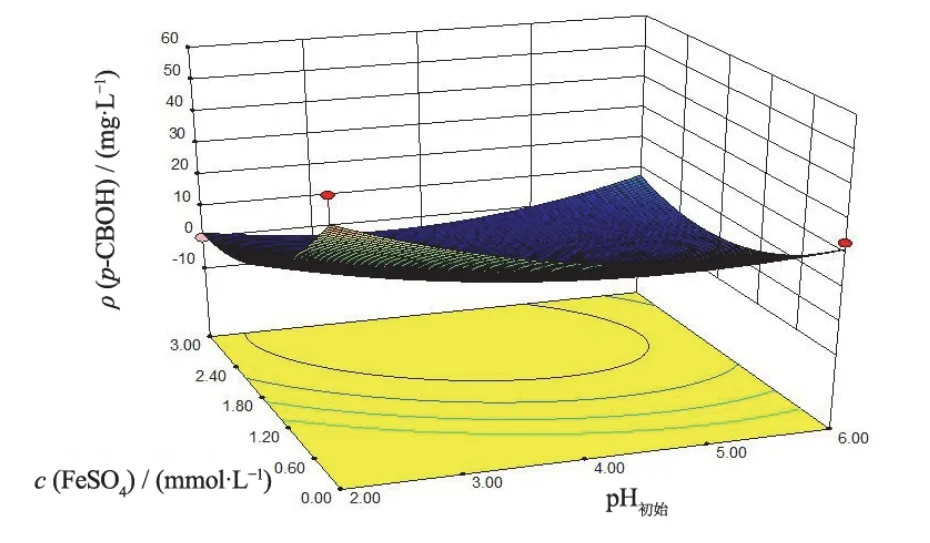
图7 FeSO4投加量和pH对p-CBOH产量的影响 Figure 7 Effects of FeSO4 dosage and pH on production of p-CBOH

图8 FeSO4投加量和Na2S2O8投加量对p-CBOH产量的影响 Figure 8 Effect of FeSO4 and Na2S2O8 dosages on production of p-CBOH
由表6还可看出,3个因子对p-CBOH生成的显著性影响顺序为:FeSO4投加量 > 溶液pH > Na2S2O8投加量。选择显著性较大的因子进一步作响应面实验,将其他因子固定在较好的水平上。根据表5的响应面设计结果,在154.86 mg/L CB的条件下进行实际实验,得到如图6、7和8所示的pH、Na2S2O8投加量和FeSO4投加量对中间体p-CBOH生成量影响的响应面图。可以看出p-CBOH产量随着pH和FeSO4投加量的增加先减小后增大,而随着Na2S2O8投加量的增加先增加后减小。FeSO4投加量对p-CBOH 产量的影响最显著,表现为曲线较陡,Na2S2O8投加量和pH次之,表现为曲线较为平滑。p-CBOH质量浓度的响应存在最小值,预测其条件为:pH 4.00,Na2S2O8投加量3.50 mmol/L,FeSO4投加量1.50 mmol/L。此条件下,p-CBOH响应预测值为0.00 mg/L,CB响应预测值为0.00 mg/L。
按照优化后的降解条件进行实验,所得p-CBOH的3次平均产量为0.00 mg/L,CB的去除率则为100%,也与预测较吻合。
3 结论
(1)响应面法与实际验证实验相结合,得出Fe2+/H2O2体系降解CB而产生p-CBOH中间体最少的条件为:pH 2.40,H2O21.31 mmol/L,FeSO41.41 mmol/L。而Fe2+/PS体系降解CB时产生p-CBOH中间体最少的条件为:pH 4.00,PS 3.50 mmol/L,FeSO41.50 mmol/L。预测的响应值与实际实验的结果较吻合。
(2)对于Fe2+/H2O2体系,pH对CB降解时p-CBOH产量的影响最为显著,H2O2和FeSO4投加量次之;对于Fe2+/PS体系,FeSO4投加量对CB降解时p-CBOH产量的影响最为显著,Na2S2O8投加量和pH次之。

