肺癌患者肺组织微生物多样性及丰度变化研究*
杨冬华,李文军,张慧玲,绽 丽,刘佳雯,张永栋△
(青海大学附属医院:1.院感科;2.胸外科,西宁 810000)
在我国,肺癌死亡人数顺位为恶性肿瘤的第1位[1],给社会带来巨大的医疗、经济负担。随着测序技术的发展,研究证实,在健康状态下肺部也存在丰富的细菌微生物群落[2]。而人体微生物生态是指在一定空间范围内,细菌、真菌、病毒形成的微生物群落以其宿主的组织和细胞及其代谢产物为环境而形成的统一生物系统[3-4]。并且,对肺部微生态与呼吸系统疾病的研究为目前研究热点。然而目前的研究方向主要集中于肺部细菌微生态与慢性气道疾病[5-7],如慢性阻塞性肺疾病(COPD)、哮喘等。关于肺部细菌微生态与肺癌的相关研究相对较少。本研究拟通过Illumina平台,采用16S rDNA 高通量测序的方法研究不同分型肺癌患者的肺部微生物组学,分析肺癌患者肺组织的微生物组学特征,初步探讨肺部细菌微生态与肺癌的相关性及可能机制。
1 资料与方法
1.1 一般资料
选取2019年本院病理诊断为肺癌的行肺叶切除术或修补术的19例住院患者。其中男14例,女5例;平均年龄(59±6.8)岁。知情同意后术中无菌操作取黄豆大小肺组织一块液氮速冻后放置-80 ℃冰箱储存。取的部位为局部组织(癌变组织周围,距病变1 cm处)和周围组织(相对远离癌变组织)。按照不同部位分组:距离病变1 cm处的组织为A1组,远离癌变部位的组织为B1组;按照不同病理状态分组:小细胞癌肺组织为A2组,非小细胞癌肺组织为B2组。
纳入标准:(1)年龄30~85岁,无手术禁忌证,经组织病理学诊断为小细胞癌和非小细胞癌的住院患者;(2)入院前1周无抗感染治疗;(3)临床病例信息资料完整。
排除标准:(1)年龄<30岁或>85岁;(2)合并阻塞性肺炎;(3)合并支气管哮喘、肺结核、COPD、艾滋病(HIV)、糖尿病、特发性肺纤维化等可能影响微生物组学特征的其他疾病;(4)曾有粉尘接触史或其他特殊接触史患者;(5)切取肺组织过程中未按照无菌操作或被污染的标本;(6)临床信息资料不完整。所有标本的采集都经过本院伦理委员会批准。
1.2 方法
1.2.1DNA提取
肺组织DNA抽提步骤如下:(1)取100 mg左右肺组织样品加入2 mL离心管中,加3粒钢珠,液氮震碎,在组织破碎仪上50 Hz,30 s。(2)加入700 μL SDS裂解液,加入20 μL蛋白酶K,65 ℃水浴放置40 min,期间颠倒混匀数次,加入等体积酚∶氯仿∶异戊醇(25∶24∶1),颠倒混匀,12 000 r/min离心10 min。(3)小心取上清液,加入等体积的氯仿:异戊醇(24∶1)顛倒混匀,12 000 r/min离心10 min,取上清液,转移至新的1.5 mL离心管中;加入2/3上清液体积的异丙醇;3 μL糖原(20 mg/mL);1/10体积的3 mol/L的醋酸钠;混匀,—20 ℃静置30 min以上,12 000 r/min离心10 min。(4)弃上清液,75%乙醇(现配现用)洗1遍,12 000 r/min离心5~10 min,室温静置5 min,至乙醇挥发完全,按DNA沉淀的多少加入DNase-free水(50~100 μL)溶解DNA,轻柔吹打混匀,室温静置2~5 min,直至DNA完全溶解。
1.2.2PCR扩增16SrDNA基因功能基因的不同区域
本试验选用长度约为250 bp的细菌 16S rRNA基因的高度可变的V4区用来测序。PCR 扩增选用细菌16S rDNA V4区特异性引物 520F(5′-barcode+AYT GGG YDT AAA GNG-3′),802R(5′-TAC NVG GGT ATC TAA TCC-3′)。
1.2.3文库构建
利用 TruSeq Nano DNA LT Library Prep Kit 进行建库。(1)进行的末端修复过程是利用试剂盒中的End Repair Mix2 将 DNA 5′端突出的碱基切除,3′端缺失的碱基补齐,同时在5′端加上一个磷酸基团;(2)3′端加A,这一过程中,DNA的3′端会单独加上一个A碱基,以防止 DNA 片段的自连,同时保证 DNA与 3′端有一个突出T碱基的测序接头相连;(3)加有特异性标签的接头,此过程是为了让 DNA 最终杂交到 Flow Cell 上;(4)通过PCR扩增已经加上接头的DNA片段,然后利用 BECKMAN AMPure XP beads 纯化PCR体系;(5)通过2%琼脂糖凝胶电泳来对文库做最终的片段选择与纯化。
1.2.4文库质检与测序
1.2.4.1文库质检与定量
取1 μL 文库,在 Agilent Bioanalyzer 机器上用 Agilent High Sensitivity DNA Kit 对文库做 2100 质检,合格的文库应该有单一的峰,无接头。 利用 Quant-iT PicoGreen dsDNA Assay Kit 在 Promega QuantiFluor上对文库进行定量,合格的文库计算后浓度应在 2 nmol/L以上。
1.2.4.2测序
对合格的文库,在 MiSeq机器上利用MiSeq Reagent Kit V3(600cycles)进行2×300 bp的双端测序。首先将需要上机的文库(Index 不可重复)梯度稀释到 2 nmol/L,然后按所需数据量比例混样。混好的文库经0.1 mol/L NaOH 变性成单链进行上机测序。所上文库量的多少可根据实际情况控制在 15~18 pmol/L。
1.3 统计学处理
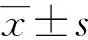
2 结 果
2.1 肺癌患者肺部微生物种群在各分类单元的相对丰度
门水平主要为变形菌门(78.0%)、拟杆菌门(12.3%)、放线菌门(3.9%)、栖热菌门(1.2%)、厚壁菌门(1.4%)。属水平主要为苍白杆菌属(19.4%)、沉积物杆状菌属(11.3%)、不动杆菌属(6.6%)、贪铜菌属(3.5%)、土壤杆菌属(2.4%)、拟无枝菌酸菌(1.7%)、鞘脂单胞菌属(1.4%)、甲基杆菌属(1.2%)、栖热杆菌属(1.2%)、短波单胞菌属(1.1%)、叶杆菌属(0.8%)、噬几丁质杆菌属(0.2%)、链球菌(0.2%)、韦荣球菌(0.1%),以及未能分类到属层面的物种,包括丛毛单胞菌科(18.6%)、变形菌纲(4.8%)、茎杆菌科(4.1%)、伯克霍尔德菌科(1.4%)、柄杆菌科(1.0%),见表1。

表1 肺癌患者肺部微生物种群在各分类单元的相对丰度
2.2 A1组和B1组在属水平菌群分类学组成
A1组和B1组微生物种群在属水平层面顺位前20的包括苍白杆菌属、沉积物杆状菌属、不动细菌属、贪铜菌属、拟无枝酸菌属、土壤杆菌属、假平胞菌属、栖热菌属、甲基杆菌属、短波单胞菌属、氨基杆菌、叶杆菌属、戴尔福特菌、链球菌、短杆菌属、不黏柄菌属、假单胞菌、葡萄球菌属、红游动菌属、鞘脂菌属,其中两组之间微生物物种丰度差异有统计学意义的为甲基杆菌属(P=0.036)和红游动菌属(P=0.03),其他微生物物种丰度差异无统计学意义(P>0.05)。见表2。

表2 A1组和B1组在属水平菌群分类学组成
2.3 A2组和B2组在属水平菌群分类学组成
A2组和B2组微生物种群在属水平层面顺位前20的包括苍白杆菌属、沉积物杆状菌属、不动细菌属、贪铜菌属、拟无枝酸菌、土壤杆菌属、假平胞菌属、栖热菌属、甲基杆菌属、短波单胞菌属、氨基杆菌、叶杆菌属、戴尔福特菌、链球菌、短杆菌属、不黏柄菌属、假单胞菌、葡萄球菌属、克拉菌属、鞘脂菌属,微生物物种丰度两组之间均差异无统计学意义(P>0.05)。见表3。

表3 A2组和B2组在属水平的菌群分类学组成
2.4 属水平A2组和B2组优势种群
通过Lefse判别分析,找出A2组和B2组有特异的主要菌群。小细胞癌组中主要菌群为叶杆菌属、动球菌科、噬纤维菌目、纤维黏网菌。B2组中主要菌群为假单胞菌科、假单胞菌属、嗜热油菌纲、SHA_31、绿弯菌门、绿弯菌目、绿弯菌科、弧菌目、假交替单胞菌科、假交替单胞菌属、绿线菌属等。

表4 属水平A2组和B2组优势种群
3 讨 论
肺癌疾病负担严重,目前研究为肺癌患者肺部微生物种群特征提供了新的视角[8-9]。本研究收集肺癌患者肺部组织并进行微生物多样性测序。测序结果显示,肺癌患者肺部微生物门水平主要为变形菌门(78.0%)、拟杆菌门(12.3%)、放线菌门(3.9%)、栖热菌门(1.2%)、厚壁菌门(1.4%)。属水平主要包括苍白杆菌属(19.4%)、未分类丛毛单胞菌科(18.6%)、沉积物杆状菌属(11.3%)、不动杆菌属(6.6%)等。APOPA等[4]对肺活检组织的微生态构成进行研究,发现肺癌患者有相似的微生态构成,以拟杆菌门和变形菌门为主,包括无色菌属、不动杆菌属、放线菌属、伊丽莎白菌属、罗氏菌属和鞘氨醇杆菌属等;同时,库克菌属、假单胞菌属、链球菌属和葡萄球菌属等机会致病菌也在肺癌患者中广泛存在。同时比较了同一患者距离病变组织1 cm处的组织和相对远离癌变部位组织的微生物组成情况。两组菌群序列量顺位靠前的为苍白杆菌属、沉积物杆状菌属、不动细菌属、贪铜菌属、拟无枝酸菌等,并且两组差异无统计学意义(P>0.05)。
一项大型的病例对照研究提示,反复使用青霉素类、头孢类、大环内酯类药物会增加肺癌患病风险,提示肺部菌群失衡可能与肺癌相关[10]。 菌群失衡表示某些致病细菌丰度的失调,进而可能通过产生过多的毒性物质、介导炎性反应而促进肺癌的发生、发展[11]。本次研究中A2组和B2组物种多样性分析显示,物种分类组成排在前20的物种两组之间并无明显差别(P>0.05),通过判别分析进行物种差异性分析,A2组丰度均值相对较高的物种为叶杆菌属、动球菌科、噬纤维菌目、纤维黏网菌,而在B2组内丰度均值相对较高的物种分别为假单胞菌、嗜热油菌纲、绿弯菌门、 绿弯菌目、绿弯菌科、弧菌目、假交替单胞菌科、假交替单胞菌属、绿线菌属。本研究中非小细胞癌组中基本为鳞癌,而鳞癌的发病机制与肺部炎症的发生、气道阻塞的形成等相关[11-12],从而可能使肺部存在更多的优势菌落,并相比另外一组,该组中存在假单胞菌、假交替单胞菌科、假交替单胞菌属等潜在的定值菌,而该类菌属是引起肺部囊性纤维化、COPD等结构性肺病变等疾病的主要机会致病菌[13-15]。因此,肺部细菌与宿主之间可能存在复杂的相互作用。肺部细菌可能促进肺癌的发生、发展,而宿主因素例如吸烟状态、基因突变等又可能反过来影响肺部细菌,交织成复杂的关系网络。

