高脂饮食致非酒精性脂肪性肝病大鼠小肠、肝脏中NOD 样受体蛋白3及相关炎症因子的表达*
夏恩蕊,张素妍,田格格,李 浩,杜玉锐,张顺贞
(云南中医药大学中药学院,云南 昆明 650500)
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是一种与胰岛素抵抗和遗传易感密切相关的代谢应激性肝损伤,疾病谱包括非酒精性肝脂肪变、非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)、肝硬化和肝细胞癌[1]。随着肥胖发病率的增加,NAFLD 已成为全球关注的主要健康问题之一。NLRP3 是一种模式识别受体(PRRs),隶属于NOD 样受体家族(NOD-like receptor,NLRs),是NLRP3 炎症小体的组成部件之一[2]。在病原体相关分子模式(PAMPs)或损伤相关分子模式(DAMPs)的刺激下,NLRP3 可出现上调,启动炎症小体的组装,介导大量IL-18、IL-1β 的释放[3-5]。NAFLD 上调肝脏中NLRP3,进而诱导IL-18、IL-1β 的增加[6],这一过程是单纯脂肪肝进展到NASH 及肝纤维化的关键因素之一[7]。本研究旨在探讨NAFLD 模型大鼠小肠、肝脏中NLRP3 及相关炎症因子表达情况。
1 材料与仪器
1.1 动物 SD 雄性大鼠(180~220 g)20 只[购自湖南斯莱克景达实验动物有限公司,生产许可证号:SCXK(湘)2016-0002,实验单位使用许可证编号:SYXK(滇)K2013-0002]。
1.2 试剂 高脂饲料(82.5%普通饲料、10%猪油、2%胆固醇、0.5%胆酸钠、5%蛋黄粉)[8]。普通饲料由楚商生物有限公司提供。
ALT、AST、IL-18、IL-1β、脂多糖ELISA 试剂盒(上海酶联生物科技有限公司,MM-0047R)。TC、TG生化试剂盒(南京建成,20190824)。Ultrapure RNA Kit RNA 提取试剂盒(康为世纪,CW0581S);HiFiScript cDNA Synthesis Kit(康为世纪,CW2569M);UltraSYBR Mixture(康为世纪,CW0957M)。NLRP3 抗体(abcam,ab214185)、SP 免疫组化试剂盒(中杉金桥科技公司,2004C1009)、DAB 显色试剂盒(中杉金桥科技公司,2024G0331)。
1.3 仪器 垂直板电泳装置(TanonVE-180P RE)、垂直板电泳胶转膜仪装置(Tanon VE-586)、荧光定量PCR 仪(Heal Force,CG)、石蜡切片机(Thermo,Finesse 325)、显微镜(奥林巴斯,CX23)。
2 方法
2.1 动物分组及取材 将20 只SD 雄性大鼠随机分为2 组,即正常组、高脂饮食组,每组各10 只。正常对照组给予普通饲料,高脂饮食组给予高脂饲料。4 周末每组取2 只验模,8 周末处死动物,收集血清、肝脏及小肠样本。肝大叶置于4%多聚甲醛固定,室温保存。其余肝脏和小肠分装一份置于RNA保存液中,其余分装后-80℃保存。血清样本分装后-80℃保存。
2.2 血清肝功能变化 血清4℃解冻,根据试剂盒说明书检测大鼠血清ALT、AST、TC、TG 水平。
2.3 肝脏组织病理切片 取4%多聚甲醛固定的肝大叶,常规操作制备肝组织石蜡切片,HE 染色后显微镜下(10×40 倍)拍摄病理图片。
2.4 ELISA 试剂盒检测大鼠血清、肝脏炎性因子按试剂盒说明书操作,检测血清、肝组织中的IL-18、IL-1β。
2.5 RT-PCR 法检测大鼠肝脏、小肠组织中NLRP3mRNA 表达量 按试剂盒步骤提取RNA,测定浓度和纯度。利用Primer3 软件设计引物序列,由华大基因合成,以RT-PCR 方法检测NLRP3mRNA 水平。
2.6 免疫组化法检测大鼠肝脏、小肠组织中NLRP3蛋白表达水平 肝脏切片进行常规脱蜡复水、抗原修复、过氧化物酶结合、抗原封闭。NLRP3 一抗4℃孵育过夜,37℃复温30 min,PBS 冲洗,滴加二抗,37℃孵育20 min,PBS 冲洗。DAB 显色5 min,PBS 冲洗,苏木精复染5 min,盐酸酒精分化1~3 s,自来水冲洗10 min,常规脱水,透明,封片,镜检。
2.7 统计学分析 通过SPSS20.0 软件进行处理,计量资料以(±s)表示,组间比较采用独立样本t 检验,P<0.05 为差异具有统计学意义。免疫组化结果使用Image-Pro Plus 6.0 软件进行阳性率统计。
2.8 伦理学审查 本研究方案经由云南中医药大学实验动物伦理委员会审批(批号:R-06201947),符合实验室动物管理与使用准则。
3 结果
3.1 肝组织病理学变化
3.1.1 肝脏形态观察 正常组大鼠肝脏呈暗红色,表面光滑,边缘锐利,体积较小。模型组大鼠肝脏颜色明显偏黄,表面有脂肪粒凸起,有油腻感,体积较大。如图1。
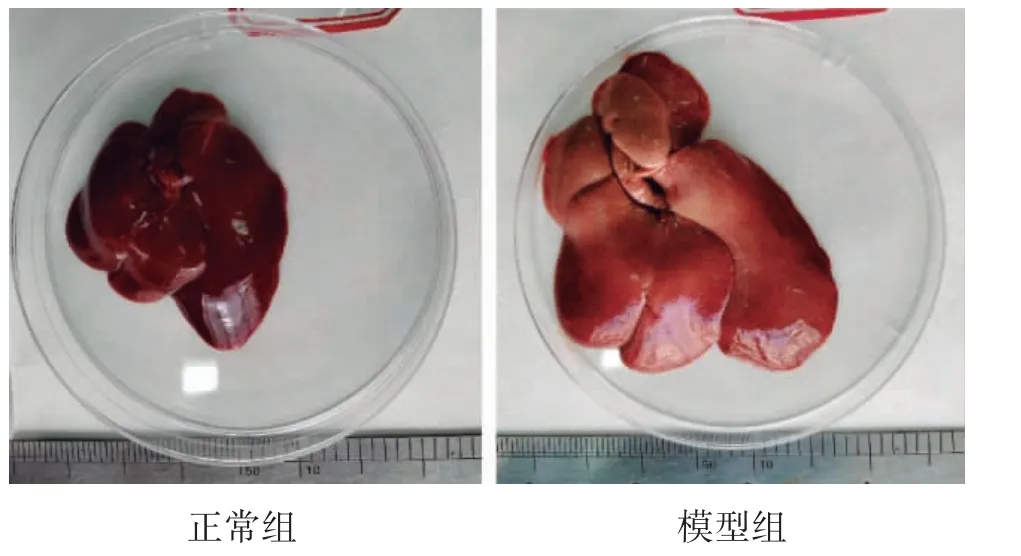
图1 肝脏形态
3.1.2 HE 染色 正常组大鼠肝组织肝索清晰,肝细胞形态规则,沿肝索有序排列,细胞核边缘清晰,胞质未见明显脂肪空泡及炎性病变。高脂饮食组大鼠肝细胞排列紊乱,可见明显的肝细胞气球样变,细胞大小不一,出现大量脂肪空泡,部分细胞核边缘模糊或不可见。如图2。
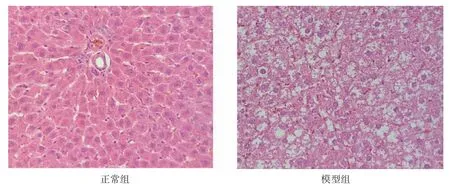
图2 肝组织病理切片(HE 染色病理切片,×400)
3.1.3 油红O 染色 正常组肝组织基本无橘红色脂滴,细胞核清晰。模型组大鼠可见大量圆形脂肪空泡,以及大面积橘红色脂滴,细胞核边缘多不清晰,细胞形态不规则,与正常组相比,出现明显的脂肪变性。如图3。
3.2 生化指标 检测结果显示,模型组大鼠血清肝功能指标ALT、AST 显著高于正常组(P<0.05),提示模型组大鼠存在肝脏细胞受损情况。此外,模型组大鼠肝脏中TC、TG 显著高于正常组(P<0.05),血清中TG 显著升高(P<0.05),TC 有上升趋势,但与正常组无显著差异(P>0.05)。如表1。
表1 大鼠生化指标比较(±s)
注:与正常组相比,▲P<0.05。
ALT AST TC TG组别 n 血清/(mmol·L-1)正常组 8 15.78±1.93 15.72±1.32 47.08±4.32 47.29±2.6 0.58±0.20 0.67±0.18 7.82±2.49 1.11±0.26模型组 8 21.55±2.02▲ 21.99±1.09▲ 67.1±5.37▲ 69.8±4.27▲ 0.94±0.20▲ 0.91±0.13 10.35±1.93▲ 1.33±0.46▲F 值 0.19 0.25 0.67 1.21 0.80 0.51 0.24 1.24肝脏/(ng·L-1)血清/(ng·L-1)肝脏/(ng·L-1)血清/(ng·L-1)肝脏/(mmol·gprot-1)血清/(mmol·L-1)肝脏/(mmol·gprot-1)P 值 <0.05 <0.05 <0.05 <0.05 <0.05 >0.05 <0.05 <0.05
3.2.1 肝脏、血液中炎症因子 ELISA 试剂盒检测结果显示,与正常组相比,模型组肝脏中IL-1β、IL-18显著升高(P<0.05),血清中IL-1β 显著升高(P<0.05)。如表2。
表2 大鼠炎症因子表达量比较(±s,ng·L-1)
注:与正常组相比,▲P<0.05。
组别 n IL-1β IL-18肝脏 血清 肝脏 血清正常组 8 37.77±1.82 45.28±9.65 164.23±35.55 106.72±16.64模型组 8 43.31±1.71▲ 65.2±17.19▲ 196.13±35.63 139.76±11.07▲F 值 0.116 1.556 0.218 1.437 P 值 <0.05 <0.05 >0.05 <0.05
3.2.2 RT-PCR 检测肝脏、小肠中NLRP3mRNA 表达量 RT-PCR 结果表明,模型组大鼠肝脏、小肠NLRP3mRNA 表达量显著升高(P<0.05)。如表3。
表3 大鼠NLRP3mRNA 表达量(±s)
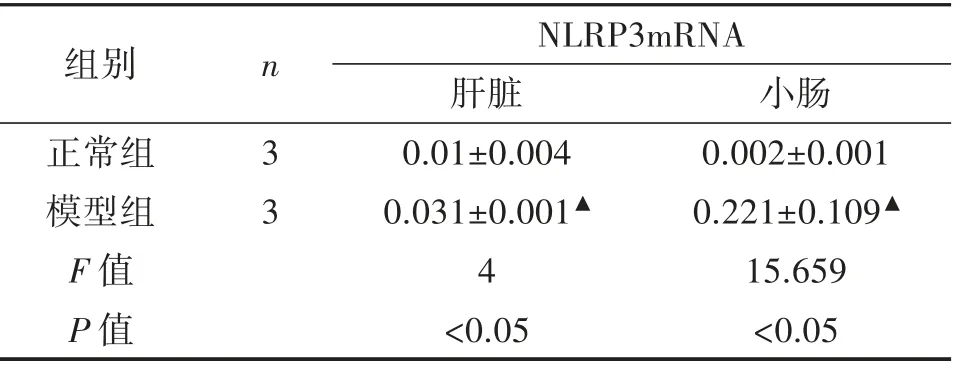
表3 大鼠NLRP3mRNA 表达量(±s)
注:与正常组相比,▲P<0.05。
组别 n NLRP3mRNA肝脏 小肠正常组 3 0.01±0.004 0.002±0.001模型组 3 0.031±0.001▲ 0.221±0.109▲F 值 4 15.659 P 值 <0.05 <0.05
3.2.3 免疫组化法检测肝脏、小肠中NLRP3 表达量与正常组相比,模型组大鼠肝脏、小肠NLRP3 表达量显著升高,且P<0.05,如表4。从免疫组化图片中可以看出,模型组大鼠较正常组大鼠的棕色区域更多,即NLRP3 阳性表达更高,如图4。
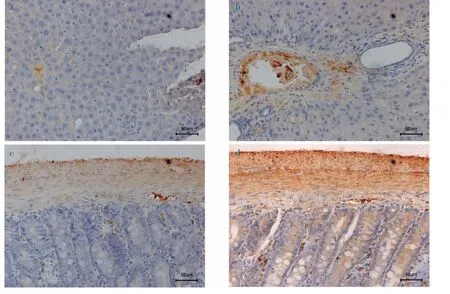
图4 NLRP3 表达量(免疫组化染色,×400)
表4 大鼠NLRP3 阳性率(±s)
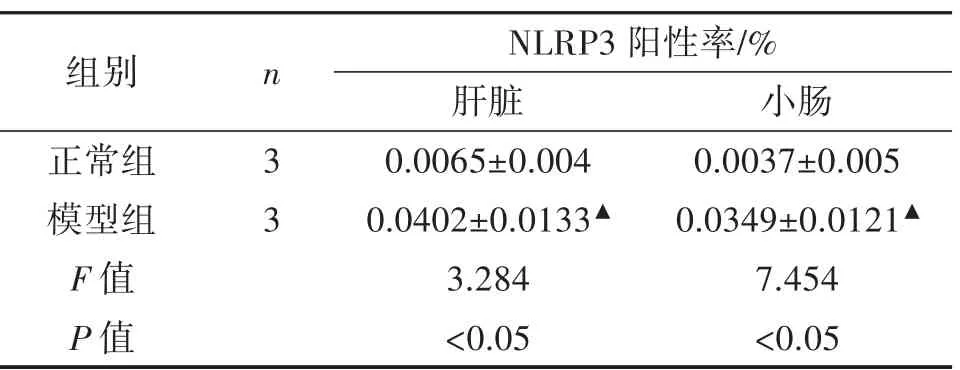
表4 大鼠NLRP3 阳性率(±s)
注:与正常组相比,▲P<0.05。
组别 n NLRP3 阳性率/%肝脏 小肠正常组 3 0.0065±0.004 0.0037±0.005模型组 3 0.0402±0.0133▲ 0.0349±0.0121▲F 值 3.284 7.454 P 值 <0.05 <0.05
4 讨论
孙林林等[8]对高脂模型进行改良,添加胆酸钠及蛋黄粉增加肝脏对胆固醇的吸收,加快了成模速度,该改良模型8 周出现炎性反应,12 周则形成明显的肝脏纤维化。本实验证实该模型成模较快,比普通高脂模型有更好的炎性反应。
“肠-肝轴”在1988 年由Marshall 提出[9],其认为肠道与肝脏由于门静脉的连接和相同的胚胎起源,二者在生理病理方面相互影响[10]。肝肠之间可通过门静脉进行物质交换,而肠道菌群及其它物理化学因素的改变,可能造成肠道屏障损伤,肠内有害物质(如LPS)进入门静脉,激活小肠和肝脏固有免疫,上调炎症因子,进一步加重了肝内炎症和代谢紊乱[11]。课题组对NAFLD 肝、肠NLRP3 和相关炎症因子变化进行探讨,发现NAFLD 大鼠中小肠、肝脏中NLRP3 表达显著升高,肝脏、血清中炎症因子IL-1β、IL-18 显著上升。NAFLD 不仅能够激活肠道的固有免疫,且能通过门静脉引起肝脏免疫反应的激活,并进一步增加炎症因子的释放。
有研究认为高脂饮食改变肠道菌群,诱发肠道炎症,肠道屏障功能减弱后,LPS 可从肠道入血,并经门静脉进入肝脏,激活Toll 样受体4(TLR4),使肝NLRP3 炎症小体活化,随后IL-18、IL-1β 释放增加,肝脏炎症反应加剧[12-14]。
NLRP3 炎症小体的激活途径多样,微生物、胆汁酸等其它因素是否参与NAFLD 模型大鼠小肠、肝脏内NLRP3 的调节尚待进一步研究。

