低能重离子注入食用菌的剂量效应关系
齐君蔚 陈艳华 陈恒雷
(新疆大学物理科学与技术学院放射生态与离子束生物技术研究中心 乌鲁木齐830046)
食用菌是可供人类食用的大型真菌,在全世界范围内,中国是最早认识食用菌且对其进行有效利用的国家[1]。食用菌是21 世纪人类食物中不可多得的绿色食品,具有高蛋白、低脂肪、低热量、老少皆宜的特点,被誉为“素中之荤”、“上帝食品”、“健康食品”,其原因在于食用菌子实体和菌丝体所含有的真菌多糖、多肽类以及其它极为丰富的活性成分,具有抗肿瘤、降血脂、调节机体免疫力、保护心脑血管等多种药用价值[2-5]。食用菌的生产可分为固体栽培和液体发酵两种,固体栽培主要是为了获得食用菌子实体,液体发酵主要是为了获得食用菌菌丝体[6],而制约食用菌生产效率的因素除了栽培技术和发酵水平外更关键的是菌种品质,优良菌株的选育是食用菌产业永续发展的根本保证。
离子束生物技术是20世纪80年代中期由中国科学家开创的一种具有自主知识产权的生物育种新技术,该技术已成功应用于小麦、水稻、玉米、大豆等大宗粮食作物的品种改良和抗生素、酶制剂、氨基酸产生菌等工业微生物及石油降解微生物的诱变育种[7-9]。由于重离子注入具有能量沉积、动量传递、质量沉积、电荷中和与交换等联合作用,其生物学效应更加显著[10-12]。本研究基于低能重离子业已明确的诱变功效,利用低能氮离子注入3 种食用菌分生孢子,通过洗脱镜检、平板培养、液体发酵,揭示低能重离子注入食用菌的剂量效应关系,可为食用菌的低能重离子诱变育种提供一定的实验依据和方法学参考。
1 材料与方法
1.1 材料
1.1.1 菌种
阿魏菇(Pleurotus ferulae)、香菇(Lentinula edodes)、猴头菇(Hericium erinaceus)子实体,均由乌鲁木齐市新北园春蔬菜批发市场采购,分生孢子由本实验室孢子分离所得。
1.1.2 仪器
LCD-1000 型多功能离子注入机,西南核物理研究所;LRH-150B生化培养箱,广东省医疗器械厂;ZHWY-2102 新型恒温震荡器,乌鲁木齐祥生仪器有限公司;522分光光度计,北京普源精电科技有限公司;METTLER-TOLEDO 精密分析天平(万分之一),METTLER TOLEDO公司。
1.1.3 培养基
固体培养基的成分为(w/v):马铃薯20%(煮汁过滤)、葡萄糖2.0%、蛋白胨0.5%、磷酸二氢钾0.20%、硫酸镁0.15%、琼脂粉2.0%,自来水定容,pH值自然。
液体培养基的成分为(w/v):马铃薯20%(煮汁过滤)、小麦粉2.0%、酵母膏0.5%、磷酸二氢钾0.20%、硫酸镁0.15%、自来水定容,pH值自然。
1.2 方法
1.2.1 分生孢子悬液的制备及计数
取一朵新鲜的食用菌子实体去柄后置于无菌三角支架上,支架下放一无菌空白培养皿,一起置于干燥器中自然喷发,用无菌接种环辅助10 mL无菌水洗脱乳白色分生孢子,梯度稀释后用移液枪吸取0.2 mL 分生孢子悬液涂布于无菌空白培养皿,置于超净工作台,风干制备菌膜。同时,取0.2 mL分生孢子悬液用血细胞计数板进行计数。
1.2.2 低能氮离子注入诱变
将风干制备的3 种食用菌分生孢子菌膜置于LCD-1000 型多功能离子注入机的小靶室(见图1),分别采用能量15 keV、注量(0、2、4、6、8、10、12、14)×1015cm-2的N+束,在压强为2.5×10-3Pa的真空状态下,以5 s/次、间隔5 s的脉冲方式注入。
1.2.3 培养方法
平板培养。分别用2 mL 无菌水将小靶室中经不同剂量离子束注入后的3种食用菌分生孢子洗脱转接到5 皿平板固体培养基上,26 ℃恒温培养,动态观察3种食用菌新生菌落菌丝体在平板培养基上的长势,将菌丝体长势与对照菌株差异显著的菌株分别转接到斜面和平板固体培养基上26 ℃恒温培养7 d,动态观察和检测平板培养菌丝体长势,每组实验设3 次重复,斜面培养菌丝体用于摇瓶发酵。
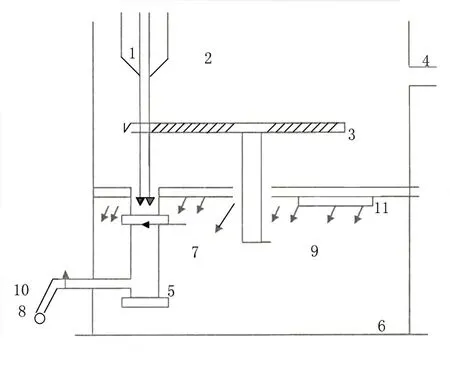
图1 LCD-1000多功能离子注入机靶室示意图1.离子束;2.大靶室;3.转盘;4.抽气系统;5.小靶室;6.无菌室;7.手动闸门;8.小机械泵;9.送无菌风;10.电磁闸门;11.紫外线灯管Fig.1 Diagram of target chamber for LCD-1000 multi-functional Ion implanter1.ion beam;2.large target chamber;3.turntable;4.air extraction system;5.small target chamber;6.sterile room;7.manual gate;8.small mechanical pump;9.sterile air supply;10.electromagnetic gate;11.ultraviolet lamp
摇瓶发酵。用无菌接种钩刮取固体斜面菌丝体,按每个斜面菌种转接3 瓶的接种量接种于装有150 mL 液体培养基的500 mL 摇瓶中,转速160 r/min、26 ℃恒温培养10 d。发酵结束后经过滤收集菌丝体并测定其生物量和多糖含量,每组实验设3次重复。
1.2.4 测定方法
菌丝体生物量测定。将发酵液倒入漏斗垫有8层纱布的抽滤瓶中,用纯净水洗脱过滤后收集菌丝体,所得菌丝体置于空白培养皿中放入100 ℃干燥箱干燥至恒重后,用分析天平称其质量。
菌丝体多糖含量测定。将称重后的菌丝体研磨至粉,取10 g溶解于100 mL纯净水中,95 ℃热水浸提3 次,每次30 min,合并浸提液后用苯酚-浓硫酸法测定菌丝体多糖含量[13]。
2 结果与分析
2.1 低能氮离子注入对三种食用菌分生孢子的刻蚀作用
通过低能氮离子注入对3种食用菌分生孢子刻蚀作用试验结果(见图2)不难看出,未经低能氮离子注入的3种食用菌分生孢子细胞完整,呈现为椭圆形或圆形,而经过能量15 keV、注量12×1015cm−2低能氮离子注入的3种食用菌分生孢子刻蚀作用明显,低能氮离子不同程度破坏了细胞的完整结构,有些细胞被打碎,有些细胞变形,有些细胞只剩下了孢子壳,内容物全部被低能氮离子轰击出来。出现这种生物学效应的原因,从原子分子尺度来讲,主要是由于低能重离子注入具有能量转换、动量传递、质量沉积三重作用,当入射重离子的速度不是很高时,速度越慢的重离子掠过电子的时间越长,电子获得的动量越大,重离子的电离损失率也就越大;从细胞尺度来看,主要是因为采用脉冲方式不断对食用菌分生孢子细胞进行注入,产生机械损伤和热胀效应,当作用到某个分生孢子的注入剂量达到某个值时,细胞膜破裂、内容物溢出。
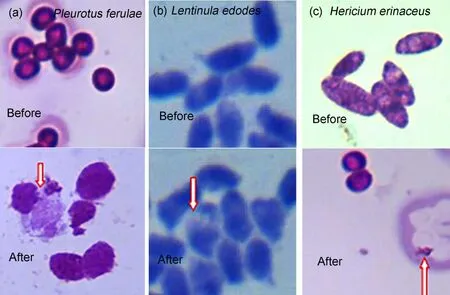
图2 低能氮离子注入对3种食用菌分生孢子的刻蚀作用(400×)Fig.2 Etching for conidium of three edible fungi by low-energy nitrogen ion implantation(400×)
通过低能氮离子注入对3种食用菌分生孢子刻蚀作用试验结果(图2)不难看出,未经低能氮离子注入的3种食用菌分生孢子细胞完整,呈现为椭圆形或圆形,而经过能量15 keV、注量12×1015cm−2低能氮离子注入的3种食用菌分生孢子刻蚀作用明显,低能氮离子不同程度破坏了细胞的完整结构,有些细胞被打碎,有些细胞变形,有些细胞只剩下了孢子壳,内容物全部被低能氮离子轰击出来。出现这种生物学效应的原因,从原子分子尺度来讲,主要是由于低能重离子注入具有能量转换、动量传递、质量沉积三重作用,当入射重离子的速度不是很高时,速度越慢的重离子掠过电子的时间越长,电子获得的动量越大,重离子的电离损失率也就越大;从细胞尺度来看,主要是因为采用脉冲方式不断对食用菌分生孢子细胞进行注入,产生机械损伤和热胀效应,当作用到某个分生孢子的注入剂量达到某个值时,细胞膜破裂、内容物溢出。
2.2 不同剂量低能氮离子注入对3种食用菌存活率的影响
通过不同剂量低能氮离子注入对3种食用菌存活率的影响试验曲线(图3)可以看出,随着低能氮离子注入剂量的增加,3种食用菌的存活率均呈现先骤减后缓慢增大再陡降的“马鞍型”剂量-效应曲线。出现这种现象的原因主要是因为低剂量的N+束射程较短只对分生孢子细胞表面产生刻蚀作用,未对细胞结构产生损伤,因而细胞存活率较高;随着注入剂量的增加,低能氮离子对分生孢子细胞的刻蚀作用越来越严重,同时,N+束与细胞作用产生大量次生粒子和自由基损及细胞内部活性物质,从而使细胞存活率急剧下降,但下降到一定值后,细胞内外达到某种动态平衡,细胞中的自我修复机制被激活,使得存活率略有回升;当注入剂量再增大时,细胞结构遭到严重破坏,存活率骤然下降。
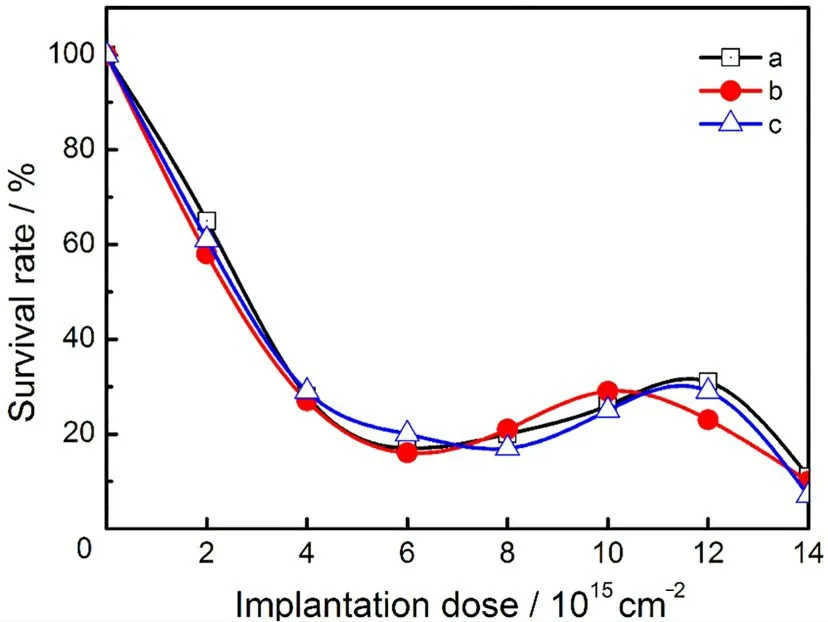
图3 不同剂量低能氮离子注入对3种食用菌存活率的影响:(a)阿魏菇;(b)香菇;(c)猴头菇Fig.3 The effect of different doses of low-energy nitrogen ion implantation on the survival rate of three edible fungi:(a)Pleurotus ferulae;(b)Lentinus edodes;(c)Hericium erinaceus
2.3 不同剂量低能氮离子注入对3种食用菌平板培养菌丝体长势的影响
通过不同剂量低能氮离子注入对3种食用菌平板培养菌丝体长势影响的试验结果(见表1)发现,与未经离子束注入平板培养菌丝体长势相比,所有剂量下菌丝体密度均有所增大,菌落直径差异显著,尤以存活率曲线峰值剂量时菌丝体密度和菌落直径最大;相较于出发菌株,各剂量下菌丝体颜色略显不同,气生菌丝老化现象均不明显,特别是存活率曲线峰值剂量下平板培养第7天的菌丝体基本都未出现结皮。出现这一现象的原因可能是因为当注入剂量介于某个剂量区间时,低能N+束与分生孢子细胞作用产生的大量次级粒子的电离作用有可能引起细胞内遗传物质DNA 双链断裂,细胞很难自我修复进而发生遗传变异,出现老化延迟生物学效应。
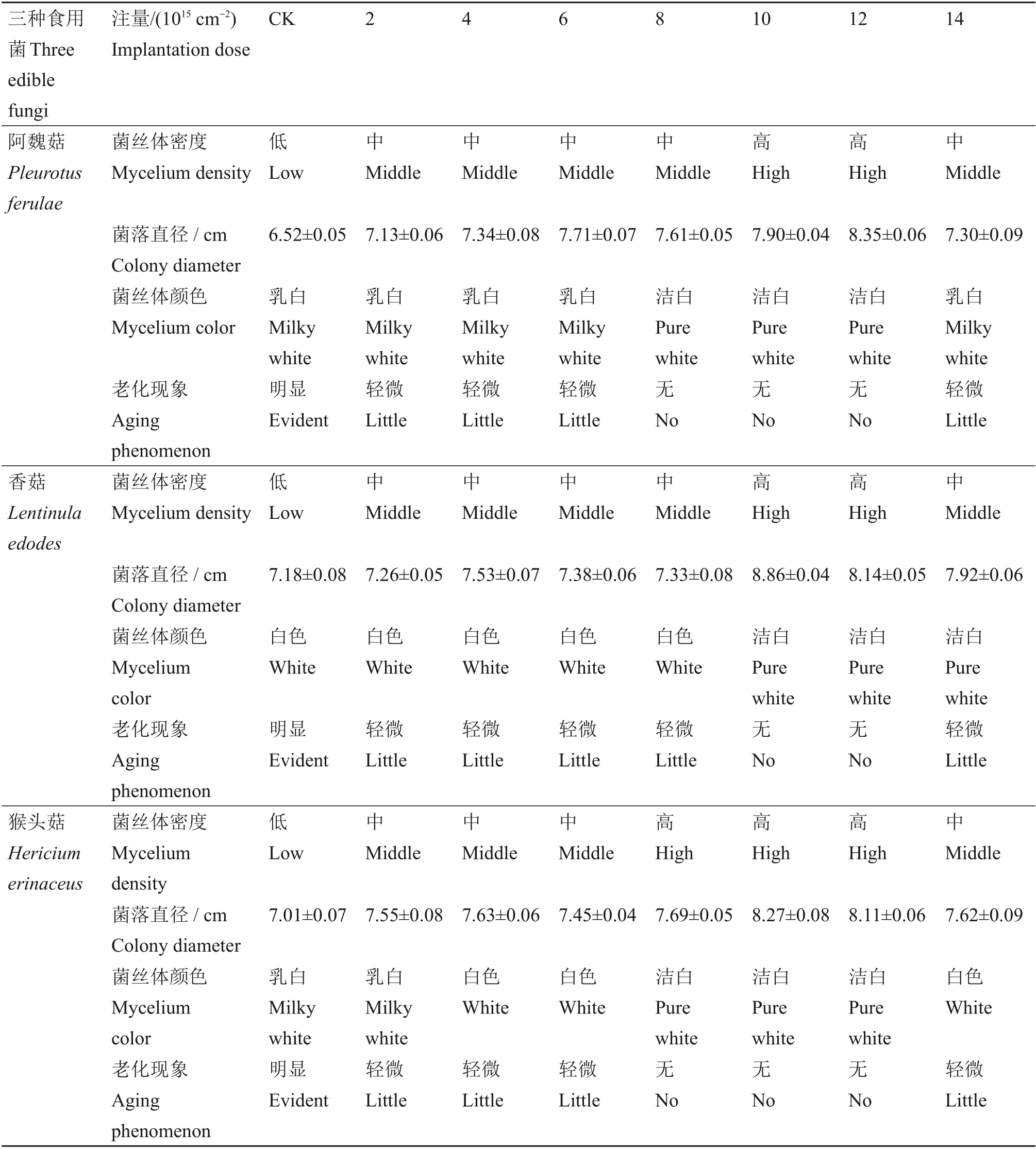
表1 不同剂量低能氮离子注入对3种食用菌平板培养菌丝体长势的影响(第7天)Table 1 Effects of different doses of low-energy nitrogen ion implantation on mycelium growth of three edible fungi in plate culture(No.7 day)(xˉ±s,n=3)
2.4 不同剂量低能氮离子注入对3种食用菌摇瓶发酵菌丝体生物量及多糖含量的影响
通过不同剂量低能氮离子注入对3种食用菌摇瓶发酵菌丝体生物量及多糖含量影响的试验结果(表2)发现,与未经离子束注入摇瓶发酵菌丝体生物量相比,所有剂量下菌丝体生物量均有所增大,尤以存活率曲线峰值剂量区间内的菌丝体生物量最大;相较于出发菌株,各剂量下3种食用菌菌丝体多糖含量各不相同,特别是存活率曲线峰值剂量下菌丝体多糖含量普遍较高。出现这一现象的原因可能是因为当注入剂量介于某个剂量区间时,低能N+束与分生孢子细胞作用产生的大量次级粒子的电离作用有可能引起细胞内遗传物质DNA 双链断裂,细胞很难自我修复进而有部分菌株发生了多糖高产性状的遗传变异。

表2 不同剂量低能氮离子注入对3种食用菌摇瓶发酵菌丝体生物量及多糖含量的影响(第10天)Table 2 Effects of different doses of low-energy nitrogen ion implantation on mycelium biomass and polysaccharide content of three edible fungi in flask fermentation(No.10 day)(xˉ±s,n=3)
3 结论
(1)低能氮离子注入对3种食用菌分生孢子的刻蚀作用显著。未经离子注入的3种食用菌分生孢子细胞完整,呈现为椭圆形或圆形,而经过能量15 keV、注量12×1015cm−2低能氮离子注入的3种食用菌分生孢子刻蚀作用明显。低能氮离子不同程度破坏了细胞的完整结构,有些细胞被打碎,有些细胞变形,有些细胞只剩下了孢子壳,内容物全部被低能氮离子轰击出来。
(2)采用15 keV 不同注量(0、2、4、6、8、10、12、14)×1015cm−2的低能氮离子注入诱变,3种食用菌的存活率均呈现先骤减后缓慢增大再陡降的“马鞍型”剂量-效应曲线,这与王连峰等[14]开展的阿魏菇多糖高产菌株筛选的离子束诱变和复合诱变对比研究试验结果基本一致。
(3)与未经离子束注入平板培养菌丝体长势相比,所有剂量下3种食用菌菌丝体密度均有所增大,菌落直径差异显著,尤以存活率曲线峰值剂量时菌丝体密度和菌落直径最大,菌落直径均超过8.20 cm;相较于出发菌株,各剂量下菌丝体颜色略显不同,气生菌丝老化现象均不明显,特别是存活率曲线峰值剂量下平板培养第7天的菌丝体基本都未出现结皮。
(4)与未经离子束注入摇瓶发酵菌丝体生物量相比,所有剂量下3种食用菌菌丝体生物量均有所增大,尤以存活率曲线峰值剂量区间内的菌丝体生物量最大,均超过15.30 g∙L−1;相较于出发菌株,各剂量下3 种食用菌菌丝体多糖含量各不相同,但在存活率曲线峰值剂量下3种食用菌菌丝体多糖含量普遍较高。
(5)综合低能氮离子注入对3种食用菌的刻蚀作用、存活率、平板培养菌丝体长势、摇瓶发酵菌丝体生物量及多糖含量影响的试验结果发现,随着注入剂量的增加,低能重离子对食用菌分生孢子细胞的刻蚀作用加之产生的次级粒子特别是X射线能够穿透到很深的地方[15],有可能引起细胞内遗传物质DNA 单链或双链的断裂,根据辐射引起双重作用理论[16],DNA双链断裂时修复变得很困难,进而会发生各种遗传性状的基因突变,低能重离子注入对生物细胞及其DNA 损伤、修复的影响仍需更深入的研究[17]。

