固相萃取-原子荧光光谱法测定大米中无机硒的含量
张 颖,黄文耀,唐 琳,孔 芳,华俊辉
(湖北省疾病预防控制中心,应用毒理湖北省重点实验室,武汉 430079)
硒是机体必需的微量元素,但适宜剂量范围很窄,其生物效应和毒性与硒的形态密切相关[1-4]。在硒的各种形态中,无机硒的毒性较大,吸收和利用不理想,过量会对人体造成伤害[5-7]。无机硒的存在形态主要为可溶于水的硒酸根和亚硒酸根,有机硒的存在形态主要为硒蛋白和硒代氨基酸,普遍认为,谷物中硒主要以硒代蛋氨酸形式(包括游离的和结合蛋白的)存在[8-10],其中部分小分子硒代氨基酸也溶于水,因此测定无机硒的含量时需要排除水溶性有机硒的干扰。
目前硒形态的测定方法主要为原子荧光光谱法和仪器联用法(包括高效液相色谱-原子荧光联用法[11-12]和高效液相色谱-电感耦合等离子体联用法[13-16])。仪器联用法可测得硒的各种形态的含量,但仪器价格昂贵,对操作技术要求较高,不适宜普遍推广应用。原子荧光光谱法具有灵敏度高、选择性强、稳定性好、成本低廉、通用性强等优点,但需要一种有效的无机硒的提取分离方式。现有的文献报道中,多采用较高浓度的盐酸溶液直接提取无机硒[17-20]或水溶液提取后用有机溶剂萃取有机硒而得到无机硒的提取方式[21-23],上述方式均可能造成有机硒的转化或不能完全分离有机硒,使无机硒的测定结果偏高。本工作采用固相萃取的前处理方式,特异性吸附硒酸根和亚硒酸根,去除大米中有机硒和样品基底的干扰,以达到分离富集无机硒的目的,再采用原子荧光光谱法测定无机硒的含量。
1 试验部分
1.1 仪器与试剂
AFS-9700型双道原子荧光光度计;DB-2EFS型智能石墨电热板;DTC-33 型超声波清洗器;Z383K 型低温高速离心机;THZ-82型恒温振荡器;Milli-Q Advantage A10 型超纯水仪;SAX 强阴离子交换柱(1 000 mg/6 mL)。
硒标准储备溶液:1 000 mg·L-1。
硒标准溶液:1 mg·L-1,移取适量硒标准储备溶液,用5%(体积分数,下同)盐酸溶液稀释。
硒标准溶液系列:分别移取1 mg·L-1的硒标准溶液0,0.2,0.4,0.6,0.8,1.0 mL,加入100 g·L-1铁氰化钾溶液10 mL,用5%盐酸溶液定容至100 mL,配制成0,2.00,4.00,6.00,8.00,10.0μg·L-1的硒标准溶液系列。
富硒大米样品购自湖北省恩施地区,标注有“富硒”字样;普通大米样品购自武汉某超市。
硒代胱氨酸、硒代蛋氨酸的纯度均为98%;硝酸、盐酸、高氯酸、氢氧化钠、硼氢化钾均为优级纯;铁氰化钾为分析纯;试验用水由Milli-Q Advantage A10型超纯水仪制得(电阻率大于18.2 MΩ·cm)。
1.2 仪器工作条件
光电倍增管负高压300 V;硒空心阴极灯,灯电流80 m A;炉高8 mm;载气为氩气,流量400 mL·min-1;屏蔽气为氩气,流量1 000 mL·min-1;延迟时间1 s;读数方式峰面积,读数时间15 s;进样体积2 mL。
1.3 试验方法
称取经烘干粉粹过筛的大米粉0.5 g,置于50 mL塑料离心管中,加入20 mL 水,超声10 min后,于90 ℃水浴振荡提取60 min,其间每隔10 min取出,上下颠倒,使样品充分混匀,水浴结束后,再超声提取20 min[10,19]。冷却,以转速8 000 r·min-1离心15 min,取上层清液,用5 g·L-1氢氧化钠溶液调至pH 4~7,过滤,移取滤液10 mL 作为提取液。SAX 强阴离子交换柱经3 mol·L-1盐酸溶液10 mL 活化、水20 mL 平衡。将提取液移入交换柱,流出速率小于3 mL·min-1,再用3 mol·L-1盐酸溶液10 mL洗脱吸附在柱上的无机硒(洗脱速率1 mL·min-1),收集洗脱液。将洗脱液转移至锥形瓶,按GB 5009.93-2017《食品安全国家标准食品中硒的测定》[24]第一法中前处理方法进行湿法消解,再采用第一法氢化物原子荧光光谱法测定样品中总硒含量,按1.2节仪器工作条件测定样品中无机硒的含量。
2 结果与讨论
2.1 提取剂的选择
硒形态的提取方式通常有水提取法、酸提取法、碱提取法和酶提取法[10-11],酶提取法将硒蛋白酶解为硒代氨基酸[25],主要目标化合物为硒蛋白。无机硒的提取剂通常为水、酸或碱试剂,本试验在前期研究工作的基础上[10,25],采用水提取大米中的无机硒。
2.2 提取液酸度的选择
固相萃取柱选用SAX 强阴离子交换柱,需经3 mol·L-1盐酸溶液10 mL 活化、水20 mL 平衡。试验考察了提取液的不同酸度(pH 3~10)对无机硒(硒酸根和亚硒酸根)加标水溶液和有机硒(小分子硒代氨基酸,包括硒代胱氨酸和硒代蛋氨酸)在SAX强阴离子交换柱上的保留情况,按试验方法测定相应的洗脱液中硒含量并计算回收率,结果见图1。
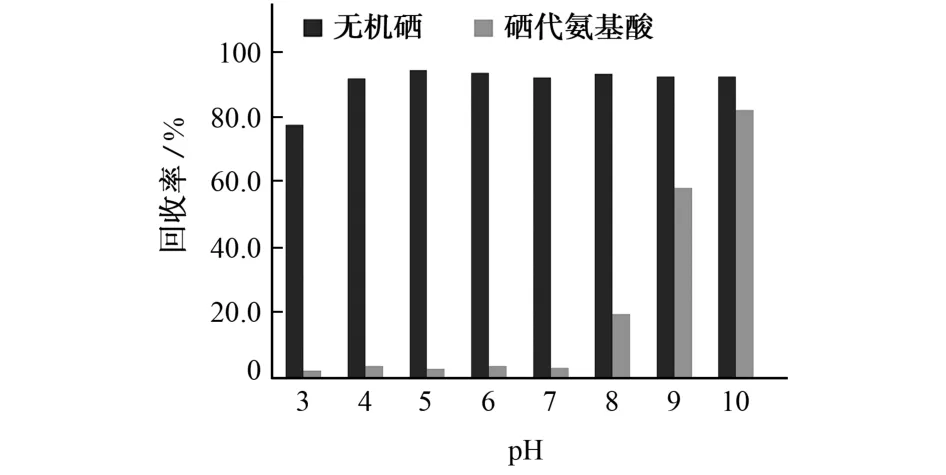
图1 提取液的不同酸度对固相萃取柱吸附无机硒和硒代氨基酸的影响Fig.1 Effect of different acidity of extract solution on adsorption of inorganic selenium and selenium amino acids by solid phase extraction column
由图1可知:当提取液的pH 为4~10时,无机硒的回收率基本保持不变;当pH 大于7时,硒代氨基酸的回收率逐渐增大。表明pH 为4~7时,无机硒的分离效果较好。为排除硒代氨基酸的影响,试验选择提取液的pH 为4~7。
2.3 洗脱液体积的选择
试验分别收集10,20,30,40,50 mL 的洗脱液,按试验方法测定硒含量并计算回收率。结果表明:不同体积洗脱液的回收率分别为93.7%,94.1%,94.1%,94.0%,93.9%,说明洗脱液体 积 为10 mL时即可获得良好的回收率,无需进一步增大洗脱液体积。
2.4 标准曲线与检出限
按仪器工作条件对0,2.00,4.00,6.00,8.00,10.0μg·L-1的硒标准溶液系列进行测定,以硒的质量浓度为横坐标,其对应的荧光强度为纵坐标绘制标准曲线。结果显示:标准曲线在10.0μg·L-1以内呈线性关系,线性回归方程为y=138.9x+90.07,相关系数为0.999 9。
按试验方法连续测定空白样品11次,测定结果的标准偏差(s)为0.021μg·L-1,以样品称样量为0.5 g,定容体积为10 mL 计,换算为0.84μg·kg-1。以3倍标准偏差计算方法的检出限(3s),所得结果为2.52μg·kg-1,以10倍标准偏差计算方法的测定下限(10s),所得结果为8.40μg·kg-1。
2.5 精密度和回收试验
取普通大米(无机硒含量较低)样品,按1.3节试验方法测定其总硒和无机硒的含量。然后根据国家标准GB/T 27404-2008《实验室质量控制规范食品理化检测》附录F[26]的规定,在上述样品中加入3个浓度水平的硒标准溶液,将大米粉充分振荡混匀,放置24 h后,按试验方法测定,每个样品平行测定6次,计算回收率和测定值的相对标准偏差(RSD),结果见表1。
由表1 可知:无机硒的回收率为90.3%~98.2%,测定值的RSD 为9.9%~19%,符合国家标准GB/T 27404-2008[26]规定的不同水平的实验室精密度要求。

表1 精密度和回收试验结果(n=6)Tab.1 Results of tests for precision and recovery(n=6)
2.6 样品分析
按照1.3节试验方法测定富硒大米和普通大米样品中的总硒和无机硒含量,有机硒含量采用总硒含量与无机硒含量的差值计算可得,并计算无机硒和有机硒分别在总硒中的占比,结果见表2。
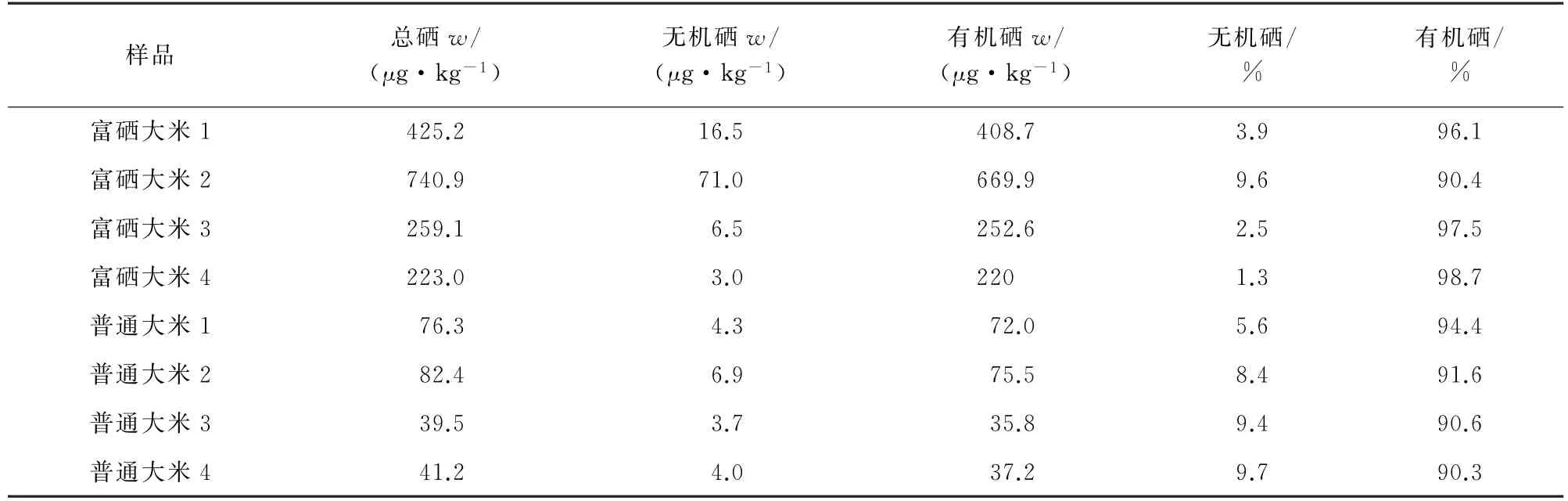
表2 样品分析结果Tab.2 Analytical results of samples
由表2可知:大米样品中无机硒占比为1.3%~9.7%,说明在没有人工非法添加无机硒的情况下,天然大米中无机硒的含量较低,主要存在形式为有机硒。
本工作采用固相萃取的前处理方式,在弱酸性范围内,采用SAX 强阴离子交换柱吸附硒酸根和亚硒酸根,去除有机硒小分子和样品基体的干扰,避免前处理过程中因有机硒小分子转化而造成的无机硒测定结果偏高。为防止固相萃取柱的过载,建议选用容量较大的固相萃取柱。该方法的检出限为2.52μg·kg-1,与GB 5009.93-2017 第一法氢化物原子荧光光谱法测定食品中的总硒的方法检出限(2μg·kg-1)相当[24],灵敏度高,不仅可以测定富硒大米中的无机硒,对普通大米中无机硒的测定同样适用,方法的适用范围广。

