淡豆豉炮制过程中拮抗菌对黄曲霉毒素B1的拮抗能力考察
李春玲,贺 婧,王立元,赵绵江,李翠英,翁美芝,周立分*,周 鸿,谢小梅*
1.江西中医药大学,江西 南昌 330004
2.南昌大学转化医学研究院,江西 南昌 330031
3.江西省疾病预防控制中心,江西 南昌 330029
淡豆豉Sojae Semen Praeparatum别名香豉(《伤寒论》),为大豆Glycine max(L.)Merr.的成熟种子(黑大豆)与桑叶、青蒿经发酵加工而成。其性味苦、辛、凉,归肺、胃经,具有解表、除烦、宣发郁热之功效,用于感冒、寒热头痛、烦躁胸闷、虚烦不眠等,被历代本草和历版《中国药典》收录,列入卫生部首批药食两用名单,在心血管疾病、糖尿病、骨质疏松、乳腺癌及女性更年期综合征、抑郁症等重大疾病的预防和控制中有广阔应用前景[1-2]。
黄曲霉毒素(aflatoxin,AFT)主要由黄曲霉菌Aspergillus flavus和寄生曲霉菌A.parasiticus产生的一类化学结构类似的次级代谢产物,在中药材、豆类、花生、玉米以及奶制品、植物油等产品中广泛存在[3]。AFT 致癌、致畸和致突变性极强,是至今发现的最强致癌真菌毒素化合物。它们降低体内胰腺消化酶活性,影响免疫力,损伤动物肝脏、中枢神经功能等,引起一系列疾病,如贫血、肠胃疾病、生长性能障碍、生殖障碍等[4-7]。其中黄曲霉毒素B1(aflatoxin B1,AFB1)毒性最强,已被国际癌症机构定义为I类致癌物[8-9]。食入被AFT(尤其是AFB1)污染的中药材,不仅达不到防病治病的效果,反而会使AFT 在人体内积累中毒,危及健康甚至生命,给中药的临床应用带来严重安全隐患。
淡豆豉在炮制过程中受原料、加工器具、温度、湿度等外界环境的影响,极易污染AFT,然而迄今关于淡豆豉炮制中AFT 的研究极少。本实验室前期已发现淡豆豉炮制过程中存在黄曲霉、溜曲霉等可能产AFT 的产毒菌[10],同时也分离到如枯草芽孢杆菌、乳酸菌、黑曲霉菌等已报道能抑制AFT 产生的有益菌(简称拮抗菌)[11-13],并发现淡豆豉炮制过程中不同时间点样本的AFT 含量、产毒菌的数量和产毒能力存在动态变化。
基于此,本实验应用LC-MS 技术检测AFB1,研究从淡豆豉炮制过程中分离的枯草芽孢杆菌、鲑色锁掷酵母菌、黑曲霉菌、屎肠球菌、鸟肠球菌及其代谢产物对产毒黄曲霉菌生长的影响,以及它们对AFB1的降解能力,为探讨淡豆豉炮制过程中AFT 消长机制奠定基础,并将筛选到的AFB1拮抗菌应用于淡豆豉炮制中,对降低淡豆豉成品的AFB1污染有重要意义。
1 材料与仪器
1.1 材料
1.1.1 实验菌株 产毒黄曲霉菌(CGMCC3.4408)购于中国普通微生物菌种保藏中心。鲑色锁掷酵母菌Saccharomyces salmonicolor(EJ1)、屎肠球菌Enterococcus faecium(BR5)、鸟肠球菌Enterococcus avium(9R2)、黑曲霉Aspergillus niger(JC2)和枯草芽孢杆菌Bacillus subtilis(JX2)均为本实验室从淡豆豉炮制过程中筛选鉴定并保存,由江西中医药大学谢小梅教授和王立元副教授鉴定。
1.1.2 培养基 PDA 培养基、曲霉素琼脂培养基、脑心浸液肉汤培养基,批号20191113、20191026、20201017,青岛高科技海博生物技术有限公司。
细菌种子培养基:葡萄糖50 g,蛋白胨5 g,酵母膏1 g,KH2PO41 g,Fe2SO4·7H2O 0.01 g,MgSO4·7H2O 0.5 g,蒸馏水1000 mL,pH 6.0。
细菌发酵培养基:葡萄糖23.5 g,蛋白胨10 g,乙酸铵8.5 g,KH2PO44.1 g,MgSO4·7H2O 0.5 g,加水1000 mL,pH 6.0。
真菌发酵培养基:葡萄糖30 g,NaNO33 g,酵母提取物1 g,K2HPO41 g,MgSO4·7H2O 0.5 g,KCl 0.5 g,FeSO4·7H2O 0.01 g,L-谷氨酸钠10 g,蒸馏水1000 mL,pH 6.0。以上培养基均在121 ℃下湿热灭菌20 min。
1.1.3 试剂 AFB1对照品,批号A832707-1mg,质量分数≥98%,麦克林有限公司;甲醇、乙腈,批号2003191、20022221,体积分数≥99.9%,罗恩公司;甲酸,批号C11265520,体积分数≥99.9%,阿拉丁生化科技有限公司。
1.2 仪器
MJ-150I霉菌培养箱、DHP-9082 细菌培养箱,上海一恒科技有限公司;AB Triple Quad 4500 超高效液相色谱-三重四级杆串联质谱仪,美国AB Sciex公司;Milli-Q Advantage A10 超纯水仪,美国Millipore 公司。
2 方法与结果
2.1 LC-MS 检测降解AFB1 研究
2.1.1 色谱条件 Hypersil Gold(100 mm×2.1 mm,3 μm);柱温25 ℃;流动相为0.1%甲酸水溶液-乙腈;梯度洗脱:0~1 min,35%乙腈;1~2.5 min,35%~50%乙腈;2.5~3 min,50%~80%乙腈;3~3.1 min,80%~35%乙腈;3.1~5 min,35%乙腈;体积流量0.2 mL/min;进样量2 μL。
2.1.2 质谱条件 电喷雾离子源(electrospray ionization,ESI),正离子模式;离子喷射电压(ion spray voltage,IS)4.5 kV;离子源温度(ion source temperature,TEM)500 ℃;雾化气(nebulizer gas,GS1)压力310.264 kPa(45 psi),加热气(heater gas,GS2)压力344.738 kPa(50 psi),气帘气体(curtain gas,N2),压力241.316 kPa(35 psi)。扫描方式为多重反应监测(multiple reaction monitoring,MRM)。碰撞电压150 V,去簇电压32 V,母离子m/z313.0,子离子m/z285.4、254.0;保留时间5 min。
2.1.3 对照品溶液的制备 准确称取0.1 mg AFB1对照品于50 mL 棕色量瓶中,加甲醇稀释至刻度,摇匀,过0.22 μm 滤膜,即得2 μg/mL 的AFB1对照品储备液。
2.1.4 供试品溶液的制备 将斜面保存的5 株待测菌分别接种于相应培养基上活化(细菌、真菌分别接于脑心浸液肉汤、PDA 液体培养基),挑取一环接种于25 mL 种子培养液中,细菌经37 ℃培养12 h 后,吸取1 mL 种子液接种于25 mL 细菌发酵培养液中,37 ℃培养2 d。真菌接种于25 mL 真菌发酵培养液中,28 ℃培养3 d。避光条件下,吸取980 μL 各发酵菌液加20 μL 100 μg/mL 的AFB1对照品,使各发酵菌液中AFB1终质量浓度为2 μg/mL,以只加20 μL 100 μg/mL的AFB1对照品不接种菌的发酵培养液作对照,37 ℃避光孵育72 h。
分别取上述孵育72 h 的各发酵液1 mL,用氮气吹至近干,加1 mL 甲醇复溶,11 269.44×g离心10 min,上清液经0.22 μm 滤膜滤过后用LC-MS检测。
2.1.5 线性关系考察 精确吸取0.005、0.010、0.025、0.040、0.050、0.075、0.100 mL 的AFB1对照品储存液于1 mL 量瓶中,用甲醇稀释至刻度,使之成10、20、50、80、100、150、200 ng/mL 的系列对照品溶液,混匀,上机测定。AFB1标准曲线为Y=23 904X+135 965,r2=0.999 3,质量浓度在10~200 ng/mL 呈良好线性关系。
2.1.6 精密度考察 配制AFB1质量浓度为100 ng/mL 的对照品溶液,连续重复进样6 次,按峰面积计算,RSD 为0.62%
2.1.7 稳定性考察 取无菌发酵液,精密加AFB1对照品溶液,使之最终质量浓度为100 ng/mL。按“2.1.4”项供试品溶液的制备步骤操作,分别测定0、4、8、12、16、20、24 h 时的AFB1含量,以峰面积来计算,RSD 为1.01%。
2.1.8 重复性考察 平行取无菌发酵液6 份,精密加 AFB1对照品溶液,使之终质量浓度为 100 ng/mL。按“2.1.4”项供试品溶液制备步骤操作,按“2.1.1”项色谱条件,分别进样2 μL 进行测定,以AFB1含量来计算,RSD 为1.50%。
2.1.9 加样回收率考察 平行取无菌发酵液9 份,分别精密加入低、中、高质量浓度的对照品溶液,每个浓度3 份,使发酵液中AFB1终浓度分别为50、100、200 ng/mL,按“2.1.4”项供试品溶液制备步骤操作,制备供试品溶液,进样分析,检测含量。用甲醇制备相应质量浓度的对照品溶液,进样分析,检测含量。计算加样回收率。以发酵液为基质,测得低、中、高3 个质量浓度水平时AFB1的平均回收率分别为92.40%、94.32%、97.20%,RSD 分别为2.35%、1.48%、1.85%(n=3)。
2.2 5 株待测菌对AFB1 的降解作用
具体操作方法见“2.1.4”项。结果显示,5 株菌发酵菌液均对AFB1有一定的降解作用,其中鲑色锁掷酵母菌对AFB1的降解作用最强,达43.65%,黑曲霉菌的降解作用最弱。各菌株发酵液中AFB1的液质联用色谱图如图1所示,降解率见表1。
表1 5 株菌的种子培养液和发酵上清液对黄曲霉生长的抑制效果及对AFB1 的降解作用(,n=3)Table 1 Growth inhibition of A.flavus and degradation of AFB1 by five strains(,n=3)
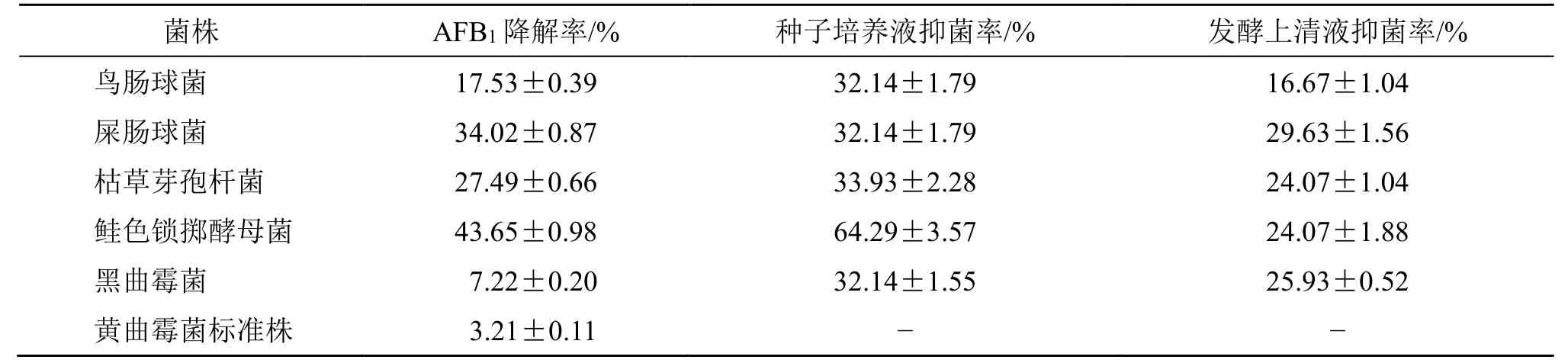
表1 5 株菌的种子培养液和发酵上清液对黄曲霉生长的抑制效果及对AFB1 的降解作用(,n=3)Table 1 Growth inhibition of A.flavus and degradation of AFB1 by five strains(,n=3)
菌株 AFB1 降解率/% 种子培养液抑菌率/% 发酵上清液抑菌率/%鸟肠球菌 17.53±0.39 32.14±1.79 16.67±1.04屎肠球菌 34.02±0.87 32.14±1.79 29.63±1.56枯草芽孢杆菌 27.49±0.66 33.93±2.28 24.07±1.04鲑色锁掷酵母菌 43.65±0.98 64.29±3.57 24.07±1.88黑曲霉菌 7.22±0.20 32.14±1.55 25.93±0.52黄曲霉菌标准株 3.21±0.11--
图1 液质联用色谱图Fig.1 LC-MS chromatograms
AFB1降解率=(对照组AFB1含量-试验组AFB1含量)/对照组AFB1含量
2.3 5 株待测菌对产毒黄曲霉生长的影响
2.3.1 产毒黄曲霉标准株(CGMCC3.4408)的孢子悬浮液制备 将产毒黄曲霉菌标准株接种于PDA培养基上,28 ℃培养5 d,加入适量无菌生理盐水洗脱黄曲霉孢子,无菌纱布滤过以滤除菌丝,血球计数板将黄曲霉孢子悬浮液调整为1×105cfu/mL,备用。
2.3.2 待测菌的培养
(1)待测菌种子液的制备:挑取经活化培养的待测菌,接种于20 mL 种子培养液中,细菌37 ℃静置培养12 h,真菌28 ℃、120 r/min 培养72 h。将上述种子液梯度稀释,选择合适的3 个稀释梯度,用移液枪吸取100 μL 稀释液分别注入相应的选择性培养基平板涂布均匀。细菌置37 ℃培养1 d,真菌置28 ℃培养3~5 d,分别对细菌、真菌进行计数,调整至1×107cfu/mL 的稀释液作为种子液,备用。
(2)待测菌发酵液的制备:吸取1 mL 1×107cfu/mL 的种子液接种于25 mL 细菌/真菌相应发酵培养基中,细菌于37 ℃培养72 h,真菌于28 ℃、120 r/min 培养96 h。
2.3.3 5 株待测菌对产毒黄曲霉生长的影响
(1)平板对峙法检测待测菌对产毒黄曲霉生长的影响:将1×105cfu/mL 的标准株黄曲霉孢子液10 μL 接种于培养基中央,用十字交叉法接种20 μL 1×107cfu/mL 各待测菌种子液于等距的4 端。以仅接种105cfu/mL 的黄曲霉标准株孢子于培养基中央作为对照组,分别置28 ℃霉菌培养箱培养5 d,量取并记录黄曲霉标准株菌落直径,计算抑菌率,每组3 个平行。
抑菌率=(对照组黄曲霉菌落直径-实验组黄曲霉菌落直径)/对照组黄曲霉菌落直径
各组黄曲霉菌生长状况如图2所示。结果(表1)显示,5 株菌种子培养液对产毒黄曲霉生长均有一定的抑制作用,其中鲑色锁掷酵母菌对黄曲霉生长的抑制作用最强,抑菌率达64.29%,屎肠球菌、鸟肠球菌、枯草芽孢杆菌、黑曲霉对黄曲霉生长的抑制率均在30%左右。

图2 平板对峙培养法检测各菌对产毒黄曲霉菌生长的影响Fig.2 Growth of A.flavus detected by plate confrontation culture
(2)待测菌发酵上清液对产毒黄曲霉菌生长的影响:取各待测菌株发酵液10 mL,11 269.44×g离心5 min,取上清液,0.22 μm 无菌滤膜滤过除菌。吸取8 mL 滤过除菌的上清液加入90 mm 的培养皿中,倾注20 mL PDA 培养基与之混匀,在平皿中央接种20 μL 1×105cfu/mL 的黄曲霉标准株孢子液,以平皿中央仅接种1×105cfu/mL 黄曲霉标准株孢子液作对照。分别置28 ℃霉菌培养箱培养5 d,记录菌落直径,计算抑菌率,每组3 个平行。
抑菌率=(对照组黄曲霉菌落直径-实验组黄曲霉菌落直径)/对照组黄曲霉菌落直径
各组黄曲霉菌的生长状况如图3所示。结果(表1)显示,5 株待测菌发酵上清液对产毒黄曲霉生长均有一定的抑制作用,其中屎肠球菌的抑制作用最强,抑制率为29.63%。

图3 各菌株发酵上清液对产毒黄曲霉生长的影响Fig.3 Effect of fermentation supernatant of different strains on growth of A.flavus
综上,5 株菌的发酵上清液对产毒黄曲霉菌的生长均有一定的抑制作用,表明5 株菌均可产生抑制产毒黄曲霉生长的代谢物质,如蛋白酶、有机酸等;5 株菌的种子培养液抑菌率均强于发酵上清液的抑菌率,表明这5 株菌通过空间性、营养性竞争来抑制产毒黄曲霉生长的效果强于其代谢产物的抑制效果;鲑色锁掷酵母菌的种子培养液抑菌率和AFB1降解率均强于其他4 株菌,而其发酵上清液抑制率与其他4 株菌差别不大,表明在淡豆豉炮制过程中,鲑色锁掷酵母菌在抑制产毒黄曲霉生长繁殖和降解AFB1方面发挥了较大的作用。
3 讨论
空气、水、土壤等自然环境中可能存在大量产AFT 的微生物,因此中药材很容易受到产AFT 菌的污染而产生AFT。解决中药材安全问题必须严格控制中药材AFT 污染。本实验建立了LC-MS 测定发酵液中AFB1的方法。该方法具有快速、准确、灵敏等特点,有助于提高分析效率,降低成本,为测定发酵液中AFB1含量提供参考。
目前,中药材中黄曲霉毒素污染的防治措施主要分为2 种:预防和降解。预防措施主要在生产过程中减少产AFT 菌的污染和储藏条件控制等。降解方法主要有3 种:物理、化学和生物方法。物理方法如辐射法等,降解效果较好,但可能存在使被辐射的产品过氧化值增加,因穿透力差而未能彻底去除,甚至触发存活的产毒菌株产生黄曲霉毒素B1等问题[14-15],化学方法如碱处理法降解作用比较强,但成本高,污染大[16]。而使用生物脱毒法更天然、绿色、安全和经济[17]。
近年来,国内外已对降解AFB1和抑制产AFT菌生长的微生物进行了大量研究。研究发现,一些微生物,如乳酸菌、酵母菌和芽孢杆菌,可抑制曲霉菌的生长及其产毒,在控制AFT 污染方面有着巨大的应用价值。Osouli 等[18]研究了枯草芽孢杆菌M419 无细胞上清液对黄曲霉的抑制率为57%。张秀江等[19]研究发现,质量浓度为0.25 mg/mL 的酵母霉菌毒素降解剂对AFB1的脱毒效率最好,为98.21%。吉小凤等[20]研究发现从肉鸡肠道粪便中筛选到的发酵乳杆菌LAB-10 对14 μg/L AFB1在48 h的降解率为63.4%。
本研究表明从淡豆豉炮制过程中分离的5 株菌对产AFT 的黄曲霉生长繁殖均有一定的抑制作用,同时对AFB1的降解也有一定的效果。屎肠球菌、鸟肠球菌和枯草芽胞杆菌对产毒黄曲霉菌的抑制率均达30%以上,这3 种菌同时是淡豆豉炮制过程中的优势菌,在抑制产毒黄曲霉菌生长繁殖的同时,还可以促进 γ-氨基丁酸(γ-aminobutyric acid,GABA)的产生[21]。5 株菌中鲑色锁掷酵母菌对产毒菌生长的抑制作用和降解AFB1的效果最好,抑制率和降解率分别为64.29%、43.65%。
本课题组前期研究发现鲑色锁掷酵母菌在整个淡豆豉炮制过程中始终存在,并且呈先上升后下降的趋势,在再闷第3 天达到最大值。文献报道鲑色锁掷酵母菌由于可产生多种具有芳香气味的酯类化合物,其在培养过程中会发出类似于天然水果发出的香味[22-23]。因此淡豆豉炮制过程中鲑色锁掷酵母菌的存在,使炮制出来的淡豆豉具有黄曲霉毒素含量少甚至无毒并且香味浓郁以及GABA 产量高等特点。
微生物降解AFT 的主要机制是通过吸附作用或酶促反应降解毒素或者修饰毒素分子而达到脱毒的目的。吸附作用主要是通过微生物与产毒菌结合成较稳定的无毒复合物而排出体外,而酶促作用是通过微生物分泌的酶破坏AFT 的毒性结构位点双呋喃环末端双键、内酯环和环戊烯酮环,产生无毒的降解产物[24-27]。严家俊[28]对一株枯草芽胞杆菌降解AFB1作用机制的研究发现,菌株培养液中上清液对AFB1的降解率达到82.6%,对培养液上清液进行热处理及蛋白酶K 处理后,发现处理后的上清液对AFB1的降解能力大大降低,推测出现这种情况是菌株降解AFB1的活性物质经热处理和蛋白酶K 处理后,酶活性被降低,说明该菌株对AFB1的降解过程为菌株胞外酶的酶促反应。
一些食用豆酱类食品中含有AFT 拮抗微生物,这些微生物可以通过吸附、降解等作用使食品中的AFT 减少。Huang 等[29]研究发现发酵食品豆腐中存在一种益生菌-植物乳杆菌,它可以与AFB1结合成一种稳定的复合物而排出体外,从而减轻AFB1对小鼠的毒性。张盼等[30]从食用纳豆中筛选出一株高效降解AFB1的枯草芽孢杆菌,该细菌的发酵上清液经浓缩后制成的粗酶液对AFB1降解率达91.4%。在淡豆豉炮制中,AFT 产毒菌和拮抗菌可能通过竞争生长空间和营养物质、分泌有机酸、过氧化物、蛋白酶等代谢产物抑制产AFT 菌的孢子萌发和菌丝生长。
目前,有许多研究者对拮抗菌抑制产毒菌株生长繁殖机制进行了大量的研究。微生物对产AFT 菌生长的抑制作用主要分为竞争抑制作用和代谢产物抑制作用。竞争抑制作用机制主要是产毒菌被非产毒菌株竞争生长空间而被物理排除,或与产毒菌竞争生长和合成毒素的营养物质。代谢产物抑制作用是通过拮抗菌产生的一些酶、有机酸和抗生素等物质来抑制产毒菌的生长和产毒,如芽孢杆菌产生的抗生素和蛋白酶,乳酸菌产生的有机酸和多肽,酵母菌产生的几丁质酶等均对黄曲霉的生长有很强的抑制作用[31]。
本研究中,5 株菌的种子液对产毒黄曲霉菌均有一定的抑制作用,这种抑制作用可能是竞争性抑制或是代谢产物抑制。5 株菌的过滤无菌发酵液对产毒黄曲霉菌均有一定的抑制作用,但其抑制效果弱于种子液,由此说明5 株菌对产毒黄曲霉菌生长的抑制作用是通过营养竞争性抑制和代谢产物抑制的共同结果。
淡豆豉炮制过程中多种微生物共同参与,不同炮制时间点存在不同的优势菌,整个炮制过程中微生物种类呈交替更迭,炮制至后期已不存在黄曲霉和溜曲霉等可能产生AFT 的微生物[9-12]。本实验室前期检测了淡豆豉炮制过程中各时间点AFT 的含量,发现“黄衣上遍”阶段中的发酵第3 天、发酵第6 天,以及“再闷”阶段中的再闷第3 天、再闷第6 天、再闷第9 天均存在AFT 污染,再闷第6天达到最大值,再闷第9 天下降到1.2 ng/mL,同时也发现发酵第3 天、发酵第6 天、再闷第3 天、再闷第6 天均存在产AFT 菌株,主要为黄曲霉菌和溜曲霉菌,发酵第6 天产毒菌数量最多,再闷第3 天检测到菌落数开始下降。本研究表明多种拮抗菌导致了淡豆豉炮制中产AFT 菌数量和AFB1含量的动态变化,研究结果将为揭示淡豆豉炮制过程AFT 消长机制奠定基础,并为淡豆豉黄曲霉毒素的防控措施提供科学依据。
本实验室后续将进一步筛选鉴定既能抑制产毒菌产AFB1又能降解AFB1的高效拮抗菌,并对拮抗菌的拮抗机制和安全性等深入研究。
利益冲突所有作者均声明不存在利益冲突

