玉米须化学成分研究
李晓雪,赵 明,2*,马耀玲,王 丹,2,时志春,2,李 军,2,王金兰,2,王伟明,张树军,2
1.齐齐哈尔大学化学与化学工程学院,黑龙江 齐齐哈尔 161006
2.黑龙江省工业大麻加工技术创新中心,黑龙江 齐齐哈尔 161006
3.黑龙江省中医药科学院中药研究所,黑龙江 哈尔滨 150036
玉米须为禾本科玉蜀属植物玉米Zea maysLinn.的花柱和柱头,又名玉麦须、玉蜀黍芯、棒子毛,其味淡,性甘、平。现代药理学研究表明其具有抗氧化、抗肾结石、降血糖、清血热、利尿、平肝、利胆等功效[1-6]。近年来,随着生活水平的提高,人们越发注重医疗保健,更青睐天然绿色的传统中药材。玉米须不仅是传统中药材,还可做茶饮,具有利水、消肿、清热、降血糖、降血压等作用,其潜在的医疗保健作用与其生物活性成分密切相关[7-9]。为进一步开发利用玉米须资源,在前期研究[10]的基础上,从玉米须甲醇浸提液醋酸乙酯萃取物中分离得到4 个化合物,通过理化性质及波谱数据分析,并结合计算电子圆二色谱(ECD)鉴定其结构分别为 6β,12β-二羟基-4(5),7(8)-玉米二烯[6β,12β-dihydroxy-4(5),7(8)-stigmdiene,1]、8α,10α-二羟基-4(5),7(12)-玉米二烯[8α,10α-dihydroxy-4(5),7(12)-stigmdiene,2]、环己甲酸甲酯(methyl cyclohexane-carboxylate,3)、氮乙酰对羟基苯乙胺(N-acethyl-tyramine,4)。其中化合物1、2 是未见报道的新化合物。评估了化合物1、2 对人膀胱癌T-24 细胞、卵巢癌SK-OV-3 细胞、宫颈癌HeLa 细胞、乳腺癌MCF-7 细胞、胃癌BGC-823 细胞的细胞毒活性及HepG2 细胞中葡萄糖消耗活性。化合物1 对SK-OV-3 细胞及T-24 细胞显示出抑制活性,抑制率分别为11.86%、18.64%。化合物1 对HepG2细胞中葡萄糖消耗具有促进作用,消耗率为10.30%。
1 仪器与材料
X-6 显微熔点测定仪(北京泰克仪器有限公司);Autopol V 型旋光仪(美国鲁道夫公司);Xevo QTOF 质谱仪(美国Waters 公司);TU-1901 双光束紫外可见分光光度计(北京普析通用仪器有限责任公司);Bruker AV-600 核磁共振波谱仪(德国Bruker 公司);Shimadzu 高效液相色谱仪(日本岛津公司):LC-20AR 泵、RID-20A 视差折光检测器、Sunfire TM Prep C18 OBDTM(100 mm×19 mm,5 μm)不锈钢柱;柱色谱用硅胶(200~300 目)为青岛海洋化工厂产品;薄层色谱(TLC)硅胶板为烟台化工厂产品;J-1500 CD 圆二色谱仪(日本分光株式会社)。
玉米须于2017年8月14日采自黑龙江省海伦市红光农场,经齐齐哈尔大学沙伟教授鉴定为玉米Zea maysLinn.的花柱和柱头,标本(No.20170814)收藏于齐齐哈尔大学天然产物研究室。
2 方法
2.1 提取与分离
11.0 kg 干燥的玉米须粉碎,每次用甲醇10 L室温浸泡3 d 后滤过,重复3 次,合并浸提液浓缩至小体积加水混悬,依次用正己烷、醋酸乙酯萃取3 次,合并相同溶剂萃取液,减压浓缩至恒定质量,得醋酸乙酯萃取物11.7 g。
取醋酸乙酯萃取物11.2 g,经硅胶色谱柱分离,依次用二氯甲烷-甲醇(9.5∶0.5,5.7 L)(8∶2,5.8 L)及甲醇(4.0 L)洗脱,经TLC 检测合并相近流分,浓缩得F1~F10。F4(738.7 mg)在流动相为甲醇-水(9∶1)、体积流量4 mL/min 条件下进行反相HPLC 分离,得到F4-1~F4-5;F4-1(481.7 mg)在流动相为甲醇-水(7∶3)、体积流量4 mL/min 条件下进行反相HPLC 分离,得到F4-1-1~F4-1-5;F4-1-1(163.2 mg)在流动相为甲醇-水(4∶6)、体积流量4 mL/min 条件下进行反相HPLC 分离,得到化合物1(2.0 mg,tR=20.9 min)、3(1.4 mg,tR=10.2 min)。F5(1.7 g)在流动相为甲醇-水(9∶1)、体积流量4 mL/min 条件下进行反相HPLC 分离,得到F5-1~F5-6;F5-1(508.2 mg)在流动相为甲醇-水(7∶3,体积流量4 mL/min)条件下进行反相HPLC 分离,得到F5-1-1~F5-1-9;F5-1-9(20.2 mg)在流动相为甲醇-水(6∶4)、体积流量4 mL/min 条件下进行反相HPLC 分离,得到化合物4(1.5 mg,tR=13.5 min)。F7(1.6 g)在流动相为甲醇-乙腈-水(2.8∶1.7∶5.5)、体积流量4 mL/min 条件下进行反相HPLC 分离,分离得到F7-1~F7-6;F7-3(178.7 mg)在流动相为甲醇-乙腈-水(2.4∶1.6∶6.0)、体积流量4 mL/min 条件下进行反相HPLC 分离,分离得到化合物2(2.3 mg,tR=41.2 min)。
2.2 肿瘤细胞抑制活性测定
以阿霉素(10 μmol/L)为阳性对照采用MTT法,评价化合物1、2 对人体肿瘤细胞株T-24、SK-OV-3、HeLa、MCF-7、BGC-823 的体外活性。用含10%胎牛血清培养液配成单个细胞悬液,以每孔3×103~7×103个细胞接种到96 孔板,每孔体积100 μL,贴壁细胞提前24 h 接种培养。加入不同浓度(1、10、100 μmol/L)的待测化合物,48 h 后,向每孔中加入20 μL(5 mg/mL)MTT 溶液,并在37 ℃下孵育4 h。除去上清液后,向每孔中加入150 μL DMSO,用连续波长酶标仪在570 nm 处测定吸光度(A)值。按公式计算各样品的肿瘤细胞生长抑制率。
抑制率=(A对照-A样品)/A对照
2.3 葡萄糖消耗活性测定
以二甲双胍(1 μmol/L)为阳性对照,评价化合物1、2 对人肝癌HepG2 细胞的体外葡萄糖消耗活性。将HepG2 细胞在补充有10% FBS 的高葡萄糖DMEM 中的96 孔培养板上培养24 h,然后在无血清和无酚红的高葡萄糖DMEM 中用0.15 mmol/L棕榈酸酯处理12 h 后,将细胞分别用高葡萄糖DMEM 和PBS 洗涤2 次,将无血清和无酚红的高葡萄糖DMEM 以及各种浓度(1、10、100 μmol/L)的测试化合物添加到细胞中孵育24 h。孵育后,使用葡萄糖测定试剂盒通过葡萄糖氧化酶法测定培养基中的葡萄糖含量。正常对照组为90 μL 培养基+10 μL 生理盐水,样品组为90 μL 培养基+10 μL 样品,按公式计算样品促进细胞葡萄糖消耗率。
促进细胞葡萄糖消耗率=(正常对照组葡萄糖含量-样品组葡萄糖含量)/正常对照组葡萄糖含量。
3 结果
3.1 结构鉴定

表1 化合物1、2 的1H-NMR 及13C-NMR 数据(600/150MHz,CD3OD)Table 1 1H-NMR and 13C-NMR data(600/150MHz,CD3OD)for compounds 1 and 2

图1 化合物1 和2 主要的1H-1H COSY、HMBC 相关Fig.1 Key 1H-1H COSY and HMBC correlations of compounds 1 and 2
与文献数据[11]对照,并根据H-1(δ2.16,ddd,J=12.5,9.6,2.6 Hz)可以推断H-1 为β 取向,根据H-1 与H-2(δ1.85),H-6 与H-2(δ1.65)的NOE 相关(图2)可以推断H-6 为α 取向。根据H-12(δ4.12,t,J=4.1 Hz)可推断12-OH 为β 构型。进一步使用CPCM模型在甲醇中针对(1S,6S,12R)-1a和(1S,6R,12S)-1b 在B3LYP/6-31+g(d,p)计算水平上计算得到的ECD 谱,结果表明计算出的(1S,6S,12R)-1a ECD谱与实验ECD 谱吻合,因此确定了化合物1 的绝对构型,命名为6β,12β-二羟基-4(5),7(8)-玉米二烯。
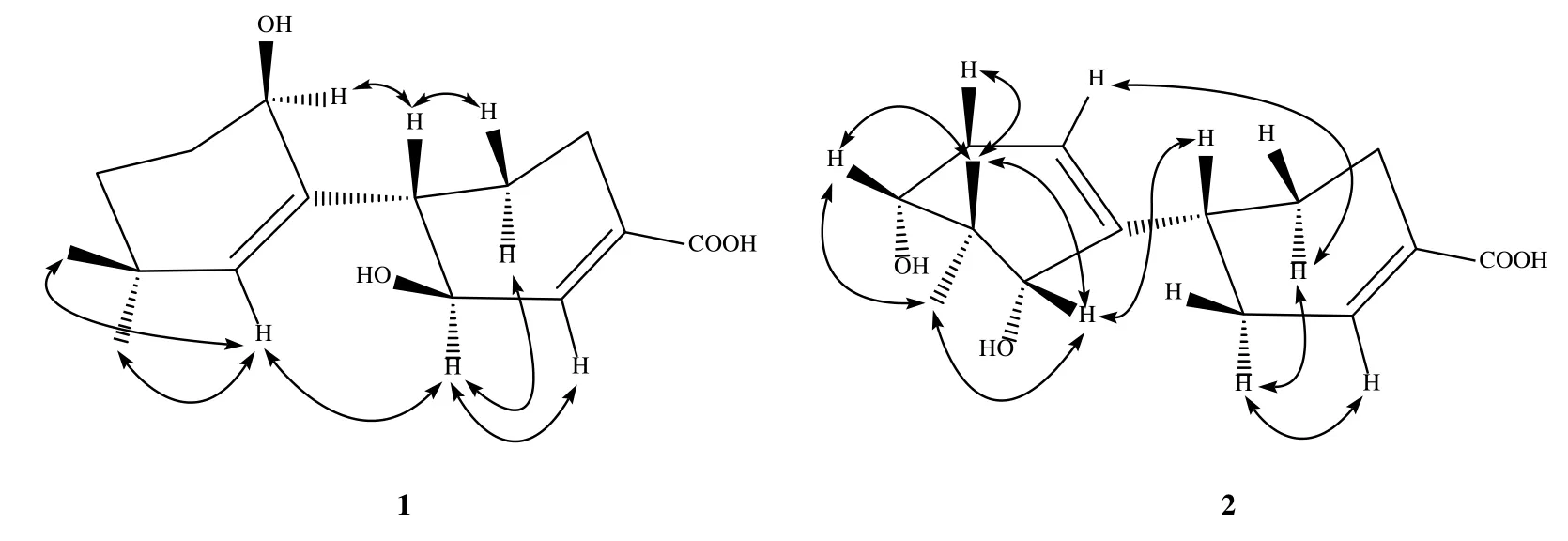
图2 化合物1 和2 主要的NOESY 相关Fig.2 NOESY correlations of compounds 1 and 2
根据H-8,H-10 与偕二甲基H-13,H-14 均有NOE 相关,可以推断出H-8,H-10 为β 取向,参照文献报道[11]及H-1 与H-8 具有NOE 相关(图2),确定H-1 为β 取向。进一步使用CPCM 模型在甲醇中针对(1R,8R,10R)-2a 和(1R,8S,10S)-2b 在B3LYP/6-31+g(d,p)计算水平上计算得到的ECD谱,计算出的(1R,8R,10R)-2a ECD 谱与实验ECD谱吻合,因此确定了化合物2 的绝对构型,命名为8α,10α-二羟基-4(5),7(12)-玉米二烯。
化合物3:白色粉末;mp 175~177 ℃;1H-NMR(600 MHz,CD3OD)δ:3.64(3H,s,-OCH3),2.30(1H,t,J=7.4 Hz,H-1′),1.61(4H,m,H-2′,6′),1.32(6H,m,H-3′~5′);13C-NMR(150 MHz,CD3OD)δ:174.6(C-1),50.5(-OCH3),33.4(C-1′),28.6(C-2′,6′),24.6(C-3′,5′),28.7(C-4′)。以上数据与文献报道一致[12],故鉴定化合物3 为环己甲酸甲酯。
化合物4:白色粉末;mp 168~170 ℃;1H-NMR(600 MHz,CDCl3)δ:7.04(2H,m,H-2,6),6.79(2H,m,H-3,5),3.49(2H,q,J=6.6 Hz,H-2′),2.74(2H,t,J=6.6 Hz,H-1′),1.95(3H,s,H-4′);13C-NMR(150 MHz,CDCl3)δ:170.1(C-3′),154.6(C-4),130.8(C-1),129.9(C-2,6),115.5(C-3,5),40.8(C-2′),34.7(C-1′),23.4(C-4′)。该结果与合成的氮乙酰对羟基苯乙胺一致[13],故鉴定化合物4 为氮乙酰对羟基苯乙胺。
3.2 肿瘤细胞抑制活性及葡萄糖消耗活性
以阿霉素为阳性对照,化合物1、2 在1、10、100 μmol/L 时,测试对人体外肿瘤细胞株T-24、SK-OV-3 的抑制活性。结果显示,在浓度为10.0 μmol/L 时,表现出一定活性,见表2。
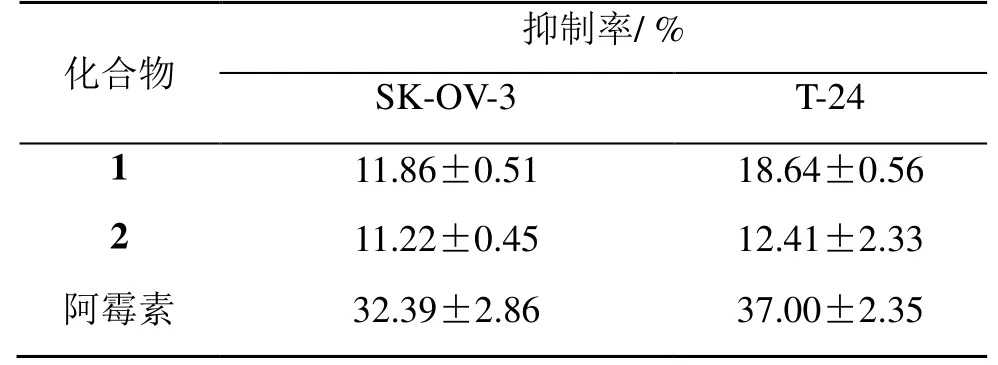
表2 化合物1、2(100 μmol·L−1)对SK-OV-3、T-24 的抑制率Table 2 Inhibition rate of compounds 1 and 2 in SK-OV-3 and T-24 cells
结果表明,化合物 1 对人体肿瘤细胞株SK-OV-3 及T-24 的抑制率分别为11.86%、18.64%,显示出一定的抑制活性,化合物2 则相对更弱。对HeLa、MCF-7、BGC-823 细胞基本没有抑制活性。
化合物1、2 的葡萄糖消耗活性测试结果见表3。由该结果可知,化合物1、2 在10.0 μmol/L 浓度对HepG2 细胞中葡萄糖消耗显示一定促进作用,消耗率分别为10.30%、9.80%。

表3 化合物1、2 在HepG2 细胞中的促进葡萄糖消耗率Table 3 Glucose consumption of compounds 1 and 2 in HepG2 cells
4 讨论
玉米须在中医用药及民间均有作降糖用,化合物1、2 在结构上属倍半萜类,对HepG2 细胞中葡萄糖消耗显示一定的促进作用,由此推测玉米须的降糖作用可能与该类倍半萜化合物有关,将在后续研究中进一步验证。
利益冲突所有作者均声明不存在利益冲突

