藏木香中1个新桉烷型倍半萜内酯
刘 玲,倪恒凡,邱 翔,朱 吕,王 欢,谭 艳,张舜杰,李先登,万 丽*,赵 旻
1.成都中医药大学,四川 成都 611137
2.四川大学华西医院,四川 成都 610041
藏木香为菊科(Asteraceae)旋覆花属InulaL.植物总状土木香Inula racemosaHook.f.的干燥根,藏药名为“玛奴”[1]。其性温,味苦、辛,具有行气化瘀、温中止吐、调气解郁、驱虫利尿、止痛之功效[2]。在众多经典藏方如四味藏木香汤散[3-4]等中广泛应用,在治疗消化不良[4]、慢性萎缩性胃炎[5]、血隆相关疾病[4]等方面疗效确切。而现代药理研究亦表明藏木香中多种降倍半萜、桉烷型及愈创木型倍半萜在抗炎方面具有显著的抑制活性[7-8]。因此,本研究以考察对尼日利亚菌素(nigericin)诱导人单核细胞白血病 THP-1 细胞中白细胞介素-1β(interleukin-1β,IL-1β)的抑制作用为导向,追踪藏木香中的活性成分,从其干燥根乙醇提取物的石油醚萃取部分分离纯化得到1 个活性倍半萜,利用现代波谱技术和化学水解方法对该化合物进行结构鉴定,确定化合物1为新的桉烷型倍半萜,命名为藏木香素I。为准确验证该结构,使用0.2 mol/L NaOH对其进行水解,得到水解产物为isotelekin(1a)和3-苯甲酰基丙烯酸(1b)。结构见图1。体外活性实验表明化合物1 对nigericin 诱导的THP-1 细胞中IL-1β 的释放具有显著的抑制作用,其半数抑制浓度(IC50)为2.1 μmol/L。采用乳酸脱氢酶(lactate dehydrogenase,LDH)检测法确定给药后nigericin诱导的THP-1 细胞中LDH 的释放以判断化合物的抗炎作用是否源于其细胞毒性导致的细胞死亡,结果表明该化合物不仅对THP-1 细胞不具有毒性,而且可抑制nigericin 诱导的THP-1 细胞死亡,对THP-1 细胞具有一定的保护作用。
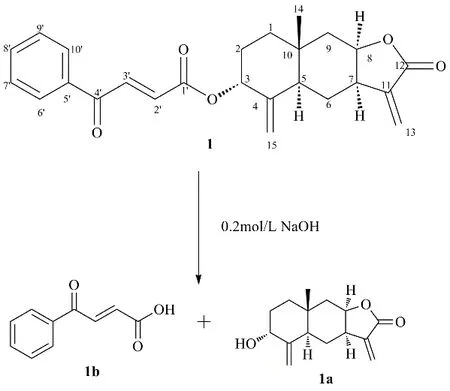
图1 化合物1 及其水解产物的化学结构Fig.1 Structure of compound 1 and its alkaline hydrolysis products
1 仪器与材料
Bruker Ascend 400 型核磁共振仪(德国Bruker公司);Waters Synapt G2 型高分辨率质谱仪(美国Waters 公司);Perkin Elmer one FT-IR 型红外光谱计(美国PerkinElmer 公司);Anton Paar MCP200 型旋光仪(美国Anton Paar 公司);Shimadazu UV-2600/2700 紫外可见分光光度计(日本Shimadazu 公司);Ultimate3000 赛默飞高效液相色谱仪[赛默飞世尔科技(中国)有限公司];Capcell pak C18分析型色谱柱(250 mm×4.6 mm,5 μm,日本Shiseidao 公司);NP7000 型半制备液相色谱仪(江苏汉邦科技有限公司);Kromasil C18半制备色谱柱(250 mm×10 mm,5 μm,瑞典Akzo Nobel 公司);薄层色谱硅胶GF254和柱色谱硅胶(青岛海洋化工厂);50 μm ODS反相C18填料(日本YMC 公司);50 μm MCI树脂(日本Mitsubishi Chemical 公司)。实验所用试剂:氘代试剂(美国Sigma Aldrich 公司);色谱纯甲醇[赛默飞世尔科技(中国)有限公司];ELISA 试剂盒(北京四正柏生物科技有限公司);人THP-1 外周血单核细胞样细胞(武汉普诺赛生命科技有限公司);RPMI 1640 培养基(美国Gibco 公司);opti-MEM(美国Gibco 公司);脂多糖(美国Sigma Aldrich 公司);LDH 细胞毒性检测试剂盒(美国Promega 公司,CytoTox 96®Non-Radioactive Cytotoxicity Assay)
研究所用藏木香药材于2020年1月采自西藏拉萨市林周县,由成都中医药大学万丽教授鉴定为菊科旋覆花属植物藏木香I.racemosaHook.f.的干燥根,样本(HX20200130)存放于四川大学华西医院。
2 提取与分离
藏木香鲜药材洗净泥沙,趁鲜切片后,放阴凉通风处自然晾干。晾干后的干燥根约6.5 kg 粉碎过2 号筛,用50 L 95%乙醇浸泡提取3 次,每次浸泡4 d。减压抽滤提取液后减压浓缩至浸膏,得乙醇提取物1056 g。接着将该乙醇提取物分散于5 L 水中,分别用石油醚、二氯甲烷、和醋酸乙酯各5 L 进行萃取,重复3 次,减压浓缩得到各萃取浸膏(254、202、280、300 g)。采用ELISA 实验检测各萃取部位对nigericin 诱导的THP-1 细胞中IL-1β 的释放的抑制作用,确定石油醚萃取部位为主要活性部位。将该石油醚浸膏用MCI 柱色谱去除色素,以90%甲醇进行洗脱,浓缩洗脱液,得淡黄色浸膏85 g。采用硅胶柱色谱对该石油醚部位进行分离,以石油醚-醋酸乙酯体系(100∶1~1∶1)进行梯度洗脱,根据薄层色谱(TLC)合并得到8 个组分(A~H),并同样利用nigericin 诱导的THP-1 细胞进行活性筛选,确定组分B 的活性最好。将组分B(6.8 g)经ODS 中压柱色谱,以10%~100%甲醇梯度洗脱,每100 mL 收集1 份,根据TLC 检视[石油醚-醋酸乙酯(5∶1)]合并得到10 个组分Fr.1~10。经活性筛选后,将活性组分Fr.8(556 mg)经半制备HPLC 色谱,用体积分数为85%甲醇,体积流量3 mL/min 等度洗脱,检测波长为210 和254 nm,分离得到化合物1(20 mg,tR=10.31 min)。
3 结构鉴定
化合物1:淡黄色油状液体,[α]20D-9(c0.5,CHCl3)。HR-ESI-MS 给出准分子离子峰为m/z:429.167 6[M+Na]+(计算值为 429.167 8,C25H26O5Na),故化合物分子式为C25H26O5,不饱和度为13。红外光谱显示羰基(1764、1717、1671 cm-1)、苯环(1159、1017、978 cm-1)等特征信号。1H-NMR 谱(表1)显示有26 个氢信号,包括1 组单取代的芳香共振质子信号δH7.99(2H,dd,J=7.6,1.2 Hz),7.63(1H,tt,J=7.5,1.2 Hz,),7.51(2H,t,J=7.5 Hz);1 组反式共轭烯氢信号δH7.90(1H,d,J=15.5 Hz,H-3′)和6.89(1H,d,J=15.5 Hz,H-2′);4个烯氢质子信号δH6.14(1H,s,13β),5.59(1H,s 13α),5.20(1H,s,15β),4.76(1H,s,15α);以及1 个甲基信号δH0.86(3H,s,H-15)。通过DEPT 谱还可以确定6 个亚甲基信号δC120.6(C-13),113.3(C-15),41.0(C-9),36.5(C-1),27.1(C-2)和27.0(C-6);4 个次甲基信号δC76.7(C-3),76.6(C-6),41.6(C-5)和40.5(C-7);以及7 个季碳信号。结合HSQC 谱对上述基团对应的一维信号进行归属。在HMBC 谱中可观察到H-1 与C-3、C-5、C-9 和C-14 之间存在远程相关;H-2 与C-4 和C-10 之间有远程相关;H-5与C-7、C-9 和C-14 之间存在远程相关;H-6与C-10、C-11 之间有远程相关;H-9 与C-1、C-7 和C-14 之间存在远程相关;结合1H-1H COSY 谱中H-1/H-2/H-3 和H-5/H-6/H-7/H-8/H-9 相邻质子之间给出的相关信号;证明了2 个六元环是通过5、10位碳进行骈合。此外,根据HMBC 谱中H-7 与C-12、C-13 和C-9 之间的远程相关;H-13 与C-11、C-12和C-7 之间的远程相关,以及H-8 与C-12 之间存在的远程相关,可以推测出C-8 位羟基与连接在C-7位上的异丙烯酸形成内酯。最后,可根据H-15 与C-4、C-3 的远程相关信号确定C-4 位的双键位置,而连在C-11 位的双键位置则由H-13 与C-11、C-12、C-7 的远程相关信号确定。至此,经文献检索综合判断可知,该部分信号与桉烷型倍半萜内酯isotelekin[9]非常吻合。剩余部分根据HMBC 谱给出的H-6′与C-4′、C-5′和C-8′之间的远程相关信号,H-3′与C-1′、C-5′之间的远程相关信号,以及H-3′与C-4′之间的远程相关;并结合1H-1H COSY 谱中H-6′/H-7′/H-8′/H-9′/H-10′和H-3′/H-2′的相关信号;推测此部分结构与和3-苯甲酰基丙烯酸[10]非常相似。同时,根据HMBC 谱中的H-3(δH5.50)与C-1′(δC164.7)的远程相关信号可以确定该化合物可能是由3-苯甲酰基丙烯酸与isotelekin 的C-3位羟基形成酯键相连而成。综上所述,化合物1 的平面结构鉴定完成(图2)。另外,化合物的相对构型可以通过NOESY 谱中H-5 与H-7 和H-8 之间,H-3 与H-14 之间,以及H-2′与H-6′之间的相关信号得到判断(图3)。
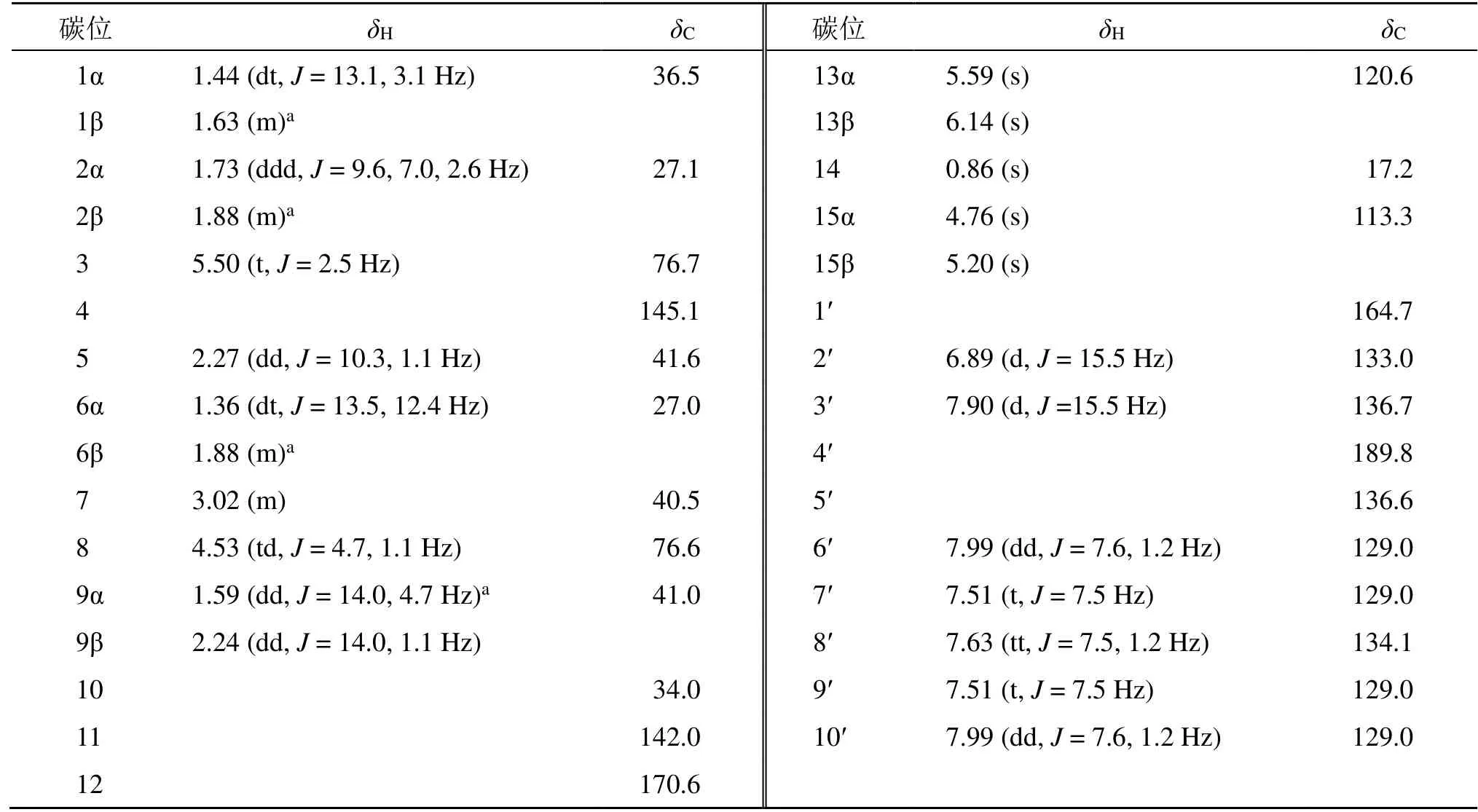
表1 化合物1 的1H-NMR(400 MHz,CDCl3)和13C-NMR(100 MHz,CDCl3)数据Table 1 1H NMR(400 MHz,CDCl3)and 13C NMR(100 MHz,CDCl3)data for compound 1
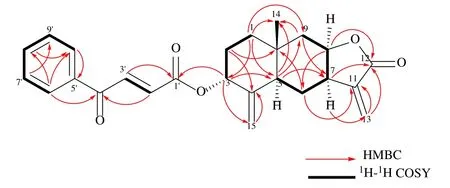
图2 化合物1 的主要HMBC 和1H-1H COSY 相关Fig.2 Key HMBC and 1H-1H COSY correlations of compound 1
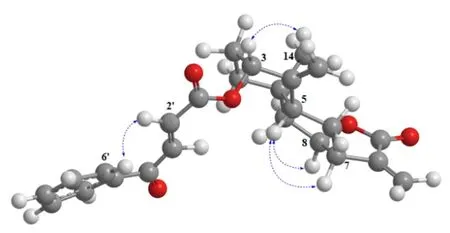
图3 化合物1 的主要NOESY 相关Fig.3 Key NOESY correlations of compound 1
由于该化合物的手性中心全部存在于桉烷型倍半萜的母核结构上,因此只要判断出母核的绝对构型就可以鉴定此化合物的绝对构型。本实验采用化学水解法对化合物1 绝对构型进行确定[11-12],用0.2 mol/L NaOH 对其进行水解,反应完成后加5%稀盐酸进行中和,用醋酸乙酯萃取,萃取产物经半制备液相分离纯化得到水解产物1a 和1b。通过与已知化合物的波谱数据及理化性质进行比对,确定化合物1a 和1b 分别为isotelekin 和3-苯甲酰基丙烯酸。综上所述,化合物1 的结构见图1,为新的桉烷型倍半萜内酯,命名为藏木香素I。
化合物1a:类白色结晶状固体,[α]20D+92(c0.5,CHCl3),HR-ESI-MS 给出准分子离子峰m/z271.130 8[M+Na]+(计算值为271.131 0),确定分子式为C15H20O3。1H-NMR(400 MHz,CDCl3)δ:6.06(1H,d,J=0.8 Hz,H-13β),5.54(1H,d,J=0.6 Hz,H-13α),4.92(1H,s,H-15β),4.51(1H,s,H-15α),4.45(1H,td,J=4.8,1.4 Hz,H-8),4.25(1H,t,J=2.7 Hz,H-3),2.95(1H,m,H-7),2.37(1H,dd,J=12.5,1.6 Hz,H-5),2.13(1H,dd,J=15.4,1.3 Hz,H-9β),1.70~1.60(4H,m,H-2α,2β,6β,9α),1.52(1H,dd,J=15.7,4.7 Hz,H-1β),1.33~1.19(2H,m,H-1α,6α),0.74(3H,s,H-14);13C-NMR(100 MHz,CDCl3)δ:170.7(C-12),150.2(C-4),142.1(C-11),120.2(C-13),109.6(C-15),76.9(C-8),73.1(C-3),40.9(C-9),40.4(C-5),40.1(C-7),35.7(C-1),34.1(C-10),29.1(C-2),27.0(C-6),16.9(C-14)。以上数据与文献报道的数据一致[9,13],故鉴定化合物1a 为isotelekin。
化合物1b:白色粉末状固体,HR-ESI-MS 给出准分子离子峰m/z199.036 8[M+Na]+(计算值为199.037 1),确定分子式为C10H8O3。1H-NMR(400 MHz,DMSO-d6)δ:8.02(2H,J=7.7 Hz,H-7,9),7.87(1H,d,J=15.6 Hz,H-3),7.71(1H,t,J=7.4 Hz,H-8),7.58(2H,t,J=7.7 Hz,H-6,10),6.68(1H,d,J=15.6 Hz,H-2);13C-NMR(100 MHz,DMSO-d6)δ:189.6(C-4),166.4(C-1),136.3(C-5),136.2(C-3),134.1(C-8),133.0(C-2),129.1(C-7,9),128.8(C-6,10)。以上数据与文献报道的数据一致[10,14],故鉴定化合物1b 为3-苯甲酰基丙烯酸。
4 对nigericin 诱导的THP-1 细胞中IL-1β 释放的抑制作用
根据参考文献报道[15]采用ELISA 法检测IL-1β的释放,评价化合物1 对nigericin 诱导的THP-1 细胞中IL-1β 释放的抑制活性,以半数抑制浓度(IC50)表示,具体步骤参照试剂盒说明书。结果表明,化合物1 对nigericin 诱导的THP-1 细胞中IL-1β 的释放具有显著的抑制作用,IC50为2.1 μmol/L,而阳性药姜黄素为5 μmol/L。
5 LDH 试验
为排除化合物1 对IL-1β 释放的抑制作用可能由于其细胞毒性导致的THP-1 细胞死亡所致,采用LDH 法检测对给药后nigericin 诱导的THP-1 细胞中LDH 的释放量,以此来进行细胞死亡分析,具体步骤参照试剂盒说明书。结果表明(图4),化合物1 不仅对THP-1 细胞无毒性作用,还能以剂量相关的方式减轻nigericin 诱导的细胞死亡,说明其对THP-1 细胞具有一定保护作用。
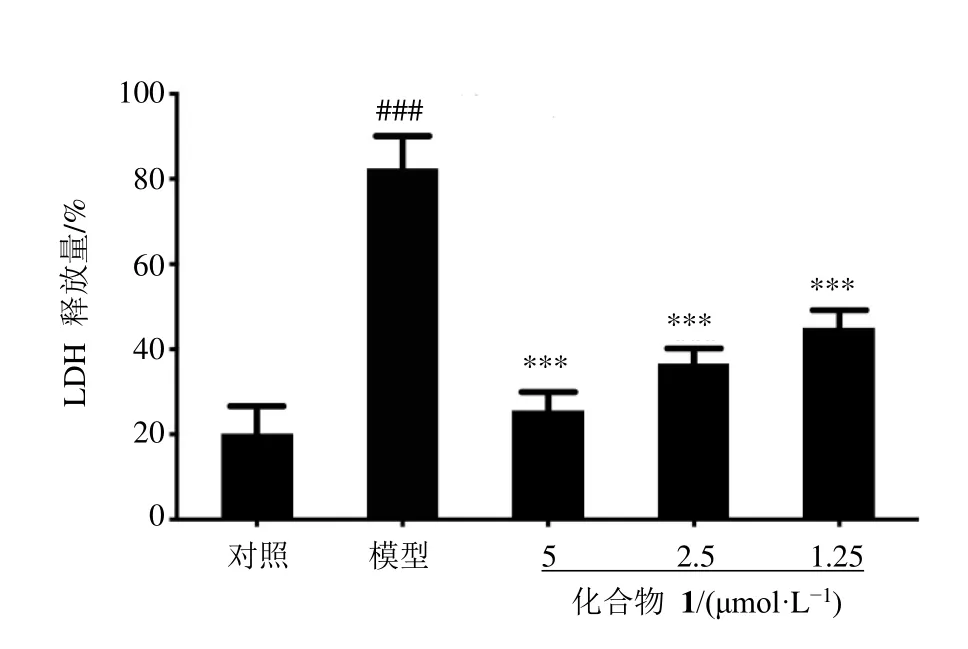
图4 LDH 法检测化合物1 处理后nigericin 诱导的THP-1细胞中LDH 的释放量Fig.4 LDH release in supernatants from nigericin-induced THP-1 cells treated with compound 1
6 讨论
本实验利用多种色谱分离技术及天然产物结构鉴定方法,通过活性追踪从藏木香中分离得到藏木香素I,该化合物对nigericin 诱导的THP-1 细胞中IL-1β 释放具有显著的抑制作用,且无细胞毒性,可为藏木香的进一步开发和应用提供参考。
利益冲突所有作者均声明不存在利益冲突
——青蒿素

