发作性运动诱发性运动障碍患者的致病基因鉴定
马红樱,黄炳辉,刘 程,袁应旺
(湖北理工学院 医学院,湖北 黄石 435003)
发作性运动诱发性运动障碍(Paroxysmal Kinesigenic Dyskinesia,PKD)是最常见的运动障碍疾病,在儿童期或青春早期发病,平均发病年龄为12岁。其临床症状为反复的简短的肌张力障碍性发作、手指徐动症、投掷样动作、舞蹈样运动或几种症状的结合[1-2]。良性家族性婴儿惊厥(Benign Familial Infantile Seizures,BFIS)是一种癫痫综合征,常在0.5~2岁发病[3]。PKD和BFIS常共存于同一个家系,或同一个患者的不同发育时期[4]。
PKD 的发病因素主要是遗传因素,即为原发性PKD,有家族史的PKD患者约占60%,而散发患者约占40%。PKD为常染色体显性伴不完全显性的方式遗传。大量研究报道,PKD/BFIS最常见的致病基因是PRRT2(Proline-Rich Transmembrane Protein 2;OMIM*614386)[5-7]。中国PKD家系及韩国、日本和欧洲的PKD家系的致病基因也主要是PRRT2基因,占家族性PKD致病基因的80%~90%。同时,33%~46%的散发性PKD患者中也检测到PRRT2突变[8],其中突变c.649dupC (p.R217PfsX8)是PRRT2 基因的热点突变,约占总突变的93.75%[9]。该突变在不同人种之间的分布频率没有差异,散发性PKD患者中新发突变也占一定的比例。
由于PKD具有短暂性、发作性的特点,临床诊断中经常被误诊为癫痫,因此,在临床诊断中对PKD致病基因的鉴定有利于提高诊断率,防止误诊[10]。本研究将从散发性和家族性PKD病例中鉴定PRRT2基因突变,旨在为PKD的临床诊断提供理论依据。
1 材料方法
1.1 仪器和试剂
1)仪器。PCR仪(美国ABI life2720);超微量紫外分光光度仪(Thermo Nan-odrop 2000c)。
2)试剂。PCR试剂(武汉擎科创新生物科技有限公司);DNA提取试剂盒(Promega公司);电泳试剂实验室自配:琼脂糖(Agarose,产品编号:10208ES60,产地:YEASEN),1×TAE缓冲溶液, 6×loading 缓冲溶液,溴化乙锭(10 mg/mL)。
1.2 病例收集
本研究收集了13个散发性PKD患者,其中3例患者在2岁之前表现为BFIS,即BFIS合并PKD,其余10例为PKD表型的患者。另外,本研究还收集到1个三代PKD家系,符合常染色体显性遗传模式,先证者9岁发病,以反复的投掷样、舞蹈样肌阵挛发作为。PKD患者临床特征及PRRT2基因突变分析结果见表1。研究符合伦理学标准并通过了黄石市中心医院的伦理学委员会审核和批准。患者或患者监护人签署了知情同意书。

表1 PKD患者临床特征及PRRT2基因突变分析结果
1.3 外周血采集、DNA提取及浓度和纯度测定
签订知情同意书后,用EDTA抗凝管采集血样5 mL,参考Promega公司DNA提取试剂盒内操作步骤进行提取[11]。通过超微量紫外分光光度仪测到DNA浓度为400~1 000 ng/μL,纯度(A260/A280)为1.83~1.87,PKD患者/家系成员外周血基因组DNA浓度和纯度见表2。

表2 PKD患者/家系成员外周血基因组DNA浓度和纯度
1.4 PRRT2基因的引物设计
通过Ensembl数据库(http://asia.ensembl.org/index.html)查询基因序列,发现一共有4个外显子(exons)(转录本ID:ENST00000358758.12),编码序列从第2个外显子开始,而且第2个外显子序列较长,设计2对扩增引物,第3、第4个外显子序列较短,共设计1对引物,因此只需设计3对引物就可以完成对3个外显子及其侧翼序列的测序验证,用于Sanger测序进行PRRT2基因突变分析的引物序列见表3。引物设计原则及注意事项参见《分子生物学常用实验技术》,使用Oligo 7进行引物设计,对设计好的引物通过e-PCR(https://www.ncbi.nlm.nih.gov/tools/epcr/)进行验证,检测引物的特异性及可行性。引物的合成订购自武汉擎科创新生物科技有限公司。

表3 用于Sanger测序进行PRRT2基因突变分析的引物序列
1.5 聚合酶链反应扩增目的条带
以患者DNA为模板,按实验室常规操作进行PCR扩增。PCR体系为标准的40 μL反应体系,详见2×Taq PCR Mix说明书。PCR反应条件为常规反应条件,不同引物的退火温度见表3,产物延长的时间为1 000 bp/min。
1.6 PCR产物的突变分析
PCR产物经琼脂糖凝胶电泳检测为单一条带后,送武汉擎科创新生物科技有限公司进行Sanger测序。
2 结果与讨论
PRRT2是鉴定到的PKD和BFIS的第1个致病基因,也是主要的致病基因[5-7]。在13个散发性PKD患者中鉴定到5个PRRT2突变,其中4个突变文献已报道和PKD表型相关联。在1号和12号散发性PKD/BFIS患者中鉴定到的PRRT2基因的重复突变c.621dupA/p.Ser208Ilefs*17和c.649dupC/p.Arg217Profs*8分别如图1和图2所示,这2个重复突变导致密码子序列发生位移,产生相同氨基酸序列的截短蛋白,因此也属于移码突变[12]。
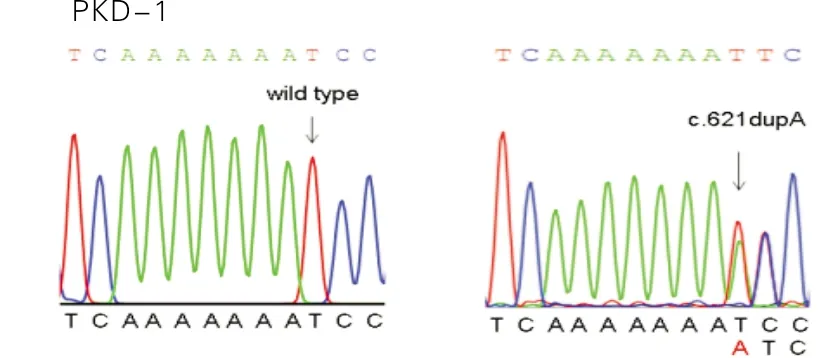
图1 在1号散发性PKD/BFIS患者中鉴定到的PRRT2基因的重复突变c.621dupA/p.Ser208Ilefs*17

图2 在12号散发性PKD/BFIS患者中鉴定到的PRRT2基因的重复突变c.649dupC/p.Arg217Profs*8
文献报道,超过90%的携带PRRT2突变的患者有c.649dupC突变,而且该突变也导致热性惊厥(Febrile Seizures,FS)、BFIS和无热性部分发作(afebrile focal seizures)等癫痫表型,因此,它是PRRT2基因的突变热点[9]。c.621dupA目前只在1个PKD合并BFIS的中国家系中鉴定到[13]。在3号和6号散发性PKD患者中鉴定到的PRRT2基因的错义突变c.796C>T/p.Arg266Trp和c.913G>A/p.Gly305Arg分别如图3和图4所示,其中c.796C>T/p.Arg266Trp是纯合突变,c.913G>A/p.Gly305Arg是杂合突变,这2个突变已见报道和PKD相关联[11],而且Labate等[14]研究发现PRRT2纯合突变的表型比较严重,包括精神发育迟滞、共济失调、智力障碍、癫痫。

图3 在3号散发性PKD患者中鉴定到的PRRT2基因的错义突变c.796C>T/p.Arg266Trp
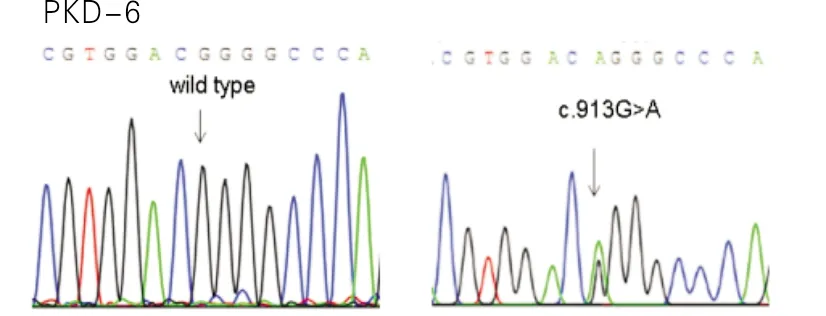
图4 在6号散发性PKD患者中鉴定到的PRRT2基因的错义突变c.913G>A/p.Gly305Arg
在10号散发性PKD/BFIS患者中鉴定到的PRRT2基因的杂合错义突变c.430C>G/p.Pro144Ala如图5所示,该突变在ExAc(外显子组整合数据库)和1000 Genomes Project数据库中记录为SNP(rs150501365),最小等位基因频率MAF值小于0.01,该突变目前没有见报道。

图5 在10号散发性PKD/BFIS患者中鉴定到的PRRT2基因的杂合错义突变c.430C>G/p.Pro144Ala
另外,在1个家族性PKD家系中鉴定到的1个新的PRRT2插入突变c.984insATC如图6所示。


图6 在1个家族性PKD家系中鉴定到的1个新的PRRT2插入突变c.984insATC
PRRT2的插入突变c.984insATC突变导致PRRT2蛋白的C端跨膜结构域在第329位增加一个异亮氨酸,即p.Ile329_Ala330insIle,该突变在ExAc或1000 Genomes Project数据库中都没有记录。因此,新鉴定到的2个突变c.430C>G和c.984insATC与表型的关系还需进一步功能验证。
3 结论
通过Sanger测序在13例散发性PKD病例中鉴定到5个PRRT2突变,其中包括2个重复突变和3个错义突变,包括热点突变c.649dupC。突变检测率为38.5%,和文献报道的33%~46%的散发性PKD患者检测到PRRT2突变的结果相一致[8]。另外,在一个家族性PKD家系中鉴定到一个PRRT2基因的新发突变c.984insATC。由于PKD具有短暂性、发作性和癫痫发作相似等特点,临床诊断中经常被误诊为癫痫[1]。因此,对家族性或散发性PKD患者进行PRRT2基因的突变分析有很重要的临床诊断意义。

