成年人无导线起搏的短期临床疗效观察
李 丽,韩学斌,安 健,高兵兵,李天亮,杜 惠
传统起搏器通过静脉系统植入单根或多根导线夺获心肌组织或传导系统,需要制作囊袋容纳脉冲发生器。约12.5%的病人因术后出现囊袋感染、导线磨损或脱位、气胸、血肿、影响美观等问题,生活质量下降,无导线起搏器因可避免上述问题[1],越来越受到临床关注。无导线起搏已经国外大样本、多中心临床数据证实其有效性及安全性[2]。本研究分析6例成年病人植入无导线起搏(Micra VR, MC1VR01,美国美敦力公司)的安全性及有效性。
1 资料与方法
1.1 研究对象 选取2019年12月—2020年5月在山西省心血管病医院行无导线起搏器植入的病人。纳入标准:符合2018年美国心脏病学学会(American College of Cardiology,ACC)/美国心脏协会 (American Heart Association,AHA)/美国心律学会 (Heart Rhythm Society,HRS)有单腔起搏器植入适应证的Ⅰ类或Ⅱ类病人[3];预计起搏比例较低的间歇高度房室传导阻滞或偶发心室停搏的病人,预计起搏比例<40%;特殊人群,包括有特殊要求,曾发生囊袋反复感染,传统起搏器经静脉入路受限的病人[4]。排除标准:预期寿命小于1年;腔静脉滤网植入或机械三尖瓣;股静脉狭窄或血栓形成者。本研究已经医院伦理委员会批准,术前均签署手术知情同意书。入选符合条件病人6例,年龄(65.18±11.44)岁,男3例,女3例;其中间歇性房室传导阻滞(AVB)2例,病态窦房结综合征(SSS)2例,心房颤动(AF)合并长RR间期2例。
1.2 手术操作步骤 常规备用大C血管造影机(飞利浦),基础镇静麻醉,术前导尿,传统起搏器作为备选方案,圈套器备用。常规贴除颤电极片,完善体表12 导联心电图、指脉氧饱和度及动脉压监测。常规消毒双侧颈胸部及双侧腹股沟区,铺无菌巾。手术时间为从穿刺血管开始至起搏器植入完成撤去鞘管,包扎伤口的时间。
具体手术操作步骤。股静脉穿刺,右侧留置8F股动鞘管,左侧植入临时起搏器备用,经鞘管给予普通肝素2 500~3 000 U。经右侧股静脉鞘管送入0.035J型超硬导丝至右心房中部,依次换鞘,11F-14F-18F-27F。移除导丝和内芯,备60 mL注射器回抽,鞘管排气,加压肝素盐水持续冲洗外鞘。MicraVR由递送系统经鞘管送至右心房中部,尾部接三联三通(一端接加压肝素盐水持续冲洗递送系统,另一端接造影剂备用)。鞘管回退至下腔静脉,递送系统逐步跨过三尖瓣,将MicraVR送至右间隔部,顺时针旋转递送系统,X线下不同角度注射造影剂,证实递送系统与心室间隔贴靠良好,栓绳解锁,同时加压肝素盐水持续冲洗杯槽。轻推送递送系统待出现“鹅颈征”,按下解锁按钮,快速释放1/2,边回撤递送系统边缓慢释放后1/2至完全释放MicraVR。测试电学参数满意后,行牵拉试验,同时观察影像,确保至少2~3个翼状结构固定在心肌内,再次测定电学参数达标,R波>5 mV,阻抗500~1 500 Ω,阈值<0.88 V/0.24 ms;试探栓绳的阻力,剪断阻力大的一端,影像观察下回撤栓绳直至完全拉出递送系统。若电学参数不满意,无阻力下回撤MicraVR至槽杯内,上锁,重新定位,满意后再次释放。结束手术,移出递送系统及鞘管,局部伤口双荷包缝合,纱布加压包扎,评估病人生命体征平稳后,安返病房。
1.3 随访 术后1周、1个月、3个月、6个月行起搏器程控检查;术后1个月、6个月行胸片、经胸心脏超声心动图(Philips IE33)检查。程控仪为美敦力2090。

2 结 果
2.1 病人临床情况(见表1)

表1 病人临床资料
2.2 手术情况 6例病人均成功植入MicraVR,手术时间(70±22)min,X线曝光量(68.17±22.59)mGy;除1例病人术中MicraVR回收3次,第4次释放成功,余病人均一次释放到位(见表1)。图1A为右前斜30°(RAO)造影剂证实Micra紧贴间隔,出现类似“鹅颈征”;图1B示递送系统释放MicraVR后行牵拉试验,可见3个小翼固定牢靠;图1C、图1D、图1E分别示正位(AP)、RAO30°、左前斜(LAO)40°MicraVR的位置。术中感知(10.10±2.30)mV,阈值(0.55±0.19)V/0.24 ms,阻抗(948±68)Ω。术后1例病人右侧股静脉穿刺点拆线后伤口愈合不佳,经二次局部清创后愈合良好,术后无动静脉瘘、感染、栓塞、心功能不全、心包填塞等不良事件。

图1 数字剪影血管造影术(DSA)透视下 MicraVR植入过程
2.3 随访结果 术中1例反复回收后释放,术后3 d阈值升至2 V/0.24 ms,于1个月随访时为1.25 V/0.24 ms,术后6个月随访降至0.5 V/0.24 ms。电学参数详见图2。术后6个月与术中比较:感知差异无统计学意义[(12.05±2.50)mV/0.24 ms与(10.1±2.3)mV/0.24 ms,P=0.275];阈值差异无统计学意义[(0.55±0.19)V与(0.55±0.11)V,P=0.49]。详见图3。阻抗差异无统计学意义[(948±68)Ω与(635±86)Ω,P=0.29],随植入时间延长,阻抗呈下降趋势。详见图4。术后起搏QRS波时限(131±3)ms,比基线QRS波轻度增宽,但均小于<140 ms,且体表心电图提示下壁导联Ⅱ、Ⅲ、AVF呈R型,符合中高位间隔位置表现(见图5、图6)。
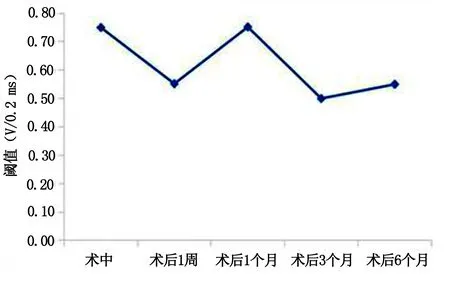
图2 电学阈值参数

图3 电学感知参数

图4 电学阻抗参数
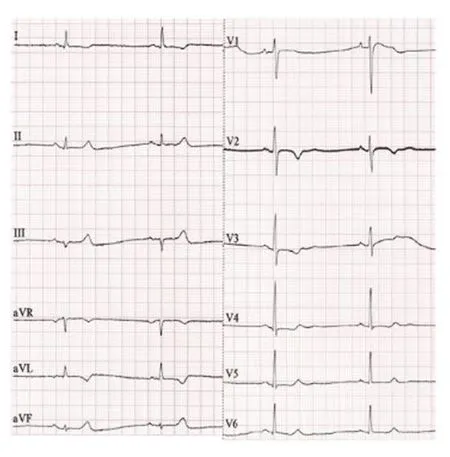
图5 窦性心律心电图
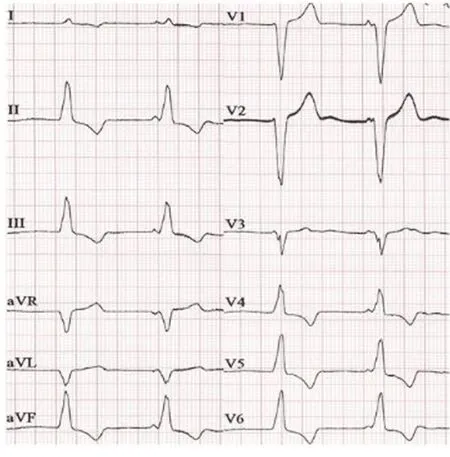
图6 起搏心律心电图
术后1个月行经胸心脏超声心动图检查(见图7),选取不同角度观察MicraVR的位置。胸骨旁四腔心切面,测定Micra嵌入心肌的附着点距离三尖瓣环(3.19±1.09)cm,距离心尖(3.89±1.19)cm;心底大动脉短轴右室流出道切面,Micra悬空至心腔内(1.43±0.23)cm。术后6个月随访时,心室起搏比例达(35.60±7.23)%,左室射血分数(LVEF)术后6个月为(58.00±5.29)%、术后1个月为(58.80±5.22)%,与术前(62.01±11.34)%比较有所降低,但差异无统计学意义。

图7 术后1个月经胸超声心动图
3 讨 论
MicraVR是一款单腔心室起搏器,体积0.8 cm3,长度25.9 mm,外径6.7 mm,重量2.0 g。通过4个自膨胀镍钛叉,锚定于右心室间隔部,具有1.5T和3.0T全身MRI兼容,其通过内置三轴加速感应器,达到频率应答的功能,同时具有心室自动阈值管理功能,可延长使用年限。传统起搏器有囊袋感染、破溃、血肿、导线磨损断裂及可能损伤三尖瓣瓣叶等并发症,且多次植入多根导线,可引起锁骨下静脉或腋静脉闭塞,如更换需再次植入,入路受限;对于需植入起搏器的患儿,导线随身体发育增长的问题尚不能解决。无导线起搏器可避免上述因素,其优势日益突显。国内小样本研究提示在传统起搏装置感染移除术后,择期植入无导线起搏器是安全、可行的[5]。我中心自2019年12月首次植入MicraVR以来,共成功植入6例,男3例,女3例,有5例为一次释放成功,有1例病人术中心室阈值0.88 V/0.24 ms,术后第3天阈值逐渐升高,最高至2 V/0.24 ms才能持续夺获心肌组织,术后1个月随访时,降至1.25 V/0.24 ms,考虑与术中反复回收(回收3次)有关,心肌急性损伤或MicraVR杯槽内有残余心肌组织影响阈值测定,也可能与病人合并有陈旧心肌梗死,MicraVR嵌入部位心肌瘢痕纤维化有关。术后起搏心电图提示下壁导联Ⅱ、Ⅲ、AVF呈R型,结合经胸超声心动图四腔心切面,Micra位于中高位间隔,与李巧元等[6]报道类似。本研究发现心底短轴切面Micra悬空至心腔内(1.43±0.23)cm。6个月随访过程中,感知、阈值、阻抗等指标均达到临床满意。随着术后随访时间延长,阻抗呈下降趋势,与其他学者[2,7]报道类似。Micra经股静脉入路,需经27F的输送鞘管送入右室间隔部,初步植入过程中,有1例病人穿刺处拆线后愈合不佳,局部二次清创后愈合良好,未引起病人局部或全身感染。术中采用双压力包加压肝素盐水,一端持续冲洗外鞘,一端持续冲洗Micra杯槽,把造影剂或微栓子等影响电学参数的因素减至最低。
MicraVR起搏器安全性高,并发症低,一项纳入725例前瞻性、多中心、非随机MicraVR研究发现,植入成功率高达99.2%,有1例因起搏器外因素死亡,术后1年的并发症发生率为4%,低于导线起搏器[8]。MicraAV通过感知心脏机械活动时产生的加速度信号,较好地实现了房室同步,已在临床上逐步应用[9],进一步拓展了无导线起搏器植入的适应证。术后经胸心脏超声左室射血分数与术前相比差异无统计学意义,其长期工作对心功能的影响还需大样本数据及长时间临床观察证实。
本研究中6例病人均未见起搏器位移、心肌穿孔、心包填塞、栓塞事件、动静脉瘘、感染等不良事件,短时间随访心功能尚可,无起搏失夺获发生,初步证实其安全有效,但限于样本例数小,随访时间短,有待后续纳入更多样本量,长期随访研究证实。

