益肾逐瘀法对帕金森病病人脑白质超微结构的影响
陈宇航,刘 岑,袁永娥,于艳敏,张 华
帕金森病(Parkinson′s disease,PD)是一种复杂的神经系统变性疾病,一般具有运动迟缓、静止性震颤和肌强直等典型帕金森运动特征,多数病人伴有抑郁、睡眠障碍、认知功能下降等非运动症状[1]。其主要病理机制是黑质中多巴胺能神经元退变,导致纹状体内多巴胺含量降低,进而引发各种帕金森症状[2-3]。PD病人除了中脑黑质、纹状体等脑灰质结构受损以外,其脑功能网络也存在异常[4],还有试验结果提示脑白质也有部分受累[5]。Duncan等[6]发现早期PD病人扣带束、下纵束、上纵束、下枕骨束存在轴突损伤,Lenfeldt等[7]研究证实额叶白质的损伤与PD的步态障碍存在相关性,提示PD的脑白质结构改变很可能与其临床症状相关,但目前PD病人脑白质的改变机制仍未完全明了。
目前,在PD白质病变的研究上最常使用的是磁共振成像技术,其中,磁共振弥散张量成像技术(diffusion tensor imaging, DTI)可用于脑白质纤维的微观结构研究。其原理是利用水分子的弥散各向异性进行成像,可实现在活体上无损地观察脑白质纤维结构的完整性和连通性,构建脑白质内神经传导束的三维模型,实现对中枢神经纤维的微观成像,还可以对引起脑白质改变的各种疾病在超微结构层次进行损害评价。它已经广泛用于评估脑白质在不同时期的变化以及脑白质与认知功能的关系[8]。本研究使用DTI的量化参数为部分各向异性指数(fractional anisotropy, FA),指弥散的各向异性部分与弥散张量总值的比值,取值在0~1,FA值的大小与髓鞘的完整性、纤维的致密性及平行性呈正相关[9],在评估脑白质超微结构上有着其他技术手段无可比拟的优势。
目前,PD的治疗以左旋多巴制剂(美多芭)、多巴胺受体激动剂等西药为主,但随着用药时间的延长,药效容易减退,甚至可能出现异动症等副作用,还可能加重病人非运动症状[10-11],需联合用药维持治疗。而中药在治疗各种急慢性疾病具有调节整体、疗效持续时间长、副作用少等优点,不少尝试中药治疗帕金森病的病人也取得一定的治疗效果。有研究发现,在服用西药的同时使用中药辅助治疗,能很好地改善帕金森病病人的临床症状,降低服用西药的不良反应,提高生活质量[12-13]。
北京中医药大学东直门医院脑病科团队在长期的临床治疗中,不断总结治疗PD的用药、用方经验,发现PD病人多见肾虚血瘀证,因此,提出治疗PD病人当以益肾逐瘀法为核心治法,方用培元解痉汤加减。本试验以益肾逐瘀为治法治疗肾虚血瘀型PD病人,使用DTI技术对PD病人脑白质结构进行分析,并探讨益肾逐瘀法对于PD病人脑白质超微结构的改变。
1 资料与方法
1.1 一般资料 纳入2014年12月—2016年1月于北京中医药大学东直门医院脑病科门诊就诊的帕金森病病人9例为PD组,其中男1例,女8例,年龄(65.2±9.2)岁。同时在社区招募并纳入与病人性别、年龄匹配的健康志愿者9例为正常对照(healthy control, HC)组,男1例,女8例,年龄(65.3±7.6)岁。本研究经北京中医药大学东直门医院医学伦理委员会批准,受试者均已签署知情同意书。经爱丁堡利手量表中文版评估,所有受试者均为右利手。5例未曾服用任何治疗PD的西药,4例入组前已经采用原发性PD相关西药治疗(如美多芭、森福罗、息宁等),入组后不增加用药种类和剂量,并依据《中国帕金森病治疗指南》(第2版)[14]减少不合理用药。
1.2 诊断标准 西医诊断标准参照英国脑库原发性帕金森病临床诊断标准[15];中医诊断标准参照《中医老年颤证诊断和疗效评定标准》[16]。
1.3 纳入标准 ①年龄35~85岁;②符合西医帕金森病诊断标准;③符合中医颤证诊断标准,辨证属肾虚血瘀证型,且中医证候量化分级表评分≥6分[17]; ④如已服用多巴类神经递质及其协同作用的西药,于检查前停用至少12 h;⑤体内不含影响磁共振检查的金属异物。
1.4 排除标准 ①患有心、肺、肝、肾脏以及造血系统、内分泌系统等严重疾病;②患有严重精神类疾病,或幽闭空间恐惧症等不能配合磁扫描检查;③合并类风湿性关节炎、强直性脊柱炎等导致关节畸形不便判断疗效;④苍白球损毁术或脑深部电刺激术后不便判断疗效;⑤存在影响磁扫描的其他因素。
1.5 治疗方案 以益肾逐瘀法为治则,方用培元解痉汤,根据中医辨证论治的特点,在治疗中出现阶段性兼夹症状或其他标实证候时,及时予以加减用药;发生证候转变时,则结束治疗及观察。培元解痉汤组方:熟地黄30 g,制首乌15 g,醋龟甲30 g(先煎),怀牛膝15 g,肉苁蓉15 g,鹿茸粉1 g(冲服),当归 15 g,全蝎6 g,地龙6 g,水蛭粉 6 g(冲服),白芍15 g,天冬 10 g,茯苓 10 g,炒白术10 g,炙甘草10 g。每日1剂,水煎约300 mL,分早晚2次服用,疗程4周。所有PD组病人均服用中药治疗。
1.6 量表信息采集 使用统一帕金森病评定量表第3版(Unified Parkinson′s Disease Rating Scale 3, UPDRS 3)对PD组病人精神、行为和情感、日常生活、运动检查、药物治疗并发症4大项进行综合评估。帕金森中医证候量化分级表对包括运动症状及非运动症状进行评价,并采用简易智力状态检查量表(Mini-mental State Examination,MMSE)对认知能力进行评估。PD组在治疗前、治疗4周后分别进行测评。
1.7 结构磁共振成像(SMRI)及DTI扫描方法 提前与受试者确定检查时间,服用西药治疗的PD受试者检查前停药12 h以上。磁共振检查采用德国西门子Verio 3.0 T超导型磁共振全身成像仪。DTI扫描序列及参数:结构像采用磁化准备快速梯度回波序列(T1-MPR),参数:重复时间(TR):1 900 ms,回波时间(TE):2.52 ms,体素: 1.00 mm×1.00 mm×1.00 mm,层厚1.00 mm,扫描层数176。DTI扫描参数:在30个方向上施加弥散梯度,EPI序列,b值=0, 1 000 s/mm2, slice thickness:2 mm, gaP=0 mm, slices=65, TR:11 000 ms, TE:94 ms, Matrix=128×128, FOV:256×256, Voxel size: 2×2×2, Phase encode direction: A>P。PD组于治疗前、治疗4周后各扫描1次,HC组扫描1次。
1.8 磁数据处理 使用dcm2niix将T1和DTI原始数据DICOM格式转化为NIFTI格式,应用ART软件包的acpc-detect命令将T1像转化为AC-PC(前联合和后联合)对齐空间,应用斯坦福大学的VistaSoft软件包对DTI文件进行预处理,包括头动及涡流矫正,与T1像对其到AC-PC空间,并计算弥散张量,基于弥散张量配准和皮层分割的自动纤维束量化追踪技术(automatic fiber quantification, AFQ)[18],以及约束球面反卷积法(constrained spherical deconvolution,CSD),将全脑白质分成20个主要纤维束,自起始至终端将每条纤维束等分 100段(每段划分为一个位点),并计算各位点垂直截面FA均值,最终生成具有100个离散位点FA的纤维束走行线图。
1.9 统计学处理 对于量表数据:使用MATLAB分别对PD组治疗前后UPDRS3 、中医证候量化分级表、MMSE评分结果进行分析,对差值符合正态分布资料使用配对样本t检验,不符合资料使用秩和检验。对于核磁数据:使用MATLAB分别对PD组治疗前与HC组、PD组治疗后与治疗前FA值差值进行正态分布验证,对符合正态分布资料分别使用独立样本t检验或配对样本t检验,不符合者使用秩和检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 病例完成情况 本研究纳入 PD 病人9例,完成治疗观察7例,脱落2例,其中1例移居失访,1例病情较重,来院不便,要求退出,脱落原因均与疗效评价无关。
2.2 疗效评价 通过对UPDRS 3评分、中医证候量化评分以及MMSE评分进行配对t检验或秩和检验。PD组UPDRS 3评分(t=-0.187,P=0.858)和MMSE评分(t=0.548,P=0.604)治疗前后比较差异无统计学意义;中医证候量化总评分治疗前后比较差异有统计学意义(t=2.642,P=0.038),其中,治疗前后运动症状比较差异无统计学意义(P=0.180),非运动症状部分较治疗前有所改善,且差异有统计学意义(P=0.024)。详见表1。
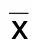
表1 PD组治疗前后UPDRS 3、中医证候量化、MMSE评分比较 (±s,n=7) 单位:分
2.3 FA值差异位点 经数据统计分析发现,PD组治疗前左侧扣带束、右侧下纵束、右侧钩束部分节段与HC组相比FA值明显下降,筛选出具有统计学意义的位点,位点具有连续性。详见表2。PD组左侧、右侧皮质脊髓束均存在部分节段FA值较HC组明显上升。各纤维束FA值及位点示意图见图1~图6。

图1 各纤维束位置

表2 PD组治疗前与HC组差异位点分布

图2 左侧扣带束FA值及差异位点

图3 右侧下纵束FA值及差异位点

图4 右侧钩束

图5 左侧皮质脊髓束

图6 右侧皮质脊髓束
比较PD组治疗前后的FA值,发现有显著差异的位点为左侧扣带束的4个位点(n分别是92,93,94,95),其FA值较基线明显升高,且位点具有连续性(见表3),差异具有统计学意义(P<0.05)。该纤维束治疗前后FA值及位点示意图见图7~图8。
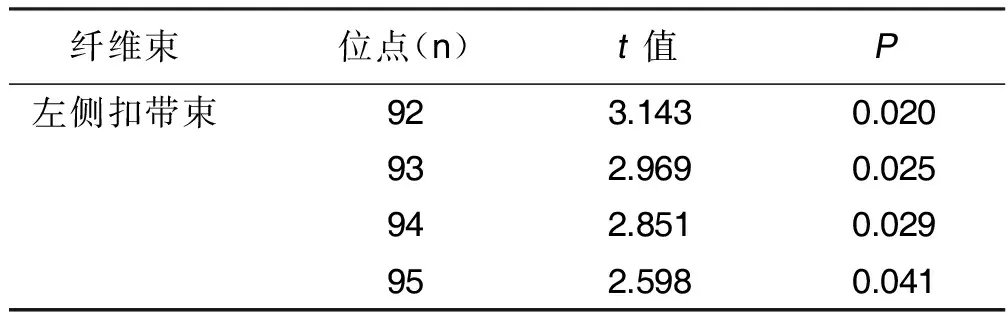
表3 PD组治疗前后差异位点分布

图7 治疗前左侧扣带束

图8 治疗前后左侧扣带束
3 讨 论
比较PD组治疗前后PD的相关量表,发现UPDRS3评分及MMSE评分均未能得到显著性差异结果;而在中医证候量化评分表中,运动症状部分在治疗前后无明显变化,而非运动症状部分较治疗前有显著改善,提示益肾逐瘀法对于PD病人的治疗作用可能主要体现在非运动症状上,而运动症状未能改善可能与样本量较少且疗程较短有关,故未能在量表结果上得到体现。PD组治疗前与HC组对比分析结果显示,在PD病人的双侧皮质脊髓束FA值明显高于HC组,而包括扣带束、下纵束、钩束在内的其他组织FA值明显低于HC组,以往有学者研究发现皮质脊髓束这一独特差异[19]。Arkadir等[20]研究认为,FA值的增高可能与PD病人轴突密度代偿性增多相关,皮质脊髓束的改变可能是丘脑和纹状体输入减少的代偿机制,或是选择性的神经退化——增高的FA值应该是“苍白球-丘脑”活动性改变的结果[21]。
结合PD组治疗前与HC组、PD治疗后与PD组治疗前的分析结果,可以发现帕金森病人在左侧扣带束92-95位点的FA值较正常组下降,而经治疗后其FA值较治疗前升高,实现了FA值的逆转。此前一些学者通过DTI技术发现PD病人的脑白质中扣带回纤维结构存在损伤,这与病人认知功能下降存在一定的相关性[22]。扣带束是边缘系统最重要的白质纤维,是连接海马与扣带回的通路,在大脑情景记忆、执行能力和情感中具有重要作用,与认知功能存在关联[23]。扣带回亦是边缘系统的重要组成部分,分为前部和后部,前部参与许多复杂的躯体和内脏运动功能和痛反应,而后部主要监控感觉、立体定位及记忆[24]。Raichle等[25]在对大脑静息状态的研究中发现包括扣带回前部、扣带回后部在内的多个脑区BOLD信号具有较高的时间相关性,由此提出了默认模式网络(default-mode network, DMN)的概念。DMN直接影响着人们的心理活动、认知功能,其主要负责大脑对内外环境的监测、情绪的加工、自我内省、维持意识的觉知、情景记忆的提取等功能[26-27]。He等[28-29]证实阿尔兹海默病病人脑内DMN脑区之间的功能连接度下降,且功能连接度的下降程度与病情发展呈正相关。本研究对所有纤维束的位点进行筛选,得到存在明显治疗效应的4个位点(n92、n93、n94、n95),其位置连续,构成部分纤维节段,位于左侧扣带束前部,该部位参与构成了边缘系统,在默认模式网络的信息传递中发挥重要作用。在治疗前,PD病人在该节段的FA值明显低于HC组,提示脑白质结构受损,进一步影响DMN各脑区间的信息传递,这很可能是PD病人认知功能下降的重要原因。而治疗后PD病人在同一节段的FA值高于治疗前,说明基于益肾逐瘀法的培元解痉汤可能对脑白质超微结构受损的情况有治疗意义,进而改善病人的认知功能。
PD的运动症状在中医学多属“颤证”范畴,《素问·脉要精微论》曰:“骨者,髓之府,行则振掉,骨将惫矣”,肾主骨生髓,肾精不足,则骨髓空虚,骨失髓养,脑髓不充,下虚则上摇。而认知功能下降是PD的典型非运动症状之一,属中医学“痴呆”范畴,其病位在脑。脑为髓海,元神之府,神机之用,清代王清任《医林改错》提出“ 灵机记性在脑不在心”“小儿无记性者,脑髓未满,高年无记性者,脑髓渐空所致”。髓海空虚,髓减脑消,则灵机失用。肾虚髓空,必兼血瘀。“元气既虚,必不能达于血管,血管无气,必停留而瘀”,元气乃肾精所化,肾精亏虚,则气化无源、温煦无力、血不化生,脉道不充,血行不畅,故而成瘀。反之,脉络瘀阻,血行不畅,津液失布,肾失水谷精微濡养则虚。肾虚导致血瘀,血瘀加重肾虚,二者互结,虚实夹杂,形成恶性循环,病情不断发展,迁延难愈。因此,肾虚血瘀是中医治疗PD的核心病机[30-31]。安畅[32-33]基于肾虚血瘀辨证对PD病人给予中药治疗,发现病人认知功能及日常生活能力有明显改善,进一步说明PD当以肾虚血瘀为辨证核心,并拟定了培元解痉汤为主方进行治疗。方中熟地黄为君,其味甘滋润,主入肝肾经,重用以补益肝肾、益精填髓。制首乌、醋龟甲、怀牛膝滋补肾阴、强筋健骨,肉苁蓉、鹿茸粉壮肾中之阳,诸药同用,阴阳双补,共奏益肾填精之功;当归养血活血行瘀,全蝎、地龙、水蛭粉均为虫类药,性善走窜,逐瘀力较强,共用以通经行络、舒筋活血,恢复玄府开阖之功。以上诸药共为臣药,补肾益髓与活血化瘀并行,再佐以白芍、甘草酸甘敛阴并养血,茯苓、白术健脾益气、防滋腻太过生湿化痰,白芍、天冬生阴津、降虚火。怀牛膝亦可引药下行,炙甘草调和诸药,共为使药。方中醋龟甲、鹿茸粉属“血肉有情之品”“栽培身内之精血”,其滋补之力更甚草木金石之类。本方诸药相配伍,补益而不滋腻,逐瘀而不伤血,同时通窍活络,开通玄府,共行益肾逐瘀之效。肾精充盈,血瘀得化,则血脉运行通畅,津液输布不达,故经脉、骨得所养,脑髓得充,玄府开阖,神机得用。
分析本研究中实现FA值逆转、脑白质微观结构重组的原因,考虑可能是改变了小胶质细胞周围的血液微环境,抑制了小胶质细胞的活化,减少了对于神经元结构的损坏,甚至实现髓鞘结构修复,这种微观结构上的改变从中医学“玄府”角度进行阐释。“玄府”最早见于《黄帝内经》,意指腠理,即汗孔,金代刘完素在《素问·玄机原病式》中扩展了玄府的概念,认为玄府应为遍布全身的微细结构,是“气出入升降之道路门户”。常富业等[34]认为玄府的升降出入是神机运转的基本保证,进一步提出玄府为神机运转的道路门户,其范畴与西医的认知功能相近。脑为诸阳之会,十二经脉之气血皆汇聚于脑,因此,脑中玄府丰富,更有学者提出神机统于脑,脑髓是神机生发之所,依赖气血津液精髓充养,气血津液精髓是神机运转的物质基础,并参与脑髓神机对生命活动的调控[35]。若玄府开阖通利障碍,则神机运转失常,脑髓失养,表现为运动及非运动功能障碍。培元解痉汤以益肾逐瘀为治法核心,兼有通络开窍之用,恢复玄府开阖之功,使脑部气机升降出入顺畅,脑组织代谢正常运转,从而对帕金森病的非运动症状,尤其是认知功能进行改善。其作用机制可能为改变小胶质细胞周围的血液微环境,抑制了细胞的活化,减少神经元损坏,甚至实现髓鞘修复,但这种微观结构性的改变,未能在MMSE评分上得到统计学数据支持,考虑与本研究样本量较少、治疗时间短、治疗后差异位点数量较少相关,且MMSE评分评价较为粗糙,只能初步评价病人的认知能力,因而未能得到证据支持。
今后在进行相关试验设计时,需要选择更细化的量表进行评价,适当扩大样本量,延长治疗时间,进行疾病程度相关的分级研究,对试验结论进一步验证。

