基于网络药理学探讨西洋参-丹参治疗冠心病的作用机制
林 泉,徐凤芹,马晓娟,王 哲,李丹丹,殷惠军
冠状动脉粥样硬化性心脏病(coronary heart disease,CHD)是指由于冠状动脉粥样硬化使管腔狭窄、痉挛或阻塞导致心肌缺血、缺氧或坏死而引发的心脏疾病,简称冠心病[1]。《中国心血管健康与疾病报告2019》指出,中国冠心病现患人数约1 100万人,2017年城市居民冠心病死亡率为115.32/10 万,农村居民冠心病死亡率为122.04/10万,冠心病患病率及死亡率仍处于上升阶段[2]。冠心病发病率和死亡率高,严重危害人类健康,已成为重大公共卫生问题。
冠心病属于中医学“胸痹”“真心痛”范畴,传统治疗以益气活血为主,认为气虚血瘀是冠心病中医病机关键[3-5],是其根本的病理改变,取得了良好疗效[6-9]。心主血脉,血不能自行, 必须靠气的推动,才能在脉管中运行不止, 环周不休。《血证论》曰:“运血者即是气”,王冰注《素问·五脏生成篇》亦曰:“气行血乃流”。心气不足, 则运血无力,血停成瘀,《医林改错》中曰:“元气即虚, 必不能达于血管, 血管无气, 必停留而瘀”。瘀血一旦形成, 必然影响脉道的通利,临床往往可以见到心悸、胸闷、气短乏力等症[10]。西洋参-丹参为益气活血的常用药对,其中西洋参甘凉,归心、肺、肾经,能补气养阴、清热生津,丹参苦微寒,归心、肝经,善活血祛瘀、通经止痛,两药常相须为用,活血而不耗气、益气而不壅滞,相得益彰[11]。
现代药理学研究表明西洋参-丹参有效成分可以保护血管内皮功能[12]、抑制炎症反应[13]、抑制斑块形成并增加斑块稳定性[14]、减轻缺血及非缺血心肌组织损伤[15]、改善心肌缺血再灌注[16]等。但以往多是对其某一作用机制进行具体研究,难以获得其作用机制网络的整体面貌。网络药理学能够系统反映药物与疾病间的关联性,阐明药物作用机制,有助于揭示中药复方的科学内涵,发现药物靶标[17]。为此,本研究采用网络药理学方法,从西洋参、丹参的物质基础出发,系统分析其活性成分和作用靶点,建立“成分-靶点-通路-疾病”网络,探讨其调治冠心病的分子机制,同时为后续研究提供理论基础。
1 资料与方法
1.1 药物活性成分和相关靶点的筛选 在中药系统药理学数据库与分析平台(TCMSP,https://tcmspw.com/tcms p.php)分别以“西洋参”“丹参”为关键词进行检索,获得其化学组成成分[18]。限定ADME参数,以口服利用度(oral bioavailability,OB)≥30%和类药性(drug-likeness,DL)≥0.18为标准[19],进行初步筛选,获得两种药物的活性成分,进而检索各活性成分所对应的蛋白质靶点,并根据已发表的文献对未预测到的靶点进行补充。通过Uniport蛋白质数据库(https://www.uniprot.org)标准化蛋白质靶点信息,限定物种为“human(人)”,获取预测靶点相对应的基因名。
1.2 冠心病相关靶点的筛选 以“coronary heart disease”“coronary atherosclerotic heart disease”为关键词,检索GeneCards数据库[20](https://www.genecards.org)、TTD数据库[21](http://bidd.nus.edu.sg/group/cjttd)、OMIM数据库[22](http://www.omim.org)和DRUGBANK数据库[23](https://www.drugbank.ca),获取冠心病相关潜在靶点。在GeneCards数据库中,靶点的Score值越大,代表该靶点与疾病的关系越密切,故以Score值大于中位数为标准对靶点进行筛选;合并4个数据库靶点后,删除重复值得到冠心病靶点。
1.3 药物和疾病共同靶点的筛选 为明确药物作用靶点与冠心病相关靶点间的相互关系,通过R语言筛选西洋参-丹参作用于冠心病的交集靶点,并绘制Venn图。
1.4 成分-靶点网络构建与分析 剔除西洋参-丹参中未能作用于冠心病相关靶点的活性成分后,将能够作用于相关靶点的活性成分与冠心病相关靶点导入CytoScape3.7.0软件,构建成分-靶点网络。通过Network Analyzer插件分析有效成分的网络拓扑参数,包括连接度(degree)、介度(betweenness centrality)及紧密度(closeness centrality)等,筛选发挥药效的关键活性成分。
1.5 蛋白质互作网络(PPI)构建和关键靶点筛选 将药物和疾病共同靶点提交至STRING11.0数据库(https:// string-db.org)构建PPI网络模型[24],限定物种为“Homo sapiens”,最小相互作用阈值设定为“highest confidence(0.900)”,且隐藏网络中断开的节点,其余设置均为默认设置,得到PPI网络,并通过CytoScape3.7.0中“Network Analyzer”插件进一步分析网络拓扑学参数,获取关键靶点。
1.6 靶点通路富集分析及其可视化 将药物和疾病共同靶点导入功能注释生物信息学分析平台(DAVID)数据库[25](https://david.ncifcrf.gov/),进行基因本体(gene ontology,GO)富集分析和京都基因与基因组百科全书(kyotoencyclopedia of genes and genomes,KEGG)富集分析,分析其主要的生物学过程与代谢通路,并将结果上传至OmicShare网站(http://www.omicshare.com/)绘制高级气泡图,进行可视化。
1.7 成分-靶点-通路网络图构建 将富集基因数最多的20条KEGG通路、通路相关靶点和相应的药物活性成分导入CytoScape3.7.0,构建成分-靶点-通路网络图。
2 结 果
2.1 药物活性成分和相关靶点的获取 通过TCMSP检索得到西洋参化学成分153种、丹参化学成分202种,经ADME筛选,并排除未获取作用靶点的化学成分后,共获得西洋参9种、丹参59种活性成分。同时在平台获取西洋参成分作用靶点59个、丹参成分作用靶点136个,合并后删除重复值共得到药物作用靶点153个。
2.2 冠心病相关靶点的获取 检索Genecards、OMIM、TTD、DrugBank4个疾病数据库,分别得到疾病靶点个数为897个、545个、26个、35个,将得到的靶点合并后删除重复值,最终得到1 420个冠心病相关靶点。
2.3 药物和疾病共同靶点的获取 使用R语言将药物作用靶点和冠心病相关靶点进行交集合并,最终得到72个共同靶点,并绘制Venn图(见图1)。
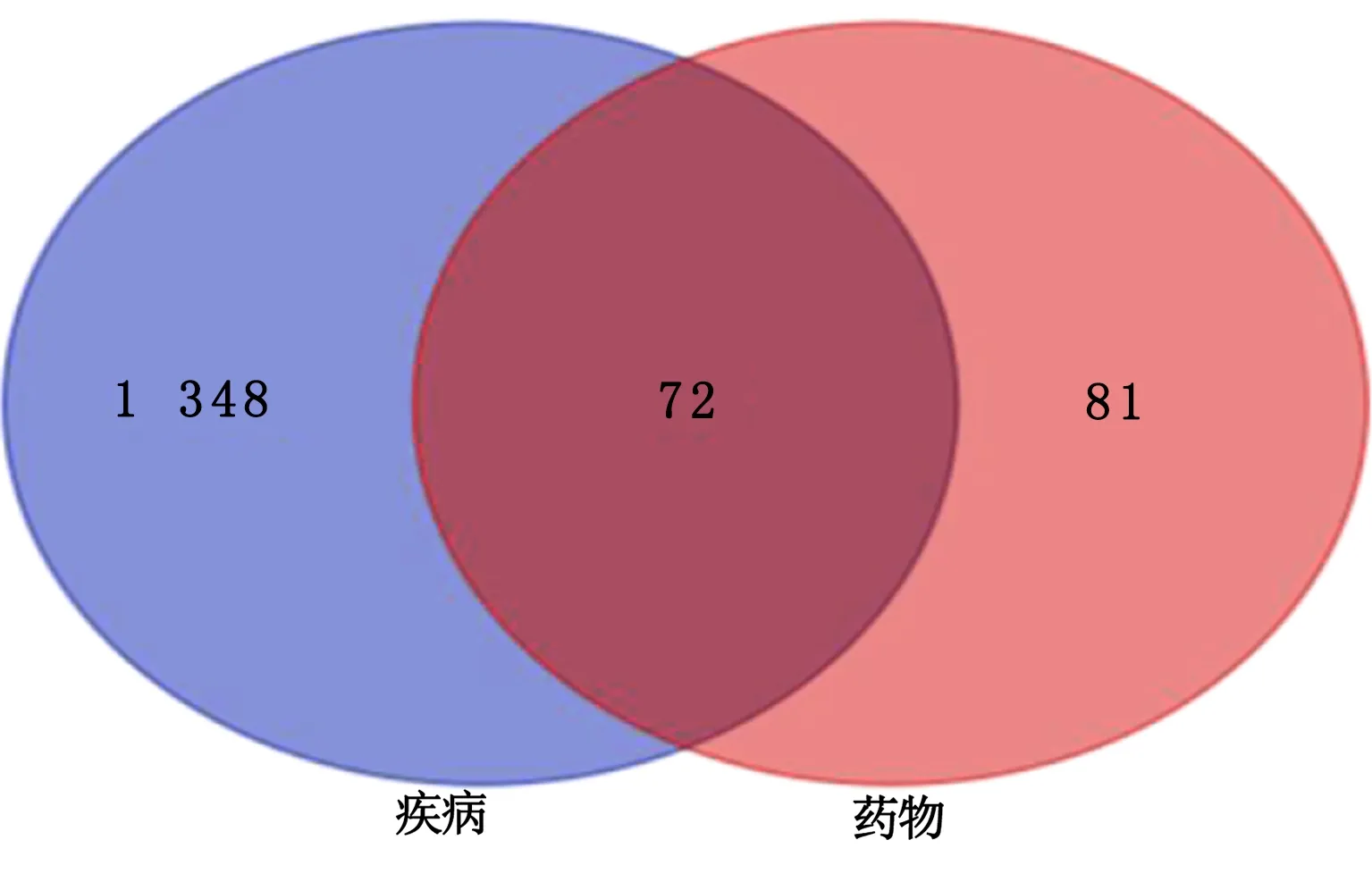
图1 药物作用靶点-疾病靶点Venn图
2.4 成分-靶点网络构建和分析 剔除西洋参-丹参中未能作用于冠心病相关靶点的活性成分后,共获得西洋参6种、丹参57种活性成分(见表1)。将活性成分与冠心病相关靶点导入CytoScape3.7.0软件,构建成分-靶点网络(见图2),共包括节点137个(包含63个活性成分、72个靶点和2个药物)、边425条。对其进行网络拓扑分析,观察Degree值,发现木犀草素作用于34个疾病靶点,丹参酮ⅡA作用于20个疾病靶点,β-谷甾醇、4-亚甲丹参新酮和隐丹参酮等活性成分也调节多个靶点,由此可见,中药治疗疾病多成分、多靶点的特点,同时这些度值较高的化合物可能是西洋参-丹参发挥治疗冠心病作用的关键活性成分(见表2)。

表1 西洋参-丹参候选活性成分
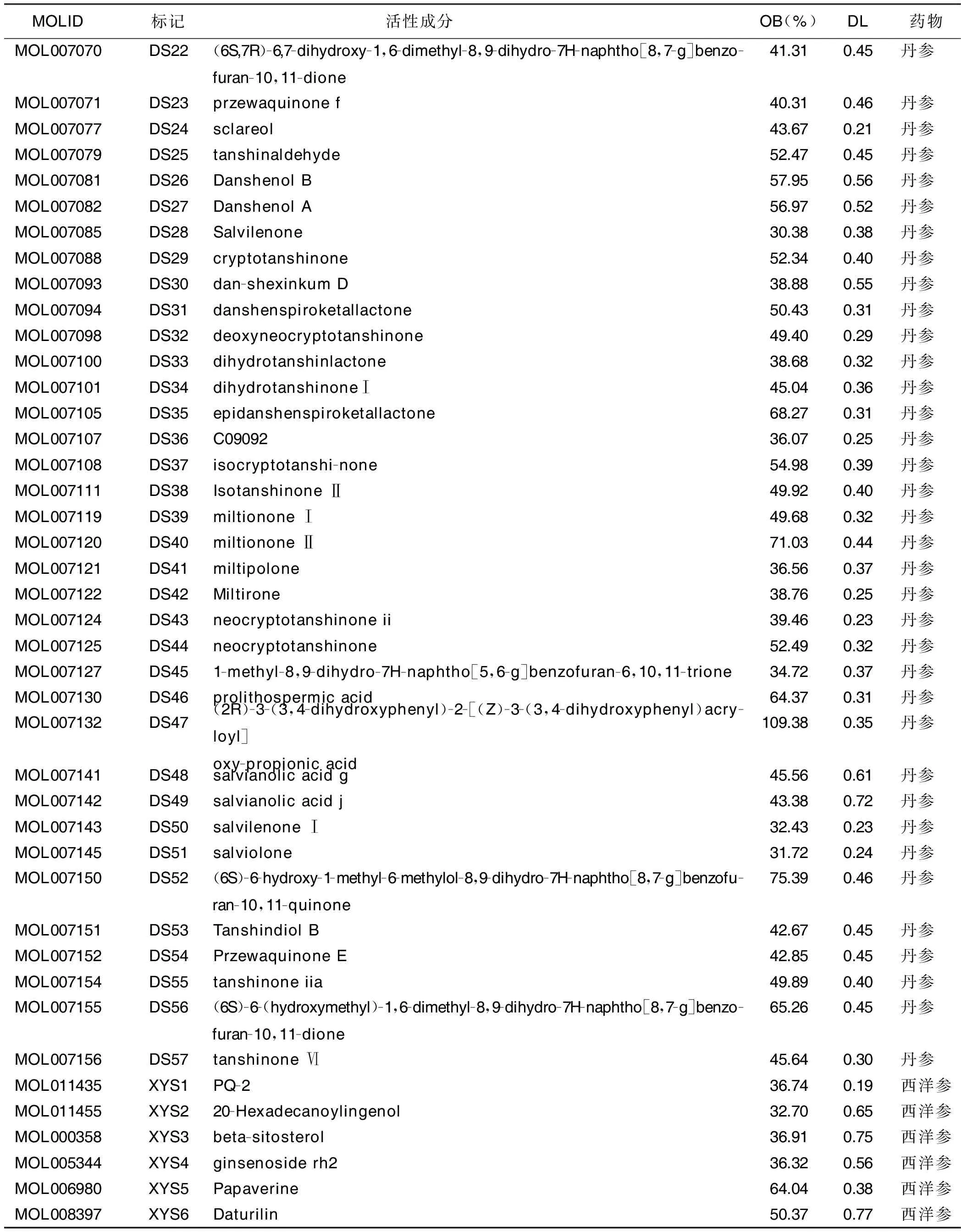
(续表)
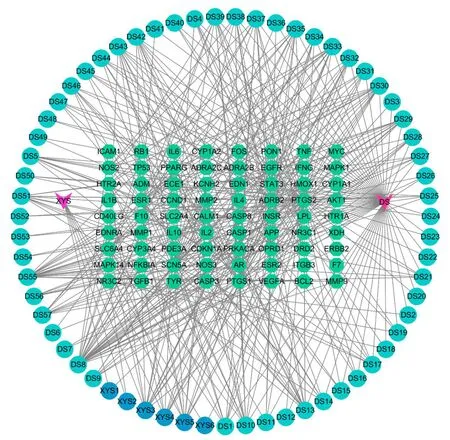
图2 成分-靶点网络图

表2 西洋参-丹参关键活性成分基本信息
2.5 PPI网络构建和关键靶点获取 将共同靶点提交至STRING平台,得到西洋参-丹参靶点PPI网络(见图3),共得到68个节点和256条边。将PPI网络导入CytoScape3.7.0,通过“Network Analyzer”进行分析,结果提示Degree值排名前10位的靶点分别为STAT3、AKT1、TP53、TNF、MAPK1、MAPK14、IL6、VEGFA、FOS和IL1B,推测这些靶点可能是西洋参-丹参治疗冠心病的关键靶点(见表3)。

图3 西洋参-丹参靶点PPI网络

表3 西洋参-丹参治疗冠心病关键基因基本信息
2.6 靶点通路富集分析及其可视化 本研究使用DAVID数据库,对西洋参-丹参治疗冠心病交集靶点进行基因富集分析,包括GO的生物过程(biological process,BP)、细胞组成(cellular component,CC)、分子功能(molecular function,MF)和KEGG通路,共得到578个GO注释结果和116条通路。以P值排序,选取富集基因数最多的前20条分析结果,通过Omishare平台转化为气泡图。由结果可知,西洋参-丹参主要参与的生物学过程包括细胞增殖、细胞凋亡、信号转导、缺氧反应、基因表达调控、药物反应、调控RNA聚合酶Ⅱ启动子的转录、对雌二醇的反应、蛋白质磷酸化的正调控、炎症反应等。详见图4。主要涉及的细胞成分包括细胞质膜、细胞核、细胞质、细胞外基质等(见图5)。涉及的分子功能主要富集于蛋白质结合、酶结合、转录因子结合、DNA结合、细胞因子活性、转录因子活性、蛋白质异二聚体活性、血红素结合、蛋白激酶结合、类固醇结合、类固醇激素受体活性、蛋白磷酸酶结合、生长因子活性等(见图6);排除各种疾病通路外,主要参与的通路有HIF-1信号通路、PI3K-Akt信号通路、TNF信号通路、FoxO信号通路、MAPK信号通路、雌激素信号通路、T细胞受体信号通路等(见图7)。
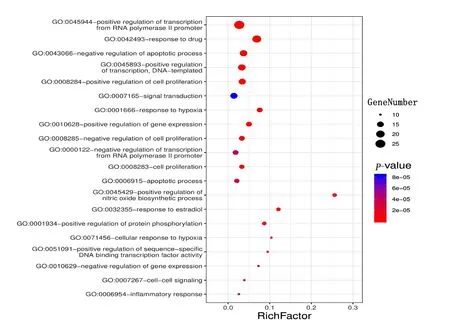
图4 西洋参-丹参治疗冠心病作用靶点的GO-BP富集分析

图5 西洋参-丹参治疗冠心病作用靶点的GO-CC富集分析

图6 西洋参-丹参治疗冠心病作用靶点的GO-MF富集分析

图7 西洋参-丹参治疗冠心病作用靶点的KEGG分析
2.7 成分-靶点-通路网络图构建 通过CytoScape3.7.0软件绘制成分-靶点-通路网络图,直观呈现活性成分、预测靶点和疾病通路之间的关系(见图8),图中共有节点155个(包含63个活性成分、72个靶点和20个通路)、边线642条,结果表明西洋参-丹参的同一活性成分可调控不同靶点,而同一靶点可干预不同的生物学过程及信号通路,体现了中药复方治疗疾病多成分、多靶点、多途径联合作用的特点。
图8 成分-靶点-通路网络图
3 讨 论
本研究基于网络药理学方法,通过检索相应的数据库和软件,筛选药物和疾病靶点,并对靶点进行GO和KEGG富集分析,构建成分-靶点-通路网络,从整体角度描述了中药与疾病的相互作用关系,科学系统地探讨了西洋参-丹参治疗冠心病的作用机制。本研究共筛选出西洋参-丹参63个活性成分,153个潜在靶点,与1 420个冠心病靶点相映射,得到72个共同靶点,富集分析得到GO分析结果578个,信号通路116条,充分体现了中药治疗疾病多成分、多靶点、多通路的治疗特点;西洋参-丹参治疗冠心病的关键活性成分为木犀草素、丹参酮ⅡA、β-谷甾醇、4-亚甲丹参新酮、丹参新醌D、二氢丹参内酯、2-异丙基-8-甲基菲-3,4-二酮、罂粟碱、鼠尾草酚酮和隐丹参酮;关键靶点为STAT3、AKT1、TP53、TNF、MAPK1、MAPK14、IL6、VEGFA、FOS、IL1B;生物功能主要涉及细胞增殖凋亡、炎症反应、信号转导、缺氧反应、基因表达、药物反应、对雌二醇的反应、蛋白质磷酸化等生物学过程;生物学通路主要作用于HIF-1信号通路、PI3K/Akt信号通路、TNF信号通路、FoxO信号通路、MAPK信号通路、雌激素信号通路和T细胞受体信号通路,其通过上述生物学过程进而对冠心病的病程产生影响。
本研究显示,初步筛选出西洋参-丹参治疗冠心病的关键活性成分为木犀草素、丹参酮ⅡA、β-谷甾醇、4-亚甲丹参新酮、丹参新醌D、二氢丹参内酯、2-异丙基-8-甲基菲-3,4-二酮、罂粟碱、鼠尾草酚酮和隐丹参酮。动脉粥样硬化相关基础研究表明,木犀草素能够提高血清中超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px),降低血清丙二醛(MDA)的表达,进而减少氧化损伤来改善高脂诱导的ApoE-/-小鼠动脉粥样硬化斑块[26]。丹参酮ⅡA能够下调THP-1巨噬细胞中miR-33的表达来抑制氧化型低密度脂蛋白(ox-LDL)诱导的促炎细胞因子的分泌[27],并可抑制TLR4/MyD88/κB(NF-κB)通路发挥抗炎及免疫调节作用[28]。β-谷甾醇可通过ERK1/2信号通路,减轻心肌缺血再灌注大鼠出现的氧化应激和炎症损伤,并抑制其心肌细胞的凋亡[29]。隐丹参酮能够调控PKM2抑制斑块内新生血管的形成[30],且可通过抑制NF-κB的活化,呈剂量依赖性地降低TNF-α诱导的人脐静脉内皮细胞间黏附分子(ICAM-1)的基因表达以发挥抗动脉粥样硬化的作用[31]。以上研究说明西洋参-丹参可以通过多种成分作用于不同靶点,多层次、多途径对动脉粥样硬化的发生发展产生影响,然而,部分关键成分的研究较少,需要进一步的实验证实,也为进一步的研究提供了思路。
本研究结果表明,西洋参-丹参治疗冠心病的关键靶点主要有STAT3、AKT1、TP53、TNF、MAPK1、MAPK14、IL6、VEGFA、FOS、IL1B。基础研究表明,STAT3参与慢性炎症、氧化应激等生物学效应[32],其激活可以促进内皮功能的恢复,进而预防动脉粥样硬化的发生发展[33]。AKT1是一种丝氨酸/苏氨酸激酶,是PI3K/Akt信号转导途径的重要中间分子, 在动脉粥样硬化斑块形成中起重要作用[34-35]。研究发现雌二醇与冠状动脉病变程度呈负相关,其可通过PTEN/Akt信号通路促进内皮细胞自噬,减少炎性因子的释放,影响冠状动脉病变进程[36]。MAPK1和MAPK14均是丝裂原活化蛋白激酶家族一员,通过三级酶促级联反应活化,调节细胞的生长、分化、应激、炎症反应等多种重要的生命活动[37],MAPK14磷酸化水平增加可诱导巨噬细胞炎症反应发生,参与动脉粥样硬化的发生发展[38]; IL6是冠心病的炎症标志物[39], 研究表明经皮冠状动脉介入术术后血清IL6升高组的长期预后显著不佳[40]。VEGFA基因沉默显著抑制ApoE-/-小鼠胸主动脉粥样斑块进展期新生血管的形成[41]。FOS是一种原癌基因,靶向降低c-Fos的表达,可降低小鼠血脂水平、斑块内脂质含量和炎症相关因子的表达[42]。以上研究表明西洋参-丹参对冠心病的调控具有多靶点效应,这些靶点涉及细胞增殖凋亡、信号转导、炎症反应、氧化应激、对雌二醇的反应、基因表达、血管生成等,这些生物过程与冠心病的发生发展密切相关,同时与生物注释分析的结果相一致,进一步印证了西洋参-丹参具有治疗冠心病的作用。
西洋参-丹参治疗冠心病的通路主要涉及HIF-1信号通路、PI3K/Akt信号通路、TNF信号通路、FoxO信号通路、MAPK信号通路、雌激素信号通路和T细胞受体信号通路,这些通路经既往研究证实与冠心病的发生发展密切相关。HIF-1是由 HIF-1α和 HIF-1β两个亚基组成的异二聚体转录因子,缺氧或炎症环境中可启动下游基因如IL-1β、LDHA以及VEGF等的转录并激活相关信号通路[43-44],研究发现HIF-1α在动脉粥样硬化部位高表达,促进动脉粥样硬化发生发展[45]。PI3K/Akt信号通路是经典的抗凋亡/促增殖信号通路,其下游靶点包括哺乳动物雷帕霉素靶蛋白(mTOR)、内皮型一氧化氮合酶(eNOS)、糖原合成酶激酶-3β(GSK-3β)、NF-κB等,通过调控上述信号发挥调节细胞自噬、减轻炎症反应、抗氧化应激等作用[46-48]。MAPK信号通路是重要的细胞内转导通路,研究显示抑制MAPK信号通路可减轻炎症反应、改善内膜增厚及抑制斑块形成[49]。雌激素通过结合不同雌激素受体改变细胞生理功能[50],其能够抑制内质网应激引起的血管内皮细胞凋亡发挥抗动脉粥样硬化作用[51]。T细胞受体(TCR)信号通路在T细胞激活中具有重要作用,抑制TCR活性,可增加胆固醇转运相关蛋白表达,促进胆固醇逆转运[52]。由此可见,西洋参-丹参可能通过调控多个通路改善冠心病的发生发展。
机体内各种反应错综复杂,通路之间互相关联影响,西洋参-丹参通过调节多个靶点和通路,共同发挥改善内皮细胞功能、抗炎抗氧化、减轻细胞泡沫化、抑制平滑肌细胞迁移、改善脂质代谢、减轻冠状动脉微环境缺血缺氧状态作用,进而稳定斑块,减轻斑块进展。冠心病发生发展是一个多因素、多阶段、多基因参与的复杂过程,而西洋参-丹参可从多层次、多角度参与到动脉粥样硬化的组织修复,通过调节多个生物过程来治疗冠心病,体现了中药治疗疾病的整体性与系统性。
综上所述,本研究初步揭示西洋参-丹参与冠心病之间“多成分-多靶点-多通路”的作用网络,初步预测其主要活性成分、关键靶点和在冠心病治疗中的作用机制,为西洋参-丹参治疗冠心病提供了理论依据和研究思路。本研究主要是以生物信息学和数据计算的结果为基础,今后将在此基础设计相应的体内或体外实验,进一步分析西洋参-丹参治疗冠心病的作用机制和分子机制,以验证本研究的分析和结论。

