冠心病病人α-酮戊二酸与氧化应激反应的相关性及对冠心病介入治疗预后的评估价值
倪水清,徐 鸿
冠心病是中老年人最常见的心脏疾病之一[1]。其病因是由于血脂代谢异常,胆固醇和三酰甘油等逐渐沉积于血管壁上形成动脉粥样硬化斑块,或由于冠状动脉痉挛,导致心脏冠状动脉管腔变窄,造成心肌缺血、缺氧或坏死[2]。氧化应激是由自由基在体内产生的一种负面作用,不仅可造成衰老,还能损伤胰岛β细胞、加速动脉粥样硬化,是导致糖尿病及冠心病等的一个重要因素[3]。经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)是近30年来发展起来的一种治疗冠心病的新方法,无须通过外科开胸手术和全身麻醉,医生经皮肤穿刺动脉(胳膊或腿),在X线下通过导管等器械,治疗冠状动脉狭窄或闭塞部位,使血管管腔恢复,血流重新畅通[4]。但由于病人的自身条件不同,加之病情变化等诸多因素影响,介入治疗作为有创的治疗手段,还是有风险的。α-酮戊二酸常作为运动营养饮料的成分,与精氨酸等复配可快速帮助运动员补充能量[5]。有研究发现,在肺部外科手术中,术前口服α-酮戊二酸不仅可改善病人术后肺部运动功能,还能减少氧化应激状态[6]。α-酮戊二酸还能促进细胞能量代谢,提高血管弹性,减缓机体衰老,抑制动脉粥样硬化病变的发生发展[7]。本研究旨在探讨冠心病病人α-酮戊二酸与氧化应激反应的相关性及α-酮戊二酸对冠心病介入治疗预后的评估价值。
1 资料与方法
1.1 一般资料 选取2018年1月—2019年9月我院收治的冠心病病人120例。根据治疗方案分为内科保守治疗组与介入治疗组,每组60例。另选取同期的健康体检者60名作为对照组。3组性别、年龄、高血压、糖尿病病史比较,差异均无统计学意义(P>0.05)。详见表1。
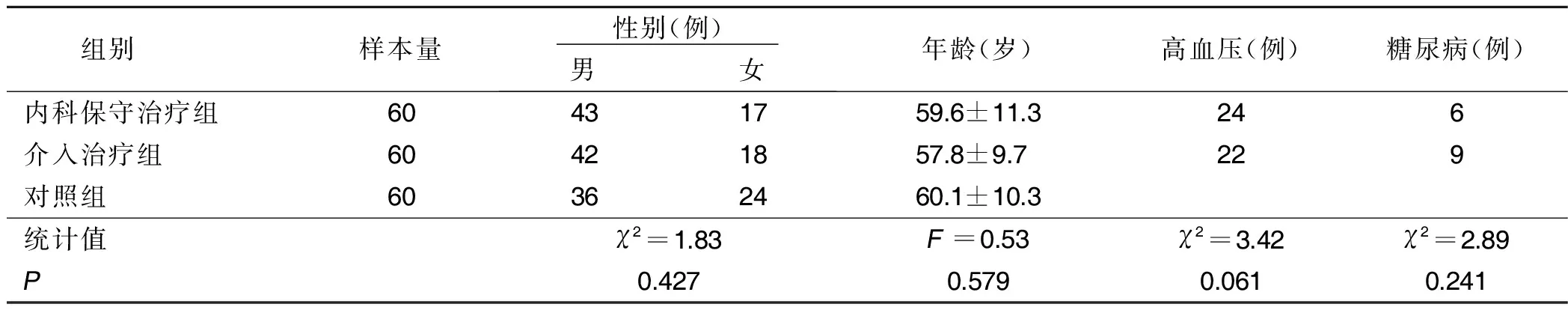
表1 3组一般资料比较
1.2 纳入与排除标准 纳入标准:符合冠心病诊断标准[8];预计生存期>3个月;年龄40~75岁;对本研究知情并签署知情同意书。排除标准:伴有肝肾功能严重不全者;伴有急性心肌炎、呼吸衰竭、心脏瓣膜病;心律失常频发者;妊娠或哺乳期女性。
1.3 方法 采集内科保守治疗组与对照组空腹外周静脉血,离心处理,采集血清,酶联免疫吸附试验(ELISA)法检测氧化应激指标,包括总抗氧化能力(TAC)、超氧化物歧化酶(SOD)、丙二醛(MDA)、过氧化氢酶(CAT)及谷胱甘肽(GSH),具体操作严格按照试剂盒说明书进行。采集内科保守治疗组、对照组、介入治疗组空腹静脉血样本,于2h内进行离心处理(1 500 g、15 min),离心后取上清液备用,采用亲水性相互作用液相色谱-液相色谱串联质谱法(HILIC-LC/MS/MS)测定血清α-酮戊二酸水平。比较内科保守治疗组与对照组氧化应激指标及3组α-酮戊二酸水平;对冠心病介入治疗组病人进行6个月的随访,最终确认12例发生主要终点事件(全因死亡或因冠心病再住院),根据是否发生主要终点事件,将介入治疗组分为发生事件组与未发生事件组,测定血清α-酮戊二酸水平,并通过受试者工作特征(ROC)曲线评价α-酮戊二酸水平对冠心病介入治疗病人预后的评估价值。
2 结 果
2.1 内科保守治疗组与对照组氧化应激指标水平比较 内科保守治疗组血清TAC、SOD、CAT及GSH水平低于对照组(P<0.05),血清MDA水平高于对照组(P<0.05)。详见表2。
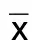
表2 内科保守治疗组与对照组氧化应激指标水平比较(±s)
2.2 3组α-酮戊二酸水平比较 α-酮戊二酸水平:对照组>介入治疗组>内科保守治疗组,3组比较差异有统计学意义(P<0.05),且发生事件组低于未发生事件组(P<0.05)。详见表3、表4。
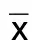
表3 3组α-酮戊二酸水平比较(±s) 单位:μg/mL
表4 发生事件组与未发生事件组α-酮戊二酸水平比较(±s) 单位:μg/mL
2.3 α-酮戊二酸与冠心病病人氧化应激反应的相关性分析 α-酮戊二酸与冠心病病人氧化应激指标TAC、SOD、MDA、CAT及GSH有相关性(r值分别为-0.522、-0.475、0.495、-0.433、-0.512,P均<0.05)。
2.4 α-酮戊二酸的ROC曲线 介入治疗后,发生事件组α-酮戊二酸的ROC曲线下面积(AUC)为0.698[95%CI(0.626,0.764)];未发生事件组α-酮戊二酸的AUC为0.871[95%CI(0.814,0.916)]。说明介入治疗后α-酮戊二酸有较高的灵敏度和特异度。详见图1。
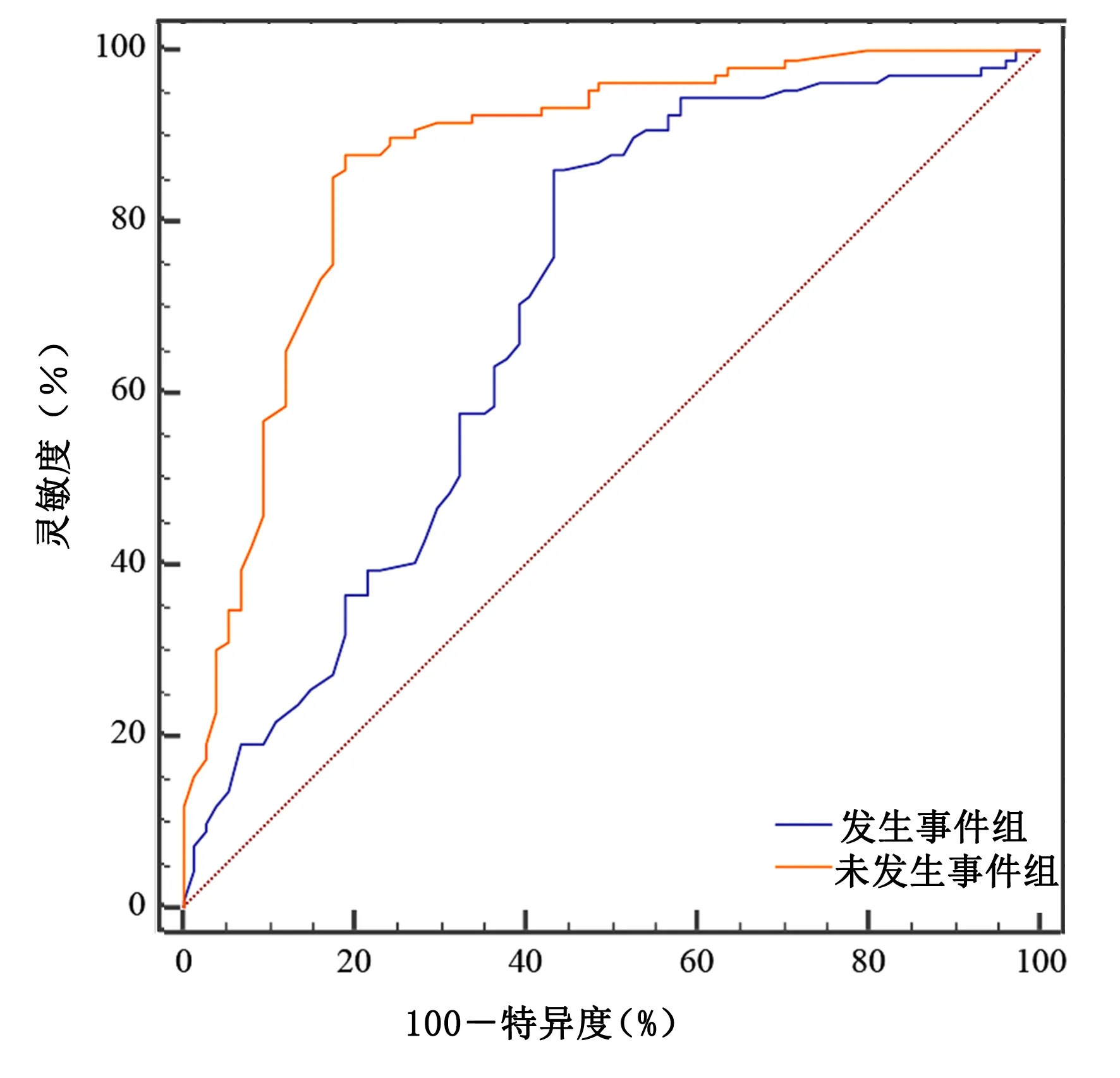
图1 介入治疗后α-酮戊二酸的ROC曲线
3 讨 论
近年来,我国冠心病发病率呈持续升高趋势,其高致残率及致死率给社会及家庭造成沉重负担[8]。随着介入心脏病学的不断发展,PCI被广泛应用于冠心病治疗中,且近期效果明显[9]。但PCI治疗预后受年龄、性别及是否合并糖尿病、高血压、高脂血症等因素影响,部分冠心病病人预后情况较差,甚至可发生猝死[10]。
α-酮戊二酸是一种戊二酸带酮基的衍生物,是三羧酸循环及谷氨酰胺代谢的重要的中间代谢产物,不仅能生成三磷酸腺苷(ATP)为机体提供能量,改善血管内皮细胞功能、自噬,还能通过调控ATP合成,限制机体营养物质的能量利用率,进而预防衰老等相关疾病[11-12]。氧化应激是因自由基及抗氧化剂间失衡所致,是动脉粥样硬化发生及发展的重要机制。有研究发现α-酮戊二酸可氧化分解过氧化氢(H2O2)、减少氧自由基产生、避免脂质过氧化损伤,此外,通过降低体内及体外细胞生成的活性氧含量,可加快机体内氧自由基的清除速率,从而增强其抗氧化能力,进一步保护血管内皮[13]。有报道指出,老年外周血管疾病病人血液中α-酮戊二酸水平明显降低,α-酮戊二酸不仅可影响其血管内皮细胞甲基化水平,且会改变其血管内皮细胞自噬及氧化应激状态,从而进一步提高血管内皮细胞的功能[14]。本研究结果表明,α-酮戊二酸水平比较,对照组>介入治疗组>内科保守治疗组。内科保守治疗组血清TAC、SOD、CAT及GSH水平低于对照组(P<0.05),血清MDA水平高于对照组(P<0.05),α-酮戊二酸对冠心病病人氧化应激反应有相关性。因此,α-酮戊二酸可能通过维持自由基与抗氧化剂之间的平衡,降低氧化应激,从而进一步抑制冠心病的发生发展。
三羧酸循环(TCA)是生物界包括植物、动物、微生物及人在内的最基础的代谢过程之一,α-酮戊二酸作为其关键中间代谢产物,在健康及疾病中所发挥的作用引起了更多关注[15]。近年来,研究发现,α-酮戊二酸可预防甚至逆转老年动物动脉粥样硬化病变,深入探讨α-酮戊二酸与动脉粥样硬化的关系,将为动脉粥样硬化的预防治疗提供新的策略及方法[16]。本研究对血清α-酮戊二酸水平对冠心病预后关系进行了研究,结果显示,发生事件组血清α-酮戊二酸水平较未发生事件组低(P<0.05)。且根据ROC曲线分析可知,在冠心病进行介入治疗的病人中,α-酮戊二酸对未发生事件组具有较高的敏感性和特异性,对冠心病介入治疗后病人预后有一定的评估价值。
综上所述,α-酮戊二酸可减少机体的氧化应激反应。血清中α-酮戊二酸水平越低,越易发生不良事件,α-酮戊二酸水平对冠心病介入治疗后病人预后有一定的评估价值,若适当补充α-酮戊二酸,则有助于减少冠心病病人氧化应激反应,改善冠心病介入治疗病人预后状况。但由于血清α-酮戊二酸积聚的机制及意义尚未清楚,由于本研究样本大小及特征受限,使得本研究结果存在一定的局限性。未来可扩大样本量进一步研究α-酮戊二酸在冠心病病理、生理过程中的作用及机制。

