不同生长期对蒲公英理化性质的影响
迟晓君,宋光春,段 曦,吴 凡,岳凤丽,*
(1.山东农业工程学院食品科学与工程学院,山东济南250000;2.中国农业大学食品科学与营养工程学院,北京100083;3.山东农业工程学院农业科技学院,山东济南250000)
蒲公英(Taraxacum mongolicum Hand.-Mazz.)又名黄花地丁、婆婆丁,为菊科蒲公英属多年生草本植物,味甜而苦涩,它主要含有酚酸、类黄酮、蒲公英色素、萜类、倍半萜内酯、植物甾醇和其他活性成分。其作为中草药在中医古籍中具有悠久的医学历史。最早记录在《唐本草》中后来被列入《本草纲目》、《中药大辞典》和《中国药典》[1],2015年版中国药典中记载[2],蒲公英具有抑菌抗肿瘤、清热解毒、健胃消炎、通乳利胆、消肿散结的功效[3]、可用于治疗消化不良、厌食症、肝脏脾脏等疾病[4-5]。同时其植株嫩叶、嫩茎可作为野菜食用从整体营养价值来评估,是开发绿色天然植物型营养保健品的理想资源,市场发展潜力巨大[6-8]。
目前我国蒲公英的加工在食品领域以采摘蒲公英鲜叶为主[9-12],基于前期对我国蒲公英鲜叶采摘时间的调研,山东省、河北省、广东省基本上一年采收5~6次,约60 d采摘一茬。河南省一年采摘叶片7~8次,约30~40 d采摘一茬。内蒙古自治区、吉林省等因气候冷凉,昼夜温差大叶片生长速度慢,一年采收叶片2次。大多是凭借经验及企业盈利的需要,国内外对于不同生长时间的蒲公英功能成分含量变化及最佳采摘期尚未有前人研究[13-15],在合理利用蒲公英鲜叶方面尚有短板,不同栽培企业采收的时期也并不统一,产品的质量难以标准化,亟待解决,本研究正是对这方面工作的有益补充,填补短板,为蒲公英鲜叶加工提质增效提供科学依据。
1 材料与方法
1.1 材料与仪器
蒲公英鲜叶 蒲公英(大叶品种)2018年11月播种,山东农业工程学院蔬菜示范园日光温室,每块种植基地10~15 m2;纯度≥99%标准品(芦丁、绿原酸、维生素C、葡萄糖、没食子酸)上海源叶公司。
TU-1810紫外分光光度计 上海元析仪器有限公司;WL-CS-115水分测定仪 广州华测检测科技有限公司;RE-5203型旋转蒸发仪 上海亚荣生化仪器厂;SHZ-DIII循环水多用真空泵 上海秋佐科学仪器有限公司;L-MU209微波超声波联用反应仪 济南启科仪器设备有限公司。
1.2 实验方法
1.2.1 样品的采集 根据前期团队对我国各地蒲公英基地采摘时间调研,分别于苗期,每间隔15 d,分别30、45、60、75、90 d上午十点随机定点取样,各时期取四角及中间区域采取约500 g,用于预实验,正式实验,及后续复检使用。
1.2.2 各成分测定
1.2.2.1 水分含量测定 将洗净、表面水分晾干后的蒲公英茎叶,剪碎放入到水分测定仪中进行水分含量测定,平行操作三次。
1.2.2.2 茎长茎宽测定 使用测量工具对其长宽测定。
1.2.2.3 粗纤维测定 按中华人民共和国卫生部GB/T 5009.10-2003,植物类食品中粗纤维的实验方法[16]测定蒲公英鲜叶中粗纤维含量。
1.2.2.4 感官评定 按播种至30、45、60、75、90 d的时间间隔采摘蒲公英鲜叶,选取10名有经验的感官评定人员对蒲公英茎叶的颜色、长度、宽度等感官指标进行感官评定。
1.2.2.5 总黄酮测定 参照罗岳北[17]方法,采取新鲜蒲公英茎叶,洗净,待表面水分晾干后匀浆。75%乙醇作为提取溶剂,按料液比1∶100加入相应的提取液,以100 W功率,55℃下超声提取两次,每次30 min,合并两次上清液,减压浓缩至25 mL容量瓶中,制备黄酮测定备用液。
参照张令文等[18]方法,在510 nm处测定吸光度,以芦丁质量浓度为横坐标,吸光度为纵坐标,绘制标准曲线,y=0.1014x+0.0004(r=0.9999),并进行蒲公英鲜叶总黄酮含量测定。
1.2.2.6 多酚测定 采用上述1.2.4步骤中的备用液进行鲜叶中多酚含量测定。
参照臧延青等[19]方法,在765 nm波长处测定吸光度,以没食子酸含量为横坐标,吸光度为纵坐标,绘制标准曲线,y=0.1144x+0.0078(r=0.9996),并进行蒲公英鲜叶多酚测定。
1.2.2.7 多糖测定 参照何婷婷、张静等[20-22]方法,采取新鲜蒲公英茎叶,洗净,晾干后匀浆。以料水比1∶25,在100 W功率,65℃超声提取两次,每次1.7 h,合并两次上清液,减压浓缩至25 mL容量瓶中,用蒸馏水定容,制备多糖测定备用液。
参照肖潮勇等[23]方法,在490 nm的波长下测定吸光度,以吸光度为纵坐标,葡萄糖浓度为横坐标,绘制标准曲线y=0.3240x+0.0013(r=0.9999),并进行蒲公英鲜叶多糖含量测定。

表1 蒲公英鲜叶感官评定标准Table 1 Criteria for sensory evaluation of fresh leaves of dandelion
1.2.2.8 维生素C测定 参照李军[24]方法,将蒲公英茎叶洗净、切碎、称取5.0000 g放入研钵中,移取0.1%盐酸10.00 mL加入到研钵中,研磨成匀浆。用离心机以10000 r/min离心10 min。移取上清液2.00 mL,倒入50.00 mL容量瓶中。然后加入体积分数为0.01的盐酸2.00 mL,定容至刻度线制备维生素C测定备用液。在243 nm下测定吸光值,以吸光值为纵坐标,维生素C的量为横坐标,作标准曲线y=0.0577x+0.0048(r=0.9998),并进行蒲公英鲜叶维生素C测定。
1.3 数据分析
文中数据均为3次重复的平均值,采用Microsoft Excel软件处理数据及作图,并运用Sigmaplot软件检验法对显著性差异进行多重比较。
2 结果与分析
2.1 不同采摘期对蒲公英叶中成分影响
2.1.1 不同采摘期蒲公英鲜叶中水分含量 随着时间的增长,蒲公英鲜叶中水分含量由30 d所测得91.54%缓慢降低至87.51%。且在30~45 d阶段水分含量下降最快,下降约2%,具有显著性差异(P<0.05),采摘期75和90 d水分含量基本保持不变。这与下文中多糖、多酚、总黄酮、维生素C含量在此时间段出现增长的趋势相符合,含水量较大的采摘期适合鲜食及制作饮料,但是不适合制作茶及粉。
2.1.2 不同采摘期蒲公英鲜叶茎长 蒲公英鲜叶上层、下层茎长的生长状态如图2所示,在60 d时上、下层茎长增长率分别为108%、99%,说明前60 d蒲公英处于生长旺盛期,植株茎长增长迅速。60 d之后生长减缓,形态变化较小并在75 d趋于稳定状态,且整个生长过程中下层的茎长总是略高于上层茎长,符合植物生长规律。
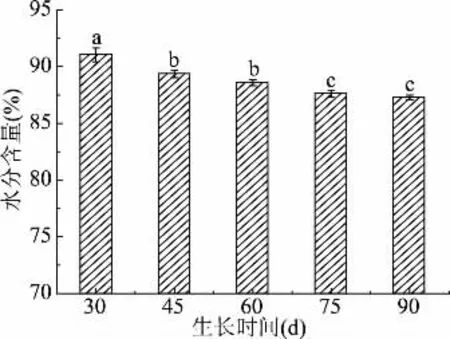
图1 不同采摘期水分含量变化Fig.1 Changes of water content in different picking periods
2.1.3 不同采摘期蒲公英叶茎宽 蒲公英鲜叶上层、下层茎宽的生长状态如图3所示,在前60 d中植株上下层茎宽降低率分别为31%、20%,但上层茎在60 d后生长趋于稳定,下层茎在75 d后达到稳定状态,结合图2、图3分析可得,从产量角度分析,60 d即可以采摘,且整个生长过程中下层的茎宽总是略高于上层茎宽,也符合植物生长规律。
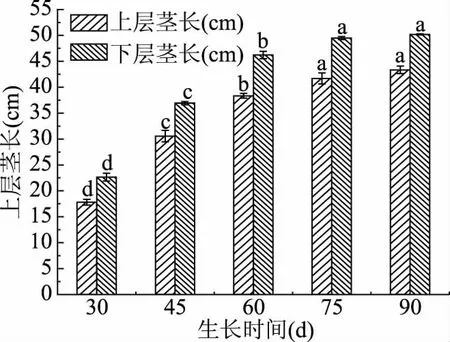
图2 不同采摘期上下层茎长变化Fig.2 Changes of stem length of upper and lower layers in different picking periods
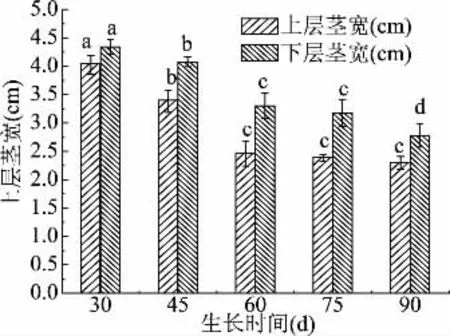
图3 不同采摘期上下层茎宽变化Fig.3 Changes of upper and lower stem width in different picking periods
2.1.4 不同采摘期蒲公英鲜叶感官评分 通过对5个不同采摘期的蒲公英鲜叶进行感官评定,根据10位经验丰富的评定人员的评分如图4所示,30 d的蒲公英鲜叶感官评分最高为88.2分,即30 d的蒲公英叶最易被人体接受,随时间的增长粗纤维含量增加,叶片的苦味加强,口感质地已不再被人体接受,感官评分均具有显著性差异(P<0.05),这与粗纤维的测定结果一致,如果采摘期小于30 d产量过低且口味过淡,叶片过嫩风味物质及功能成分过少不适合加工,故推荐30 d作为鲜食最佳采摘期。
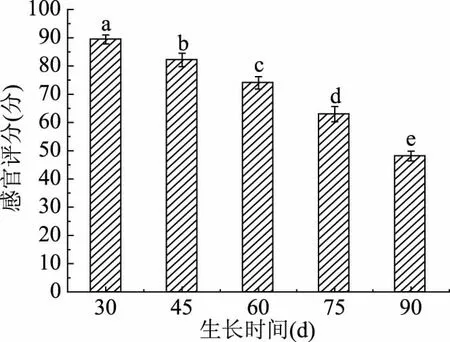
图4 不同采摘期蒲公英鲜叶感官评分Fig.4 Sensory score of fresh leaves of dandelion in different picking periods
2.1.5 不同采摘期对蒲公英叶中粗纤维含量影响 蒲公英鲜叶中粗纤维的含量变化趋势如图5所示:蒲公英鲜叶的粗纤维在30 d时含量最低为5.3 g/100 g,之后随生长时间的延长呈显著性增加趋势。因此,从食用角度而言,蒲公英鲜叶在相对幼嫩时期消化率较高,更有利于作为野菜被人们接受,随着粗纤维含量高适口性会下降,超过75 d粗纤维含量较多口感已不适合做鲜食,但适合制作茶饮或者制作蒲公英叶超微粉等其他食品。
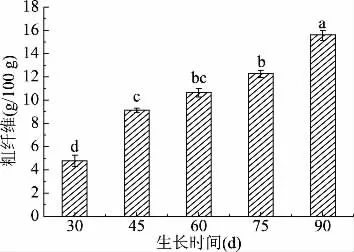
图5 不同采摘期粗纤维含量变化Fig.5 Variation of crude fiber content in different picking periods
2.2 不同采摘期对蒲公英叶功能成分影响
2.2.1 不同采摘期对蒲公英叶中总黄酮含量影响 蒲公英鲜叶中总黄酮的含量变化如图6所示:鲜叶中总黄酮的含量随时间的变化呈增长的趋势,但增长速率较为缓慢。由30 d的29.70 mg/100 g增长为75 d的53.92 mg/100 g均有显著性增长(P<0.05),说明蒲公英鲜叶中总黄酮含量变化颇为稳定,75与90 d测得的总黄酮含量不存在显著性差异性(P>0.05),说明黄酮的积累在75 d已经达到平衡。
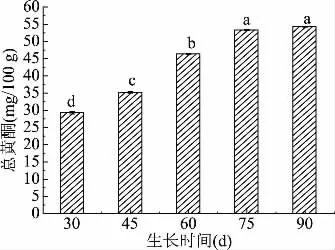
图6 不同采摘期总黄酮含量变化Fig.6 Changes of total flavonoids in different picking periods
2.2.2 不同采摘期对蒲公英叶中多糖含量影响 蒲公英鲜叶中多糖的含量随时间的增长含量变化较为缓慢。如图7所示,30~75 d鲜叶中多糖的含量总体变化趋势呈显著性增长(P<0.05),采摘期75与90 d多糖增长无显著性变化(P>0.05)。75 d以上随着时间延长多糖的积累不明显,综合种植成本考虑可于75 d采摘。
2.2.3 不同采摘期对蒲公英叶中多酚含量影响 蒲公英鲜叶中多酚的含量变化趋势如图8所示。在45~90 d多酚总体增加趋势较为显著(P<0.05),即由177 mg/100 g增长到267.5 mg/100 g,75~90 d多酚物质含量趋于稳定,说明多酚的积累在75 d已经达到平衡。
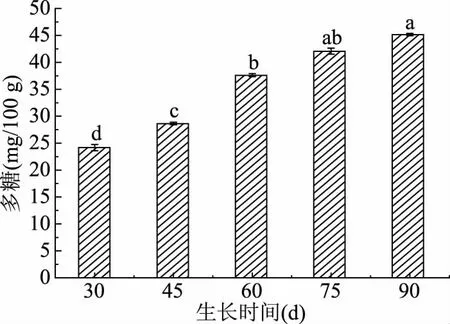
图7 不同采摘期多糖含量变化Fig.7 Changes of polysaccharide content in different picking period
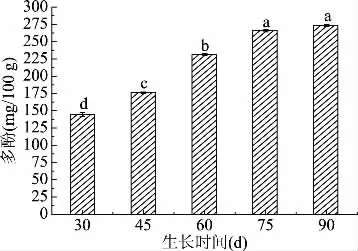
图8 不同采摘期多酚含量变化Fig.8 Changes of polyphenol content in different picking periods
2.2.4 不同采摘期对蒲公英叶中维生素C含量影响 蒲公英鲜叶中维生素C的含量变化趋势如图9所示。维生素C含量整体呈现先上升后下降再稳定的趋势,且在45 d之后逐渐降低,30~60 d均呈现显著性变化(P<0.05),但采摘期60 d以后无显著性变化(P>0.05),维生素C含量趋于稳定。此实验表明在45 d左右是维生素C合成速率最高的时间段,若想利用维生素C则可于45 d采摘。
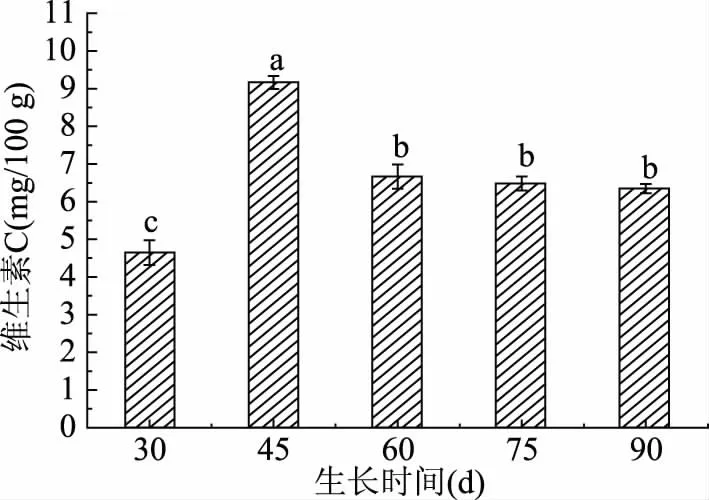
图9 不同采摘期维生素C含量变化Fig.9 Changes of vitamin C in different picking periods
3 结论
本实验表明,蒲公英鲜叶在生长期30 d时质地幼嫩细腻、苦味淡,适合鲜食或者制作蒲公英小豆腐等即食性食品;随着生长时间延长,代谢活动旺盛、次生代谢产物等活性物质积累增多,生长期45 d时水分含量较高,便于榨汁,且此阶段的蒲公英鲜叶颜色为淡绿色,榨出的汁液,色泽鲜艳明亮,维生素C、多糖、总黄酮含量等营养成分较30 d含量丰富,适合于制造新型蒲公英饮料;到达75 d进入稳定期,此时多糖、多酚、总黄酮含量较高,含水量较低,干物质含量多,大部分功能性物质含量趋于平衡,但是粗纤维等影响口感,鲜食效果不佳,适合蒲公英茶、蒲公英粉等保健品及保鲜剂产品;另外综合考虑农民经济收益,减少农田占用时间,增加企业利率,蒲公英鲜叶用于食品加工建议采摘期在90 d以内。本文通过蒲公英鲜叶在不同生长时间的理化成分测定,结合感官评定及茎长茎宽的测定,可综合确定出制作各种蒲公英产品时可选取的采摘时间,为蒲公英加工提质增效提供科学依据。

