术前外周血中性粒细胞/淋巴细胞比值对早期乳腺癌患者非前哨淋巴结转移的预测分析
冯 帆 王一刻 张 峰
前哨淋巴结(sentinel lymph node,SLN)活检是一项安全有效的评估SLN 状态的方式[1]。2006 年美国国立综合癌症网络(national comprenensive cancer network,NCCN)乳腺癌指南推荐,若SLN 活检为阴性,患者可以免除腋窝淋巴结清扫[2],若SLN 活检为阳性则需常规做腋窝淋巴结清扫[3]。腋窝淋巴结清扫术后常见并发症有上肢运动受限、感觉障碍、麻木、淋巴水肿等。近年来,有临床研究发现SLN 阳性的乳腺癌患者中仅半数有非前哨淋巴结(non-sentinel lymph node,nSLN)转移[4],并不是全部的患者均能从腋窝淋巴结清扫中获益[5]。因此分析研究SLN 阳性的乳腺癌患者nSLN 转移的影响因素有助于避免无谓的腋窝淋巴结清扫。
外周血中性粒细胞/淋巴细胞比值(neutrophillymphocyte ratio,NLR)是一项炎症指标,通过外周血常规即可获得。在乳腺癌患者中我们观察到部分患者的外周血出现中性粒细胞计数升高和(或)淋巴细胞计数降低,而国外有研究显示,术前NLR 与乳腺癌预后不良相关[6-7]。Koh 等[8]和Azab 等[9]发现,术前NLR 越高的肿瘤患者越容易出现淋巴结转移和远处转移。目前国内外关于术前NLR 与nSLN 转移关系的文章较少。因此,本文回顾性分析早期乳腺癌患者术前NLR 与nSLN 转移的关系,以及影响nSLN 转移的因素。
1 资料与方法
1.1一般资料 本研究纳入2014 年1 月—2020 年1 月杭州市妇产科医院乳腺科63 例和浙江大学医学院附属妇产科医院乳腺科380 例乳腺癌临床分期为T1-2N0M0 的患者资料,包括年龄、前哨探测方法、肿瘤直径、术前NLR、SLN 转移数目、nSLN 转移数目、病理分级、免疫组化。所有患者术前临床及影像学检查提示腋窝阴性,未进行新辅助治疗,实施手术时均先进行SLN 活检,术后病理诊断为浸润性乳腺癌,病灶最大直径≤5cm,并排除局部复发或诊断时即有远处转移灶的患者。本研究通过医院伦理审批,审批号【2021】医伦审K 第(1)号-5,并符合数据安全性要求。
1.2免疫组化 根据肿瘤细胞雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人类表皮生长因子受体-2(human epidermal growth factor receptor-2,HER2)和Ki67 表达情况进行分型:Luminal A 型[ER(+)和/或PR(+)、HER2(-)、Ki67<14%],Luminal B 型[ER(+)和/或 PR(+)、HER2(-)、Ki67≥14%]和[ER(+)和/或PR(+)、HER2(+)],HER2-positive 型[ER(-)、PR(-)、HER2(+)]以及三阴型(triple negative breast cancer,TNBC)[ER(-)、PR(-)、HER2(-)]。
1.3术前NLR 收集 NLR 即中性粒细胞与淋巴细胞比值,数据均来自患者手术前血常规结果。
1.4SLN 活检 亚甲蓝染色法:手术前患侧乳晕边缘皮内、皮下注射亚甲蓝2mL,按摩乳房15min,肉眼观察蓝染的淋巴管并循此寻找蓝染的淋巴结,将其切除并标记为SLN。
1.5统计学方法 应用统计软件SPSS 22.0 进行统计分析,计数资料以例表示,采用卡方检验、Fisher 精确检验,计量资料以M(P25,P75)表示,采用Mann-Whitney U 检验,将单因素分析中差异有统计学意义的因子纳入多因素分析,采用二元logistic 回归分析进行多因素分析。将nSLN 是否转移作为因变量作受试者工作特征曲线(receiver-operating characteristic curve,ROC 曲线),取得曲线下面积来衡量术前NLR的预测价值。P<0.05 为差异有统计学意义。
2 结果
2.1分组结果 443 例患者行SLN 活检后提示SLN未转移254 例(SLN-组),有癌转移并完成腋窝淋巴结清扫的患者共189 例(SLN+组)。腋窝淋巴结清扫后有99 例nSLN 转移(nSLN+组)和90 例nSLN 未转移(nSLN-组)。
2.2SLN(-)组与SLN(+)组分析结果 单因素分析发现,SLN(-)组和SLN(+)的肿瘤直径(P<0.001)、脉管浸润(P=0.005)和术前NLR(P=0.019)有显著差异(见表1)。将SLN(+)组中的肿瘤直径、脉管浸润、分子分型和术前NLR 纳入多因素分析,结果显示:脉管浸润(P=0.015,OR=2.899,95%CI:1.232~6.819)、肿瘤直径(P=0.001,OR=1.950,95%CI:1.313~2.897)、术前NLR(P=0.031,OR=1.239,95%CI:1.020~1.507)对于预测早期乳腺癌SLN 转移有统计学意义,见表2。
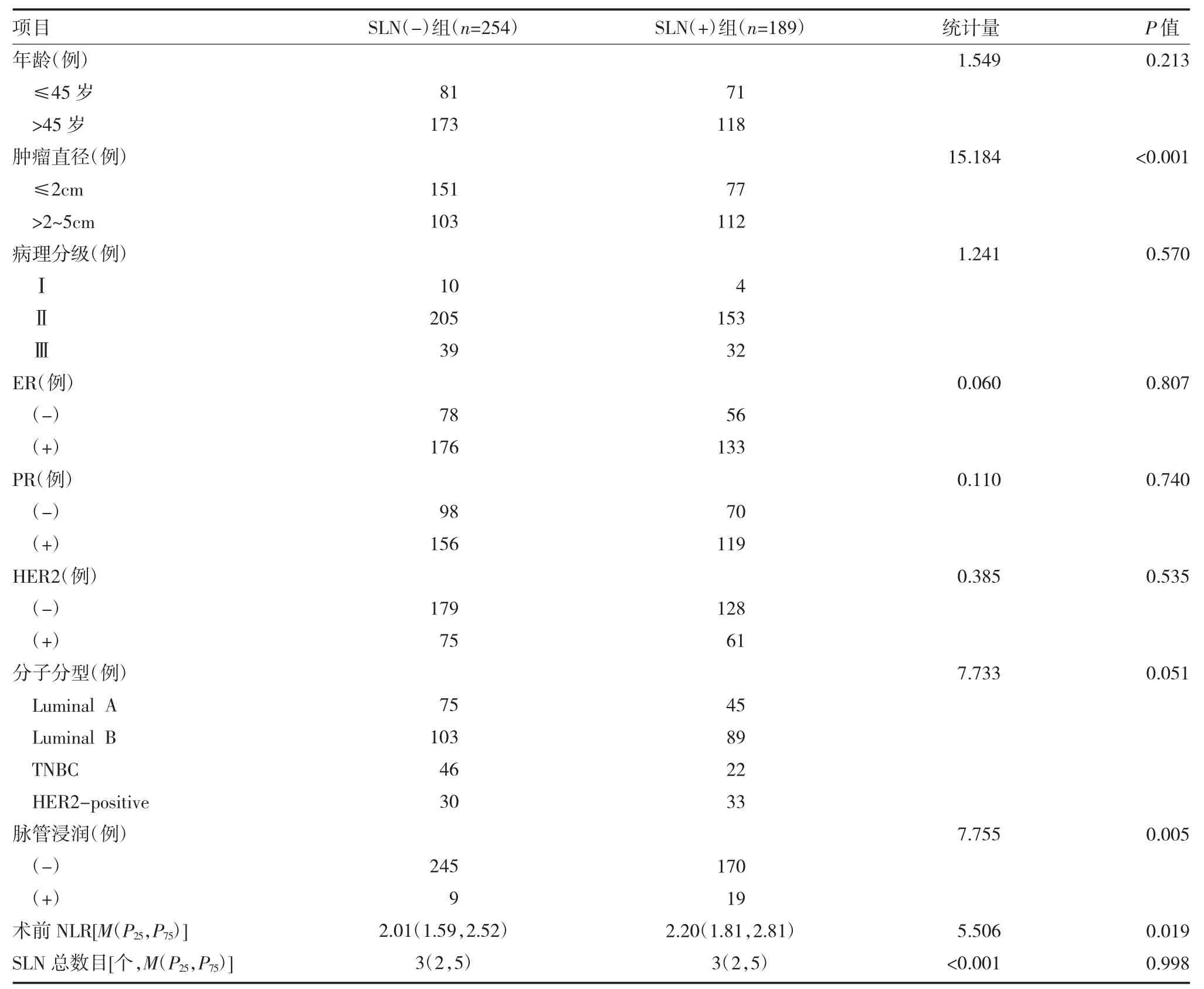
表1 SLN(-)组与SLN(+)组乳腺癌患者临床病理特征和术前NLR 比较

表2 logistic 回归分析预测SLN 转移
2.3nSLN(-)组与nSLN(+)组分析结果 单因素分析发现,nSLN(-)组和nSLN(+)的肿瘤直径(P=0.008)、SLN 转移数量(P=0.026)、脉管浸润(P=0.003)和术前NLR(P=0.003)有显著差异(见表3)。将nSLN(+)组中的肿瘤直径、术前NLR、SLN 转移数量、脉管浸润纳入多因素分析,结果显示,脉管浸润(P=0.016,OR=5.057,95%CI:1.351~18.927)、肿瘤直径(P=0.038,OR=1.952,95%CI:1.038~3.672)、术前NLR(P<0.001,OR=2.213,95%CI:1.426~3.432)对于预测早期乳腺癌nSLN 结转移有统计学意义,见表4。

表3 nSLN(-)组与nSLN(+)组乳腺癌患者临床病理特征和术前NLR 比较
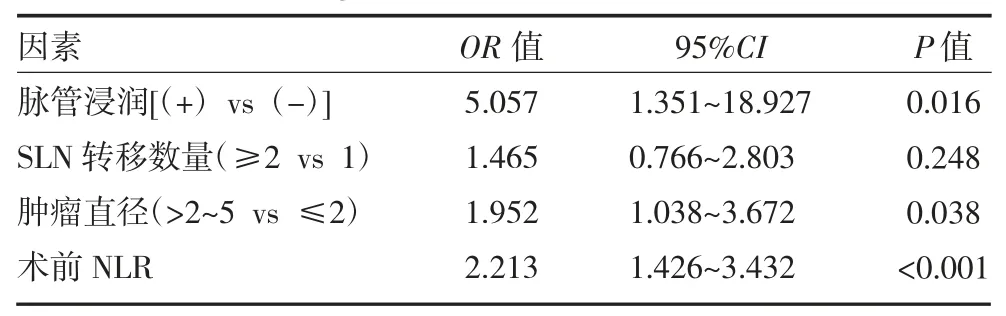
表4 logistic 回归分析预测nSLN 转移
2.4ROC 分析结果 术前NLR 的曲线下面积为0.668(95%CI:0.592~0.744),最佳截断值2.7,敏感度62.6%,特异度87.8%;阳性预测值84.9%,阴性预测值68.1%,差异有统计学意义(P<0.01),说明术前NLR对nSLN 转移的预测分析有意义,见图1。
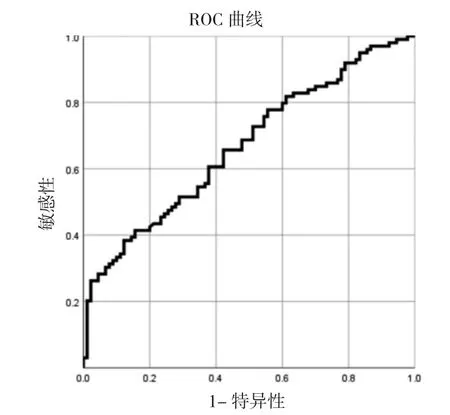
图1 术前NLR 的ROC 曲线
3 讨论
恶性肿瘤的进展和预后与机体的炎性反应密切相关,炎症免疫反应细胞能够通过调节肿瘤微环境进而影响肿瘤发生、发展[10]。中性粒细胞可以通过改变肿瘤微环境促进肿瘤细胞迁移扩散,而淋巴细胞与肿瘤的控制有关[10]。NLR 反映了中性粒细胞和淋巴细胞两者之间的平衡状态,我们研究发现术前NLR 可以预测nSLN 的转移(P<0.01)。
腋窝淋巴结清扫是目前SLN 阳性患者的标准治疗方式。我国乳腺癌患者的临床病理特点与国外乳腺癌不同,SLN 活检开展状况与国外存在差异,并且国内患者观念较为保守,因此我国大部分SLN 阳性的患者依然倾向于即刻行腋窝淋巴结清扫,但并不是全部的患者均能从腋窝淋巴结清扫中获益[5],合理选择手术方式是预防和改善术后并发症的根本措施。本文189 例SLN 阳性的患者全部接受腋窝淋巴结清扫,99 例(52.4%)术后病理诊断有nSLN 转移。其余90 例患者(47.6%)仅存在SLN 转移,这部分患者并没有从腋窝淋巴结清扫中获益,因此临床上只需要行SLN 活检。SEER 数据库的一项研究发现,在1998 至2004 年间共26986 例SLN 阳性的乳腺癌患者中,16.4%的患者单独行SLNB,83.6%行SLN 活检联合腋窝淋巴结清扫,随访50 个月后两组总生存率没有显著差异[11]。ACOSOG Z0011 试验同样发现,两组在总生存率、无病生存率和局部复发率方面差异无统计学意义[12]。该研究表明,SLN 阳性而nSLN 阴性的患者只行SLN 活检并不影响预后,且该结论已被纳入NCCN 指南。对此,寻找到能预测有无nSLN转移的因子显得十分重要。
纪念斯隆·凯林特癌症中心列线图是一个用于评估SLN 阳性患者的nSLN 转移的数学模型,包含肿瘤直径、肿瘤类型、分级、脉管浸润、ER 状态、SLN(+)数目、SLN(-)数目、SLN 寻找方式等用来预测nSLN 转移的可能性,但该列线图中并无术前NLR。本研究单因素分析显示,nSLN 转移除了与肿瘤直径、脉管浸润有关外,还与术前NLR 有关(P=0.003)。多因素分析显示,对于SLN 阳性的早期乳腺癌,脉管浸润、肿瘤直径、术前NLR 均是nSLN 转移的独立影响因素,与文献报道基本相符[13-14]。由于脉管浸润需在术后病理切片才能诊断,肿瘤直径是已知的肿瘤转移高危因素,因此,术前NLR 可以作为nSLN 转移的独立预测因素显得十分重要。
此外,术前NLR 升高被认为与乳腺癌预后不良有关。Orditura 等[6]认为,术前NLR 值越高,预后越差,而术前NLR>3.3 的乳腺癌患者生存期更短[9],术前NLR>2.5 与患者无病生存率的降低有关[15]。Rimando 等[16]认为,术前NLR≥3.7 是乳腺癌是否有转移的独立预测因素。本文中术前NLR 在nSLN(+)组与nSLN(-)组之间有显著差异,术前NLR 的曲线下面积为0.668(95%CI:0.592~0.744),最佳截断值为2.7,与文献报道基本相符[8,17-19]。因此,我们认为术前NLR>2.7 的患者更可能发生nSLN 转移,术前NLR可以作为早期乳腺癌nSLN 是否转移的预测因子。未来仍需要更多的大数据临床研究来明确术前NLR 与nSLN 转移的关系。

