西洋参多糖对克林霉素磷酸酯诱导的抗生素相关性腹泻的改善作用
任多多,邵紫君,刘松鑫,王泽帅,赵丽娟,夏蕴实,李珊珊,孙印石,
(1.中国农业科学院特产研究所,吉林长春 130112;2.吉林农业大学中药材学院,吉林长春 130118)
抗生素相关性腹泻[1](antibiotic associated diarrhea,AAD)是指在使用抗生素时发生的其他原因不明的腹泻,其中肠道菌群失调是AAD 的一个重要特征[2]。肠道菌群作为一个新的“器官”,其与机体的营养、免疫、代谢等诸多生理功能息息相关,在维持机体健康稳态中起着至关重要的作用[3]。肠道菌群与机体之间相对平衡的关系[4]被打破,就会引起肠道菌群紊乱使宿主处于疾病状态之中。
已有文献报道,许多植物多糖可以促进肠道益生菌群的生长、增强机体的免疫功能,维持肠道健康的内环境。纳米山药多糖双歧杆菌合生元结肠靶向微生态调节剂[5]能够提高肠炎大鼠的免疫功能。黄芪多糖和人参多糖能增强仔猪的免疫力,促进肠道菌群的平衡,进而提高仔猪肠道的健康[6]。铁皮石斛多糖通过提高粪便含水量和短链脂肪酸(short chain fatty acids,SCFAs)含量调节机体免疫,从而促进免疫低下小鼠的肠道健康[7]。相关研究表明人参多糖[8]、五味子多糖[9]、黄芪多糖[10]、葛根多糖[11]、百合多糖[12]等都具有调节因盐酸林可霉素导致的肠道菌群失调问题,并具有维持肠道健康的作用。不同的植物多糖大都可通过促进肠道有益菌群的生长,抑制有害菌的增殖起到调节肠道菌群的积极作用。西洋参(Panax quinquefoliumL.)是五加科多年生草本植物西洋参的干燥根,别名花旗参、美国参等,具有补气养阴、清热生津的功效[13−15]。现代药理研究表明,西洋参多糖具有抗肿瘤、抗炎、抗氧化、免疫调节等多种生物活性[16]。西洋参中含有糖类、皂苷、挥发油和多肽等多种功能成分,其中多糖是西洋参发挥药用价值的重要活性成分,不断受到人们的关注和重视,在发挥疗效的过程中起着不可或缺的作用[17−18]。目前,关于西洋参多糖对抗生素相关副作用的影响还未见报道。
克林霉素磷酸酯与林可霉素相比其抗菌作用强4~8 倍,对革兰阳性菌、革兰阴性菌具有良好的抗菌活性,同时对各类厌氧菌具有强大的抗菌作用,其抗菌谱广,临床应用比较广泛。因此本实验通过建立克林霉素磷酸酯致抗生素相关性腹泻大鼠模型,采用常规HE 染色、16S rRNA 高通量测序等方法,研究了WQP 对抗生素相关副作用,尤其是腹泻、肠道结构损伤、肠道菌群组成和多样性的影响。实验旨在采用高通量测序技术进一步研究西洋参多糖是否对克林霉素磷酸酯造成的肠道菌群紊乱有一定的调节作用,进而为西洋参多糖的进一步开发应用提供理论参考。
1 材料与方法
1.1 材料与仪器
西洋参(Panax quinquefolium) 吉林抚松丰泽农业种植开发有限公司;Wistar 健康雄性大鼠 24 只,重量为(140±20)g 辽宁长生生物技术股份有限公司,动物生产许可证号SCXK(辽)2015-0001,合格编号211002300 047566;克林霉素磷酸酯(批号1903190911) 辰欣药业股份有限公司;粪便基因组(DP328)DNA 提取试剂盒、Axygen DNA 凝胶回收试剂盒 北京天根生化科技有限公司;1-苯基-3-甲基-5-吡唑啉酮(PMP) 上海源叶生物科技有限公司;苏木精-伊红(Hematoxylin-Eosin,HE)、10%中性福尔马林溶液 北京索莱宝技术有限公司;三氟乙酸 中国赛默飞世尔科技有限公司;其他试剂均为国产分析纯。
MS204S 型电子分析天平 瑞士梅特勒-托利多公司;单煎机 青岛达尔电子机械销售有限公司;SFTDL 型低速台式大容量离心机 上海菲恰尔分析仪器有限公司;TG16 型台式高速离心机 湘仪实验室仪器开发有限公司;524G 型数显恒温磁力搅拌器 上海梅颖浦仪器有限公司;GZX 型鼓风干燥箱 上海博讯实业有限公司;Alpha 1-4 LDplus 型冷冻干燥机 德国Christ 公司;Essentia LC-16 岛津高效液相色谱仪 苏州创谱科学仪器有限公司;EG1150H 型病理包埋机、RM2255 型病理切片机 德国Leica 公司;752N 型紫外可见分光光度计 上海仪电分析仪器有限公司;IX53 型奥林巴斯荧光显微镜 北京新爱纺医疗器械有限公司;NanoDrop1000 型超微量分光光度计 美国Thermo Fisher Scientific 公司;NDA701 杜马斯定氮仪 意大利VELP 公司。
1.2 实验方法
1.2.1 西洋参多糖的制备 根据文献[19]中的方法,将500 g 的干燥西洋参切成1 cm 左右的小段后,浸泡在8 L 去离子水中2 h,单煎机煮沸提取4 h 后,120 目纱布过滤。所得滤渣再重复提取2 次,每次2 h,合并3 次所得提取液,用单煎机将其浓缩至1.5 L。浓缩液4500 r/min,离心10 min,取上清液。向上清液中加入4 倍体积的无水乙醇醇沉,静置6 h以上,然后4500 r/min,离心10 min,取沉淀。将沉淀复溶于800 mL 去离子水中,静置后4500 r/min,离心10 min,再次取上清液。向上清液中加入4 倍体积的无水乙醇醇沉,静置12 h 以上,然后4500 r/min,离心10 min,取沉淀。将沉淀复溶于800 mL 去离子水中,Sevag 法(三氯甲烷:正丁醇=4:1)脱蛋白三次。收集多糖溶液层,加入无水乙醇至乙醇终浓度为80%,4500 r/min,离心10 min,取沉淀,真空冷冻干燥得西洋参多糖(WQP)。
西洋参多糖产率计算公式如下:
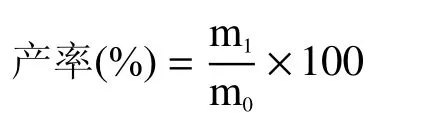
式中:m0表示制备前干燥西洋参质量,g;m1表示制备后干燥西洋参多糖质量,g。
1.2.2 总糖含量测定 采用苯酚-硫酸法测定总糖含量[20]。以0.1 mg/mL 的葡萄糖溶液为标准液,分别量取标准液0、0.1、0.2、0.3、0.4、0.5、0.6 mL 转于试管中,加去离子水补足至总体积1 mL,每个浓度重复三个样品,分别向每只试管中加入6%苯酚溶液0.5 mL,浓硫酸2.5 mL,迅速混合均匀。室温反应30 min,在490 nm 波长下进行扫描。以标准品葡萄糖含量为横坐标,吸光度值为纵坐标绘制标准曲线。
样品液的配制:称取WQP 样品配制为0.1 mg/mL的多糖溶液,取0.6 mL,加去离子水补足至1 mL,后续操作同标准品的处理方法。
1.2.3 糖醛酸含量测定 采用D-半乳糖醛酸作为标准品,间羟基联苯法测定糖醛酸含量[20]。以0.1 mg/mL的D-半乳糖醛酸为标准液,分别量取标准液0、0.05、0.1、0.2、0.3、0.4 mL 转于玻璃试管中,加去离子水补至0.4 mL,每个浓度重复三个样品,分别向每只试管中加入氨基磺酸试剂40 μL,摇匀,再加入浓硫酸2.5 mL,迅速混合均匀。沸水浴反应20 min,冷却至室温后,再加入间羟基联苯试剂40 μL,充分振荡均匀,室温放置15 min,在550 nm 波长下测定吸光度A。以D-半乳糖醛酸含量为横坐标,吸光度值为纵坐标绘制标准曲线。
样品液的配制:称取WQP 样品配制为0.1 mg/mL的多糖溶液,取0.4 mL,后续操作同标准品的处理方法。根据标准曲线和样品浓度计算WQP 中的糖醛酸含量。
1.2.4 蛋白质含量测定 采用杜马斯燃烧法测定蛋白质含量[21]。准确称取WQP 干粉样品,用锡箔纸包好,压缩空气制样完成后,置于自动进样盘里,在燃烧反应器温度1020 ℃以上、还原反应器温度650 ℃以上、氦气(纯度≥99.99%)压力2 bar 以上、氧气(纯度≥99.99%)压力2.5 bar 以上、氮气(纯度≥99.99%)压力达到3 bar 以上时自动进样检测。WQP 样品做3 个平行检测,结果取平均值。
1.2.5 单糖组成测定 样品的制备:采用PMP 衍生-高效液相色谱法(PMP-HPLC)对WQP 样品的单糖组成进行测定[20,22−24]。称取2 mg 多糖样品,进行完全酸水解,加入2 mol/L 盐酸甲醇溶液0.5 mL,充N2封管,80 ℃水解16 h,空气吹干后,加入2 mol/L三氟乙酸0.5 mL,120 ℃水解1 h,然后移入蒸发皿,45 ℃水浴,反复加无水乙醇赶除三氟乙酸后干燥。向水解后的单糖样品中加入PMP 试剂和0.3 mol/L的NaOH 溶液各0.5 mL,充分溶解后取0.1 mL 水浴70 ℃反应30 min 进行衍生化,衍生完毕后,加入0.3 mol/L 的HCl 0.05 mL,充分混匀,之后用三氯甲烷萃取3 次,除去PMP。过0.22 μm 的微孔滤膜转移至液相瓶待检测。
标准品制备:分别称取2 mg 单糖进行衍生化,处理方法同多糖样品。
色谱条件:Hypersil ODS2 C18色谱柱(4.6 mm×250 mm,5 μm);流动相为0.1 mol/L 82%磷酸盐缓冲溶液(pH7)和18%乙腈(v/v);检测波长245 nm;进样量20 μL;流速为1.0 mL/min。
1.2.6 动物实验方案及样品收集 实验动物在室内温度为(22±2)℃,相对湿度为55%±5%的饲养环境中,给予充分的进食和饮水。实验过程中严格遵守中国农业科学院特产研究所实验室动物实验标准与管理条例。
大鼠适应实验环境3 d 后,将24 只大鼠随机分为4 组(6 只/组),分别为正常组(C)、抗生素相关副作用组(DM)、自然恢复组(NR)和WQP 干预组(WQP)。DM 组、NR 组和WQP 组大鼠每天上午8:00 和下午16:00 灌胃克林霉素磷酸酯(750 mg/kg),连续灌胃5 d。C 组给与等量生理盐水。第6 d,DM 组大鼠异氟烷麻醉。采集血液,1500 r/min 离心10 min,收集血清。打开腹腔,预冷的生理盐水冲洗,取盲肠至肛门处肠段。生理盐水冲洗肠腔,取结肠组织中间段5~8 cm,10%中性福尔马林溶液中固定。无菌条件下取粪便样本(>0.5 g)于无菌冻存管中,−80 °C 冰箱备用。实验结束后大鼠在安乐死箱中安乐死。从第6 d 开始,WQP 组的大鼠灌胃WQP(100 mg/kg),每日两次,连续灌胃7 d。C 组和NR 组给与等量生理盐水。末次给药12 h 后采集各组大鼠的血清和组织标本,处理方式与DM 组相同。
1.2.7 一般情况观察 实验期间每日定时观察并记录大鼠的体重变化、精神状态和腹泻情况,评估大鼠腹泻的严重程度并进行评分,评分标准[25]见表1,最后统计各组大鼠得分总和。

表1 腹泻情况评分标准Table 1 Diarrhea scoring criteria
1.2.8 大鼠结肠组织学结构观察 将固定在10%中性福尔马林溶液中的结肠组织取出放于包埋盒中,经酒精脱水、透明、浸蜡、包埋、横断切片(厚5 μm)、贴片和烤片等步骤得到切片,随后进行常规HE 染色,然后封片,晾干后利用奥林巴斯荧光显微镜进行观察拍照。
1.2.9 大鼠肠道细菌总DNA 提取和Illumina 高通量测序 细菌基因组总DNA 样本的提取使用粪便DNA 提取试剂盒,将提取的DNA 于−20 ℃保存备用。采用超微量分光光度计对DNA 进行定量,并通过1.2%琼脂糖凝胶电泳检测DNA 提取质量。对细菌16S rRNA 的V3~V4 区进行PCR 扩增,前引物338F(5'-ACTCCTACGGGAGGCAGCA-3'),后 引物806R(5'-TCGGACTACHVGGGTWTCTAAT-3')。扩增产物进行2%琼脂糖凝胶电泳后切下目的基因条带,DNA 凝胶回收试剂盒回收PCR 扩增产物,并对PCR 扩增回收产物进行荧光定量,根据荧光定量结果,按照每个样本的测序量需求,对各样本按相应比例进行混合。利用Illumina 公司的TruSeq Nano DNA LT Library Prep Kit 制备测序文库。采用Quant-iT PicoGreen dsDNA Assay Kit 在Promega QuantiFluor荧光定量系统上进行定量,对合格的文库上机进行高通量测序。大鼠粪便样本送到上海派森诺生物科技有限公司,基于16S rRNA 测序进行肠道菌群多样性分析。
1.2.10 生物信息学和统计分析 主要采用 QIIME2(2019.4)软件和R 软件(v3.2.0)进行序列数据分析。对获得的序列按相似度进行归并、ASV(amplicon sequence variants)/OTU(operational taxonomic units)划分和聚类分析。根据ASV 特征序列/OTU 代表序列聚类的稀疏曲线,分析计算α多样性指数中的Shannon 指数以比较样品间的丰富度与均匀度。对不同处理组菌群的β多样性进行主坐标分析(principal coordinates analysis,PCoA),以描述样本间的自然分布特征。
1.3 数据处理
采用GraphPad Prism 5.0 和SPSS24.0 对本文各组数据进行ANOVA(Tukey test)分析,P<0.05 认为有统计学意义,试验数据结果以平均值±标准差表示。
2 结果与分析
2.1 WQP 的产率及单糖组成
以西洋参根干品计,WQP 的产率为6.71%,总糖含量为85.2%,糖醛酸含量31.9%,蛋白质含量2.1%。单糖组成分析结果见图1,WQP 主要由葡萄糖Glc(33.2%)、半乳糖Gal(8.9%)、阿拉伯糖Ara(12.2%)和半乳糖醛酸GalA(43.9%)组成,还含有少量的鼠李糖Rha(1.8%)。
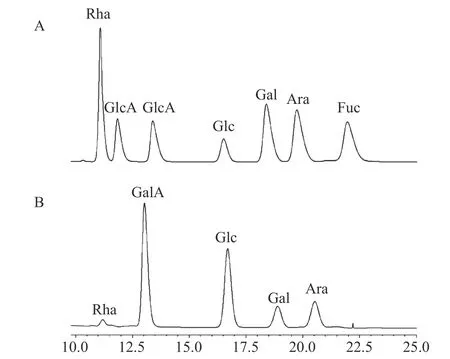
图1 HPLC 单糖组成分析Fig.1 Monosaccharide composition analysis by HPLC
2.2 对大鼠一般情况的影响
克林霉素磷酸酯灌胃3 d 后,大鼠开始出现不同程度的腹泻,表现为活动减少、不活泼、精神状态不佳、饮水量增加、排便次数增多等症状,并随给药时间延长而加重,严重者可见肛门处红肿并有少量稀粪便黏附。克林霉素磷酸酯灌胃第4~5 d,所有模型动物均出现严重腹泻,粪便变为明显的稀湿软,精神萎靡,表明已成功建立了腹泻模型,见图2。第6 d 开始进行自然恢复或WQP 干预,随着给药时间延长,NR 组和WQP 组大鼠腹泻有所缓解。到给药第7 d,WQP 组大鼠无腹泻情况出现;NR 组仍有个别大鼠出现腹泻。从腹泻情况评分来看,NR 组腹泻恢复情况不如WQP 组恢复情况明显。
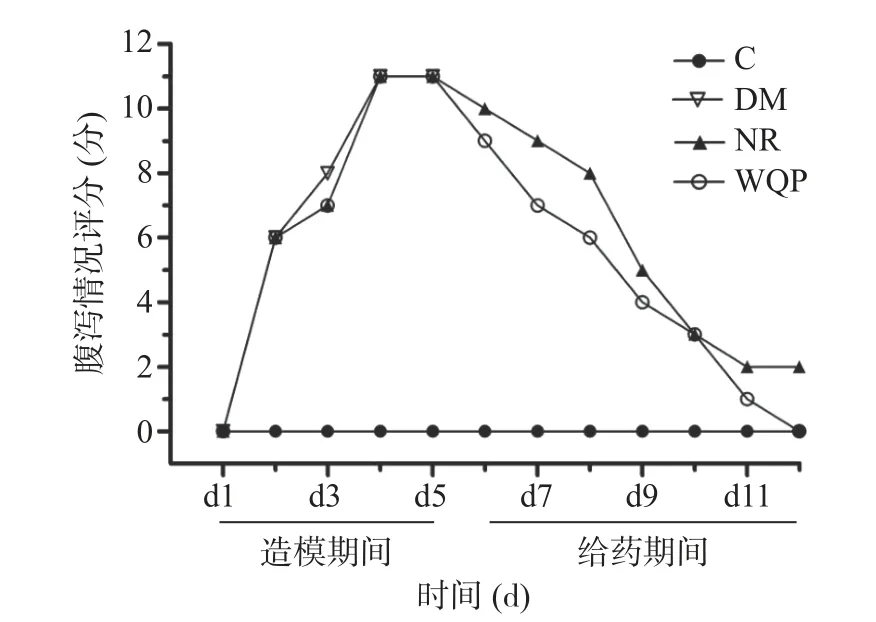
图2 大鼠腹泻情况评分Fig.2 Diarrhea scores of rats
2.3 结肠组织的病理学结构分析
各组结肠切片见图3。C 组大鼠结肠结构完整,肠黏膜上皮表面的微绒毛排列整齐,杯状细胞丰富。DM 组大鼠的结肠绒毛变短、稀疏,上皮细胞排列紊乱,绒毛间质水肿现象明显,隐窝变浅。NR 组大鼠结肠结构较DM 组稍有恢复。与NR 组相比,WQP组大鼠的结肠结构恢复情况良好,肠绒毛排列更为修长、整齐、致密,隐窝加深,绒毛间质水肿现象减弱,杯状细胞数量增加,整体与C 组大鼠结肠结构非常接近。因此,WQP 可以改善克林霉素磷酸酯所造成的结肠组织损伤,恢复肠道结构完整性。
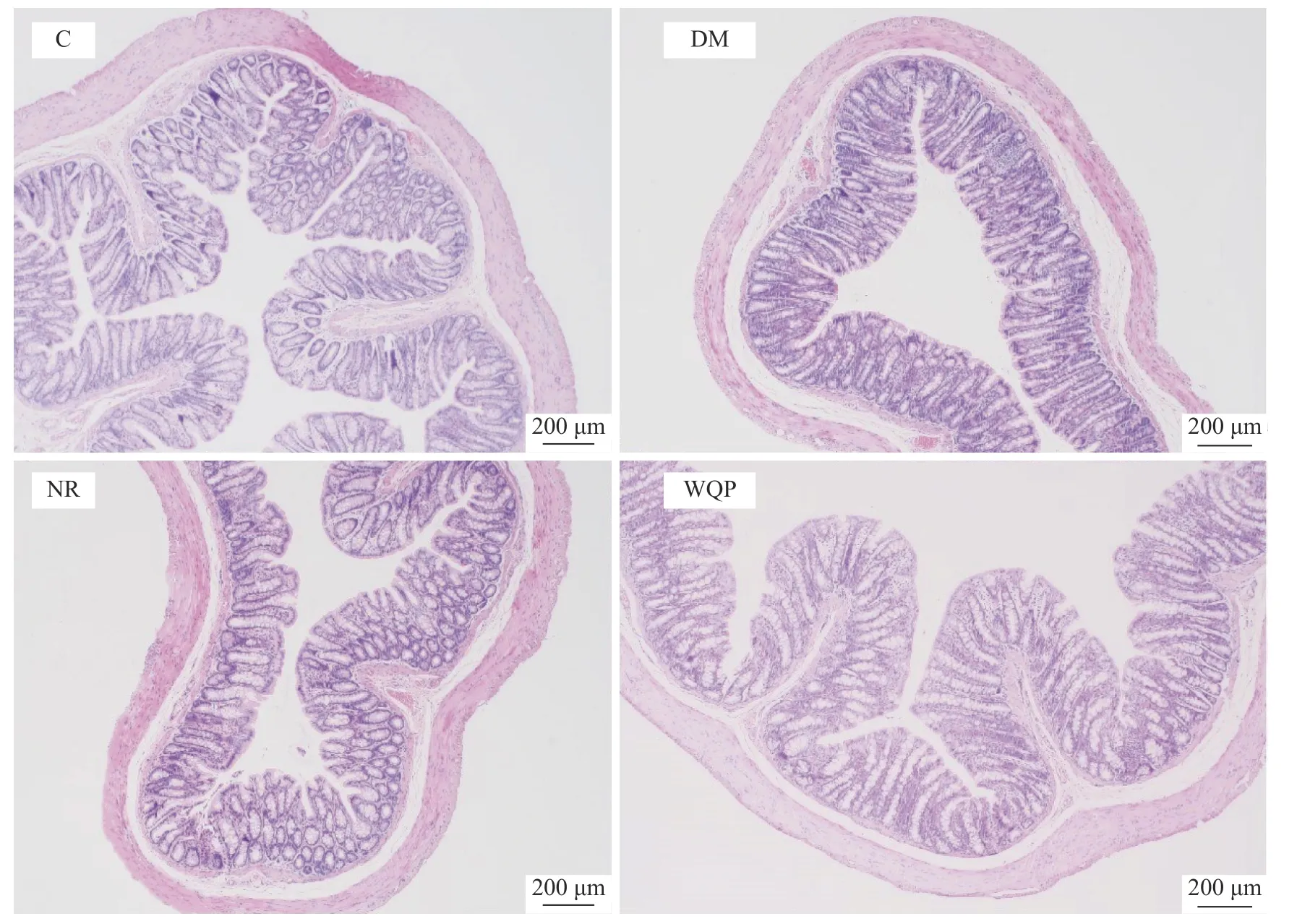
图3 结肠组织结构的变化(HE,×40)Fig.3 Histopathology observation of colon structure (HE,×40)
2.4 肠道菌群多样性及组成
2.4.1α和β多样性分析 各组大鼠肠道中的细菌16S rRNA 测序后,对获得的序列进行归并和ASV/OTU 划分。使用QIIME2 软件分析,α多样性指数中Shannon 指数值越高,表明群落的多样性越高。对不同处理组菌群的Shannon 多样性指数进行分析,结果见图4A。与C 组相比,DM 组的Shannon多样性指数高度显著降低(P<0.001)。经过自然恢复或WQP 干预后,肠道菌群的丰富度和多样性显著恢复(P<0.05)。使用R 软件对不同处理组菌群的β多样性进行PCoA 分析,结果见PCoA 主坐标分析二维排序图4B。基于Unweighted Unifrac 算法的PCoA分析表明,DM 组样本与C 组代表样本的点明显分开,表明造模后大鼠的肠道菌群结构发生显著改变。NR 组和WQP 给药组大部分代表样本的点聚集在一起,说明菌群组成和结构比较相似。
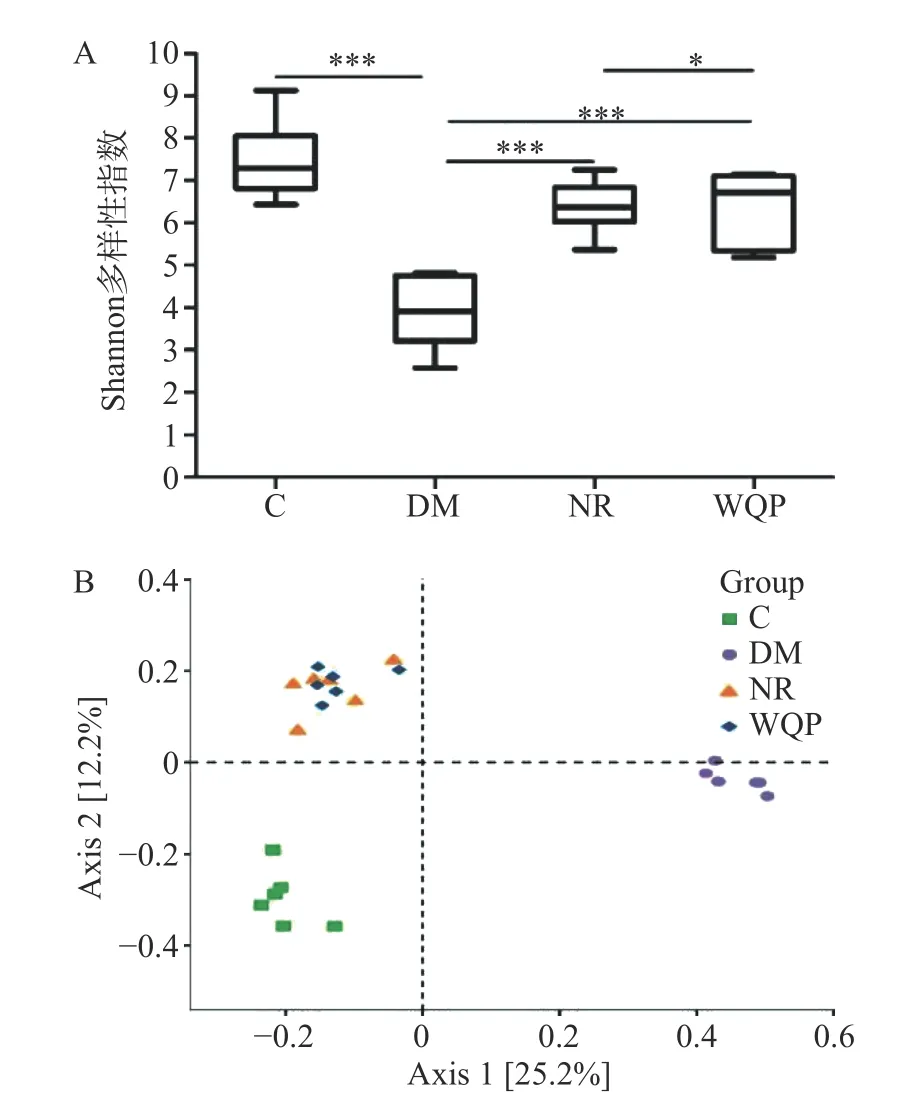
图4 肠道菌群α 和β 多样性分析Fig.4 α and β Diversity analysis of the gut microbiota
2.4.2 肠道菌群的组成分析 16S rRNA 测序后,根据ASV/OTU 划分和分类地位鉴定结果,分析了门水平肠道菌群(相对丰度>1%)的相对丰度变化,见图5。不同处理组肠道菌群组成的相对丰度发生了显著的变化。结果表明,在门水平上,各组大鼠肠道菌群主要由厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和变形菌门(Proteobacteria)等组成,其中厚壁菌门占比最多,其次是拟杆菌门。与C 组相比,灌胃克林霉素磷酸酯后,DM 组大鼠的拟杆菌门的相对丰度增加;厚壁菌门和变形菌门的相对丰度减少。经过自然恢复或干预后,与NR 组相比,WQP 可降低厚壁菌门和变形菌门的相对丰度,增加拟杆菌门的相对丰度,且在门水平上的组成更接近C 组。
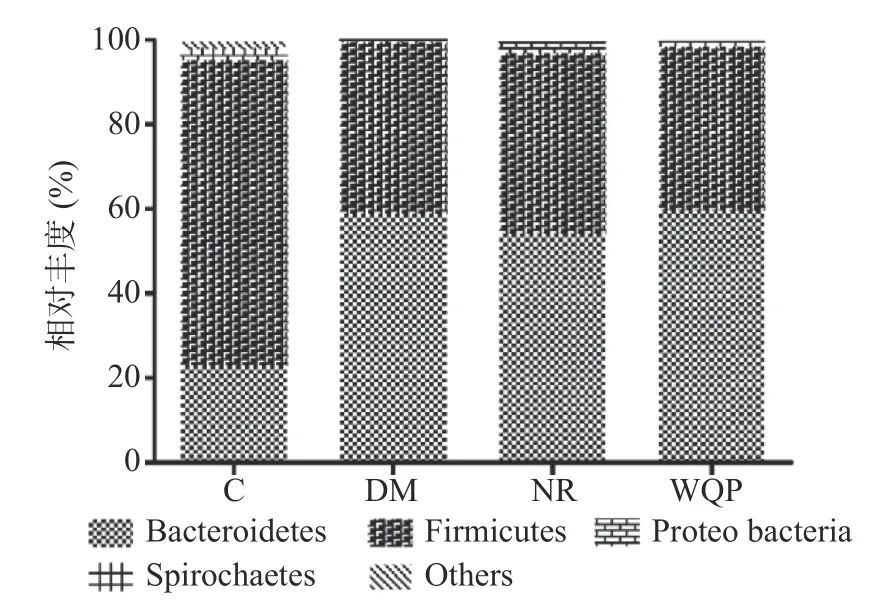
图5 肠道菌群在门水平上的相对丰度及组成Fig.5 Relative abundance and composition of gut microbiota at phylum level
对大鼠肠道菌群中相对丰度>1%的菌属进行分析,结果见图6 和图7。属水平上,大鼠的肠道菌群主要由拟杆菌属(Bacteroides)、乳杆菌属(Lactobacillus)、梭菌属(Clostridium)、布劳特氏菌属(Blautia)、颤螺旋菌属(Oscillospira)、粪球菌属(Coprococcus)和萨特氏菌属(Sutterella)等组成。与C 组相比,DM 组拟杆菌属、梭菌属的相对丰度高度显著增加(P<0.001)。NR 和WQP 组肠道菌群组成均较DM 组有一定的恢复,拟杆菌属、梭菌属的相对丰度降低。与NR 组相比,WQP 显著降低拟杆菌属、梭菌属的相对丰度(P<0.05)。
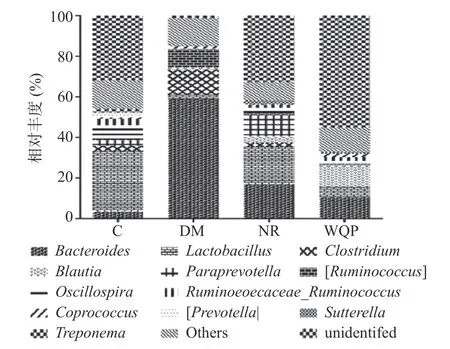
图6 肠道菌群在属水平上的相对丰度及组成Fig.6 Relative abundance and composition of gut microbiota at genus level
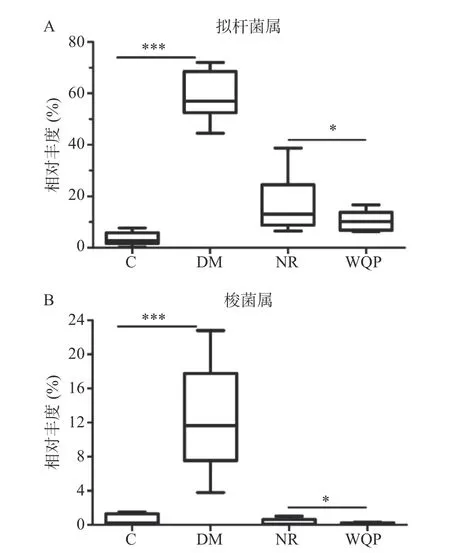
图7 肠道菌群中拟杆菌属和梭菌属的相对丰度变化Fig.7 Changes of relative abundance of Bacteroides and Clostridium in the gut microbiota
3 讨论与结论
抗生素常用来治疗感染、炎症等疾病,AAD 是抗生素治疗期间的主要副作用之一,与肠道菌群失调,炎症和肠道结构变化有关[26−27]。研究采用克林霉素磷酸酯诱导的腹泻模型来考察西洋参多糖对抗生素相关副作用,尤其是腹泻和肠道菌群失调的作用。肠道是营养物质吸收的主要场所,而营养物质的吸收和利用情况是由肠绒毛[28]的状态决定的,一般情况下,肠绒毛的长度与吸收能力呈正相关。通过研究发现,DM 大鼠的结肠结构明显受损,肠绒毛变短,杯状细胞数量减少,肠隐窝变浅,整个结肠呈现疾病相关的状态。利用WQP 干预后,能够很好的修复受损的肠道结构,促进肠绒毛长度和密度的增加,恢复杯状细胞数量,隐窝加深,结肠的结构也与C 组大鼠更为相似。结合WQP 对大鼠腹泻情况评分的影响,可以发现,WQP 能够有效抑制抗生素所引起的腹泻和肠道结构损伤等副作用。
肠道菌群失调与腹泻状态密切相关。抗生素本身又对菌群具有一定的清除作用,因此本文还考察了WQP 对肠道菌群多样性和组成的影响。结果表明,WQP 能够恢复菌群多样性,促进菌群结构修复至正常状态。门水平和属水平上,肠道菌群组成均发生了一定的变化。抗生素干预后,大鼠肠道菌群多样性下降,厚壁菌门的比例下降,这与以往的研究结果一致[29]。门水平上,经过恢复或干预后,与NR 组相比,WQP 组可降低厚壁菌门、变形菌门和放线菌门的相对丰度,增加拟杆菌门的相对丰度,且在门水平上的组成更接近正常大鼠。属水平上,与C 组相比,DM组大鼠拟杆菌属、梭菌属相对丰度显著增加;与NR 组相比,WQP 给药组显著降低拟杆菌属、梭菌属的相对丰度。拟杆菌属是人和鼠肠道中的正常菌群之一,其含量一般比较稳定[30],正常情况下在宿主的免疫、营养、代谢等方面起重要作用,可改善其肠道环境,但也是一种潜在的致病菌[31−32]。条件致病菌在正常情况下不致病,参与调节宿主正常的生理功能,但在抗生素干扰后会使机体菌群失调,导致腹泻等症状[33]。拟杆菌属、梭菌属是人和鼠肠道内主要的条件致病菌[34−35],抗生素干扰后,拟杆菌属、梭菌属的相对丰度急剧上升,加重了腹泻情况,而WQP 干预可有效降低两种菌的相对丰度。因此,WQP 对克林霉素磷酸酯所造成副作用的缓解,可能与其降低条件致病菌的含量有关。
据报道多糖能够与肠道菌群[36]相互作用,并调节肠道菌群的组成、结构和功能。研究发现,与模型组相比,硒化香菇多糖能够提高慢性胰腺炎小鼠拟杆菌门的相对丰度,降低厚壁菌门的相对丰度,同时能提高拟杆菌属等的相对丰度,调节肠道菌群[37]。葛根多糖能够改善抗生素相关性腹泻小鼠的肠道菌群失调问题[11]。水溶性紫薯多糖能够调节肠道炎症引起的菌群多样性降低,使结肠炎模型小鼠肠道菌群恢复到接近正常水平[38]。竹荪多糖对结肠炎和炎症相关疾病具有潜在的治疗作用[39]。因此,许多多糖可以对肠道菌群起到积极的调节作用。但目前还未见西洋参多糖与克林霉素磷酸酯或其它类型的抗生素相互作用的文献报道。本课题组前期研究了人参多糖及其子级份[8,20,25]、五味子多糖[9]、黄芪多糖[10]等在盐酸林可霉素诱导的肠道菌群紊乱中的作用,并且对肠道的结构、菌群的多样性和组成都有一定的恢复效果。其中,人参多糖能够提高抗生素相关性腹泻小鼠厚壁菌门的相对丰度,降低拟杆菌门、变形菌门和放线菌门的相对丰度[8]。五味子多糖通过提高腹泻大鼠拟杆菌门和变形菌门的相对丰度,显著降低厚壁菌门的相对丰度,来改善腹泻大鼠的症状[9]。黄芪多糖能够增加厚壁菌门的相对丰度,降低拟杆菌门和变形菌门的相对丰度,并通过调节肠道菌群的丰富度和多样性来改善AAD 大鼠的腹泻状态[10]。一方面肠道菌群能够降解多糖,促进机体对其吸收和利用;另一方面多糖能够通过增加有益菌,减少有害菌调节肠道菌群的组成,从而改善机体的健康水平[40]。不同的多糖对肠道菌群有不同的影响,这可能与其单糖组成、精细结构和空间构象的差异有关。本研究中与DM 组相比,WQP 组可降低厚壁菌门的相对丰度,增加拟杆菌门的相对丰度,门水平上这一结果与五味子多糖的研究一致。西洋参多糖WQP 对由抗生素引起的紊乱的肠道菌群具有一定的恢复、平衡和重建的作用,可以促进拟杆菌属、梭菌属减少,表明WQP 可能是通过调节肠道菌群来改善抗生素致腹泻大鼠的肠道菌群。虽然西洋参多糖、人参多糖、五味子多糖、黄芪多糖或其他来源的多糖对肠道菌群的平衡机制还有待进一步研究,但我们的研究结果可为类似研究提供一些数据和理论参考。
尽管西洋参多糖对克林霉素磷酸酯所诱导的肠道菌群紊乱起到了一定的调节作用,但也必须看到,本文的结果具有一定的局限性。本文测序结果中,C 组、NR 组和WQP 组有部分序列鉴定不到属水平,其中一部分序列属于肠杆菌科,另一部分无法确定到属水平,这可能是由于序列片段长度有限,所能携带的信息有限,再加上目前我们物种注释采用的算法比通用的blast 更严格,准确率更高,这就使得在属水平上的鉴定结果偏少。在以后的研究工作中,我们将会采用更深度的测序方法,来弥补这一研究手段的不足。
综上所述,WQP 的产率为6.71%,总糖含量为85.2%,糖醛酸含量为31.9%,蛋白质含量为2.1%,主要由半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖组成,还含有少量的鼠李糖。动物实验表明,WQP 可通过促进AAD 大鼠肠道结构恢复,改善肠道菌群丰富度和多样性,对克林霉素磷酸酯所造成的腹泻、肠壁结构破坏及菌群失调等症状产生改善作用。

