磷酸酯键基智能响应体系在生物医学领域的研究进展
虞铭璐,夏鹏飞,尹静波
(上海大学材料科学与工程学院,上海 200444)
磷酸酯键在体内参与核酸、三磷酸腺苷(ATP)、还原型辅酶I (NADH)和细胞膜磷脂双分子层合成,是人体内的一种重要化学键,合成机理包括磷酸或磷酰氯与醇的酯化反应[1,2]。其中,磷酸与醇的酯化反应活性较低,加入浓硫酸、2,6-二叔丁基对甲酚(BHT)[3]等催化剂可提高其反应效率。磷酰氯与醇的酯化反应活性高,是磷酸酯键的有效合成途径。
Fig.1 列举了磷酸酯键的结构稳定性、生物可降解性和酶响应性等性质。磷酸酯键在体内键合核苷酸合成核酸大分子时表现出高度的稳定性,保证了作为遗传物质的核酸的结构稳定性[4]。磷酸酯键具有水解放热的能力,在体内参与ATP 形成,通过磷酸酯键断裂释能可实现ATP 为生命活动供能的目的[5]。磷酸酯键具有一定的亲水性,参与细胞膜磷脂双分子层形成,发挥控制细胞内外物质交换的作用[6]。将磷酸酯键引入疏水性药物可改善药物的水溶性,提高疏水性药物的细胞摄入效率。此外,磷酸酯键可提高疏水材料的亲水性,有利于细胞黏附[7]。
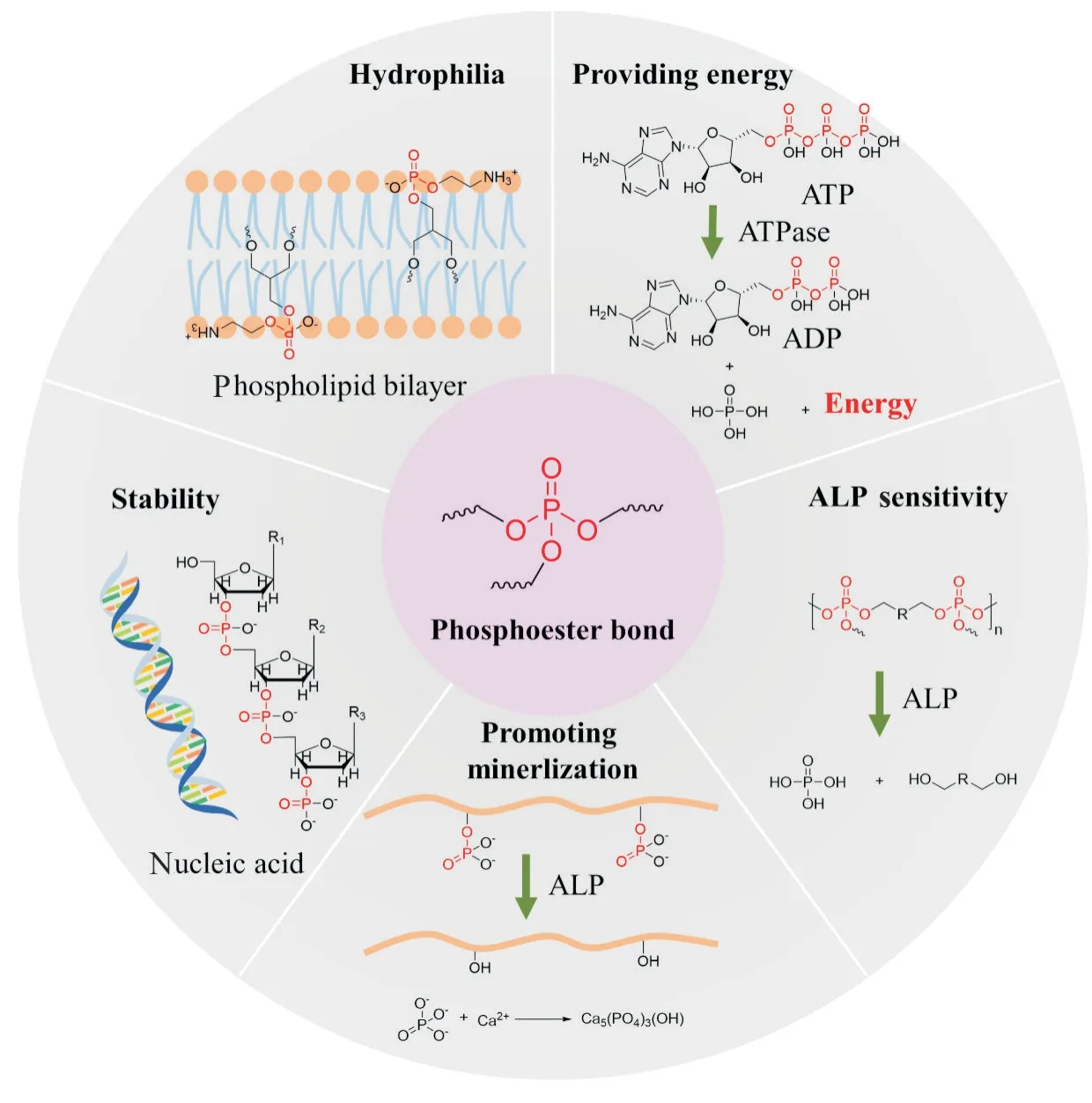
Fig. 1 Properties of phosphate ester bond
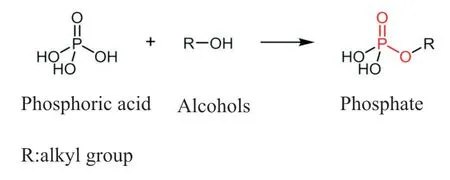
Fig. 2 Esterification reaction of phosphoric acid and alcohols
值得一提的是,磷酸酯键具有酶响应性,在碱性磷酸酶(ALP)催化作用下高效断裂,成为一种新型的智能响应“开关”[8]。研究者们将含磷酸酯键的聚合物制备成纳米粒子[9]等材料,装载药物后用于细菌感染治疗,磷酸酯键在细菌分泌的ALP 作用下断裂,实现细菌触发的药物控制释放,达到良好的抗菌效果并提高药物利用率。针对肿瘤微环境中过表达的ALP[10],可利用含磷酸酯键的聚合物胶束[11]等材料作为药物载体,实现化疗药物的靶向递送,为肿瘤治疗提供一种有效策略。
磷酸酯键还可用于调控材料的降解速率[12],实现材料降解周期与组织生长周期相匹配。水凝胶功能化的磷酸酯键被证实可以响应成骨细胞分泌的ALP 而断裂,实现水凝胶降解速率的调控,为新骨生长提供充足的空间。此外,磷酸酯键断裂产生的磷酸根能促进生物矿化[13]、促进骨再生和骨整合[14]。
1 磷酸酯键合成机理
磷酸酯键的合成机理为磷酸或磷酰氯与醇的酯化反应。
1)磷酸与醇的酯化反应
Fig.2 是磷酸与醇的酯化反应式,通过磷酸脱羟基及醇脱氢的反应机理合成磷酸酯键[15]。该反应活性较低,需要使用浓硫酸和BHT 等为催化剂。Brendan 等[3]以侧链含有磷酸基团的丙烯酸酯类聚合物为基础,在BHT 催化作用下通过磷酸酯键成功键合了甲基丙烯酸缩水甘油酯。
2)磷酰氯与醇的酯化反应
磷酰氯反应活性高,是合成磷酸酯键的重要反应物之一。1936 年,Arvin 首次发表了由双酚A 与磷酸二酰氯酰化缩合得到聚磷酸酯的专利,证实了磷酰氯与醇发生酯化反应合成磷酸酯键的可行性。Fig.3 是磷酰氯基团与醇羟基的酯化反应式,通过酰氯的醇解形成磷酸酯键。副产物盐酸会降低反应活性,加入碱作为缚酸剂可提高反应效率。此外,通过三氯氧磷或磷酸二酰氯与多元醇酯化反应,可以实现链增长获得支化结构[16](Fig.4)。Yao等[11]通过磷酰氯与醇羟基的缩聚反应获得了含磷酸酯键的超支化聚磷酸酯。Du 等[17]以2-羟基乙基丙烯酸酯和二氯磷酸乙酯为原料,吡啶作为缚酸剂获得了含有磷酸酯键的丙烯酸酯类化合物。
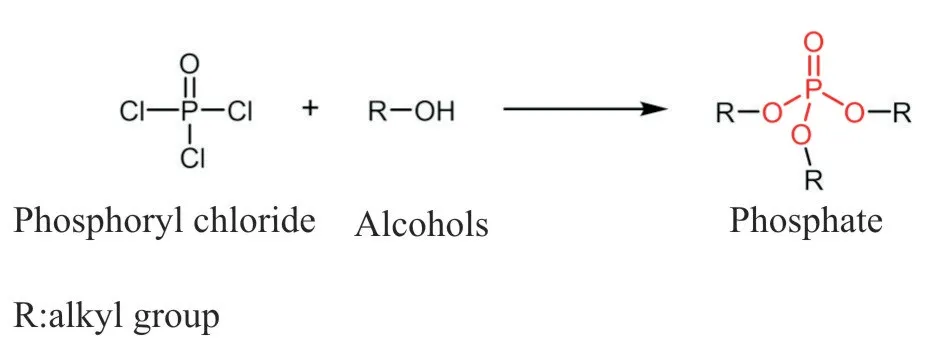
Fig. 3 Esterification reaction of phosphoryl chloride with alcohols
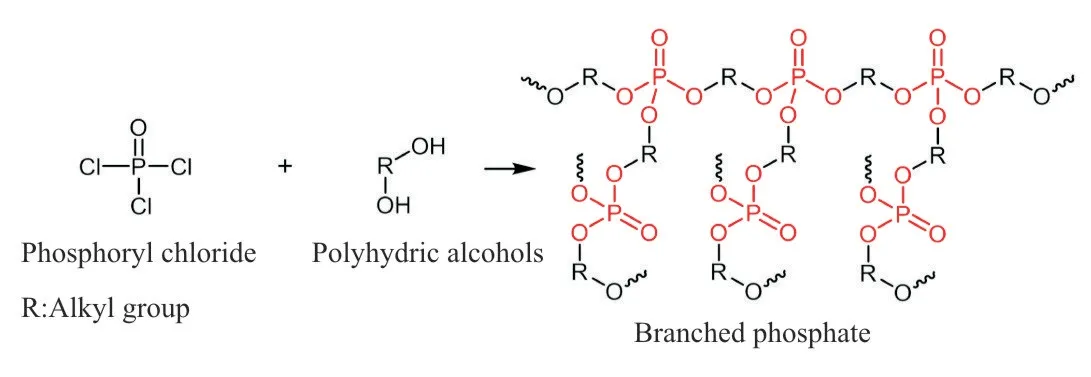
Fig. 4 Esterification reaction of phosphoryl chloride and polyhydric alcohols
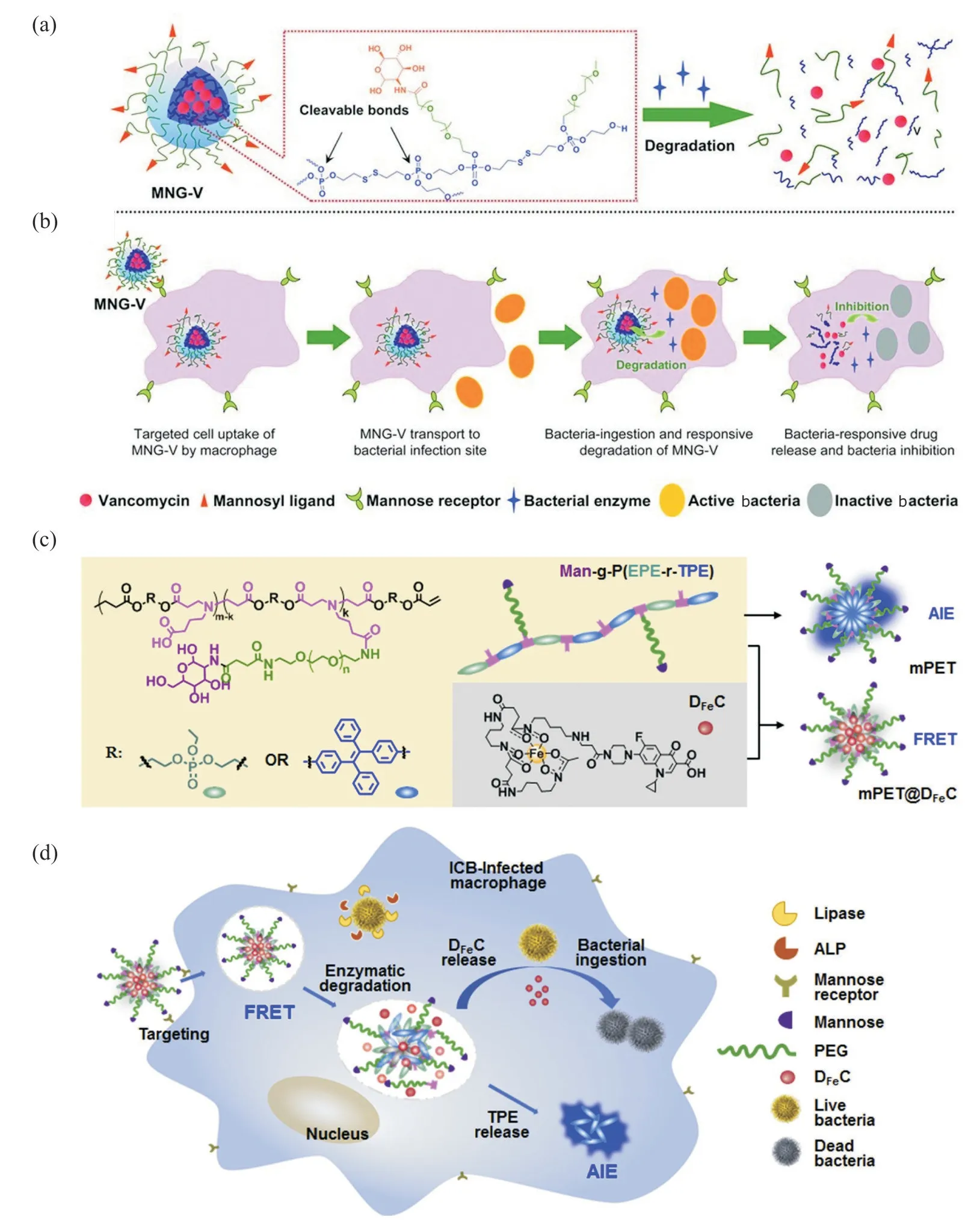
Fig. 5 Application of phosphate ester bond-based intelligent response system in antibacterials
对比分析2 种合成机理,磷酰氯与醇的酯化反应活性比磷酸与醇的反应更高,且可以通过调节活性基团比例设计不同的分子结构,如支化结构等,因而是合成磷酸酯键的有效策略。
2 磷酸酯键基智能响应体系应用
磷酸酯键由于具有智能响应ALP 并快速断裂的优势,在细胞培养、组织修复、药物控释及生物探针等领域已获得广泛应用,具有巨大研究价值。Tab.1 对磷酸酯键基智能响应体系在生物医药领域的研究进展进行了汇总。
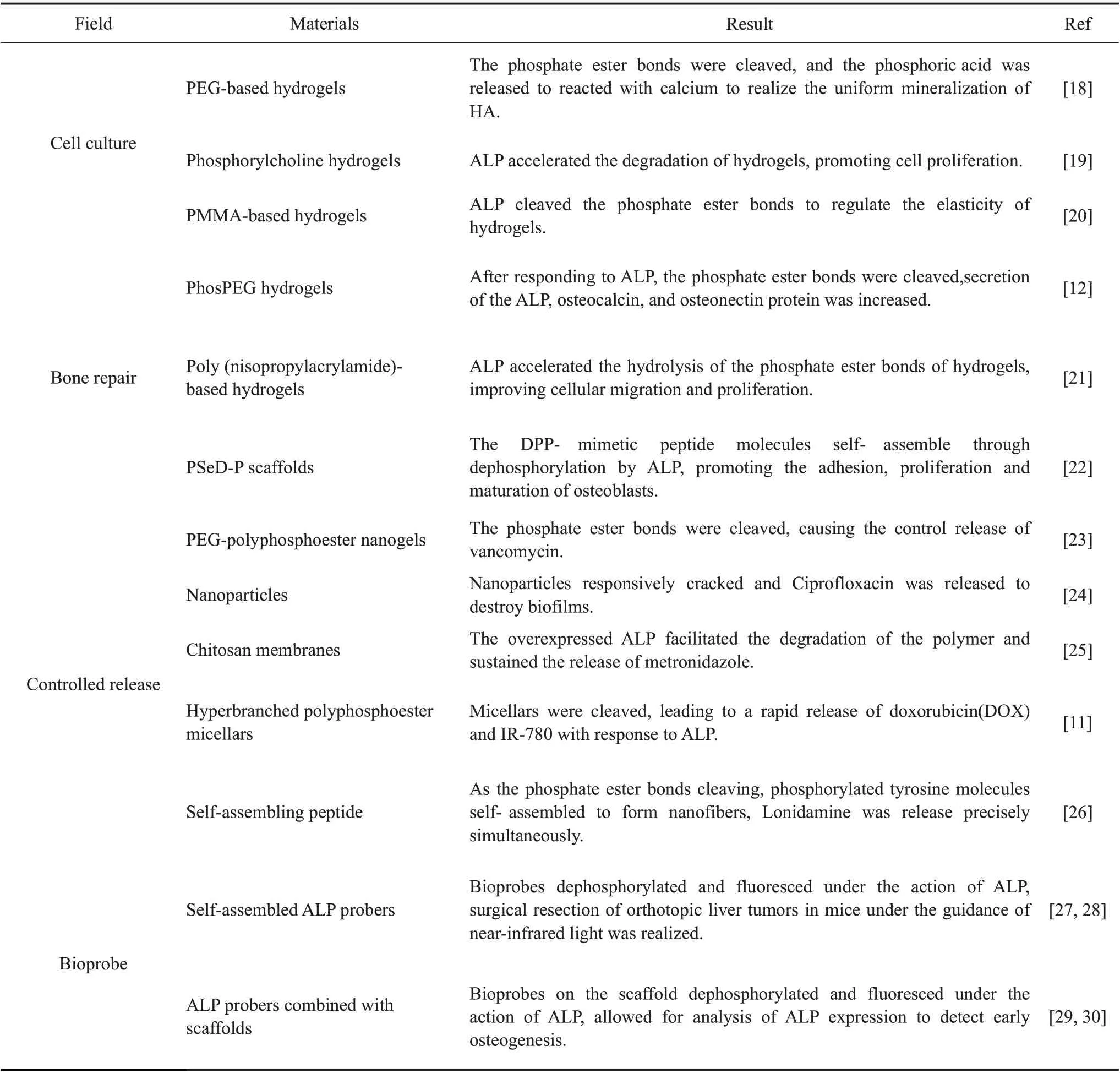
Tab. 1 Research progress of phosphate ester bond-based intelligent response system in biomedical field
2.1 用于细胞培养
细胞增殖和分化是细胞培养的重要环节。含磷酸酯键的水凝胶可在细胞分泌的ALP 催化作用下降解,一方面为细胞扩增提供空间,促进细胞增殖;另一方面降低水凝胶模量,促进细胞黏附和分化[31]。
Gaihre 等[18]提出了一种通过水凝胶生物矿化促进细胞分化的策略。由三氯氧磷和醇羟基的酯化反应获得含磷酸酯键的PEG 水凝胶,磷酸酯键在ALP 处理后断裂并产生磷酸根,进而结合钙离子并生成羟基磷灰石,使水凝胶均匀矿化。此外,该PEG 基生物矿化水凝胶能促进MC3T3-E1 细胞黏附和增殖。
Wachiralarpphaithoon 等[19]通过开环聚合获得了含磷酸酯键的丙烯酰氧基共聚物,并制备水凝胶。该水凝胶含有大量磷酸酯键,随着水凝胶接种的细胞密度上升,水凝胶中的磷酸酯键在细胞分泌的ALP 的作用下断裂并加速水凝胶降解,为细胞生长提供必要空间,达到了加速细胞增殖的效果。
Toda 等[20]通过自由基聚合法制备了含磷酸酯键的丙烯酰胺基水凝胶,磷酸酯键在ALP 作用下断裂,导致水凝胶的弹性模量下降,水凝胶上黏附的MSCs 骨架变为细长状,并有效上调了Runx2 等成骨基因的表达水平。
2.2 用于骨修复
含有磷酸酯键的生物材料一方面可调控材料的降解速率,为骨组织的生长发育提供充足空间,一方面可释放利于基质矿化的磷酸,因而在骨组织再生领域具有重要应用价值。
Wang 等[12]合成了一种磷酸酯键基聚乙二醇(PhosPEG)水凝胶,用于包埋MSCs。该水凝胶中含有大量磷酸酯键,可在ALP 催化下加速裂解。在成骨培养基中,PhosPEG 水凝胶矿化程度显著大于PEG 水凝胶。Watson 等[21]合成了侧链含磷酸酯键的甲基丙烯酸酯类共聚物,在生理温度下可热引发交联形成水凝胶。磷酸酯键在骨细胞产生的ALP 作用下断裂,从而加速水凝胶局部降解,并提高了酶促降解区的细胞增殖和迁移。
将磷酸酯键整合到聚合物中,可模仿磷酸基团在天然组织中的作用[22],有利于钙沉积,并促进骨组织再生。Huang 等[22]制备了一种含有磷酸酯键的聚甘油葵二酸酯(PSeD-P)多孔支架,PSeD-P 中的磷酸酯键能够模仿天然含磷分子结构,并具有生物活性。另外,PSeD-P 支架上修饰的磷酸酯键还键合了骨诱导组分——β-甘油磷酸(β-GP),其在降解过程中缓慢释放,有利于干细胞的分化和矿化。
牙本质磷蛋白(DPP)是牙本质基质的重要组成部分,对骨矿化过程的羟基磷灰石沉积起至关重要的作用[32],是骨和牙齿再生的主要候选材料。Gulseren 等[33]介绍了一种含有类似DPP 结构的酶响应性肽纳米纤维体系,其中磷酸酯键在ALP 作用下断裂,使其自组装形成凝胶。此外,磷酸酯键断裂产生的磷酸基团能促进磷灰石样矿物沉积,促进骨再生。该体系在设计新型复杂的骨科和牙科支撑材料中具有重要意义。
2.3 用于药物控释
酶响应性药物控释体系能够实现药物在病灶区的按需释放,并避免药物突释引起的副作用,在临床具有极高的应用价值。磷酸酯键可以响应细菌感染或癌症环境下高表达的ALP 并发生断裂,从而可作为一种智能响应体系“开关”,在药物控释领域受到广泛关注。
Xiong 等[23]报道了一种含磷酸酯键的具有核壳结构的纳米凝胶(Fig.5(A)),该纳米凝胶在甘露糖靶向指引下可进入巨噬细胞,磷酸酯键在细菌分泌的ALP 作用下断裂,触发纳米凝胶内核裂解,实现万古霉素控制释放(Fig.5(B)),有效抑制了耐甲氧西林葡萄球菌的生长。进一步地,Chen 等[24]在含磷酸酯键和抗生素—环丙沙星(CIP)的纳米粒子上功能化了具有细菌识别能力的去铁胺(DFO),磷酸酯键在响应巨噬细胞内ALP 后断裂并触发去铁胺-环丙沙星复合物释放,达到了高效杀菌的目的(Fig.5(C,D))。
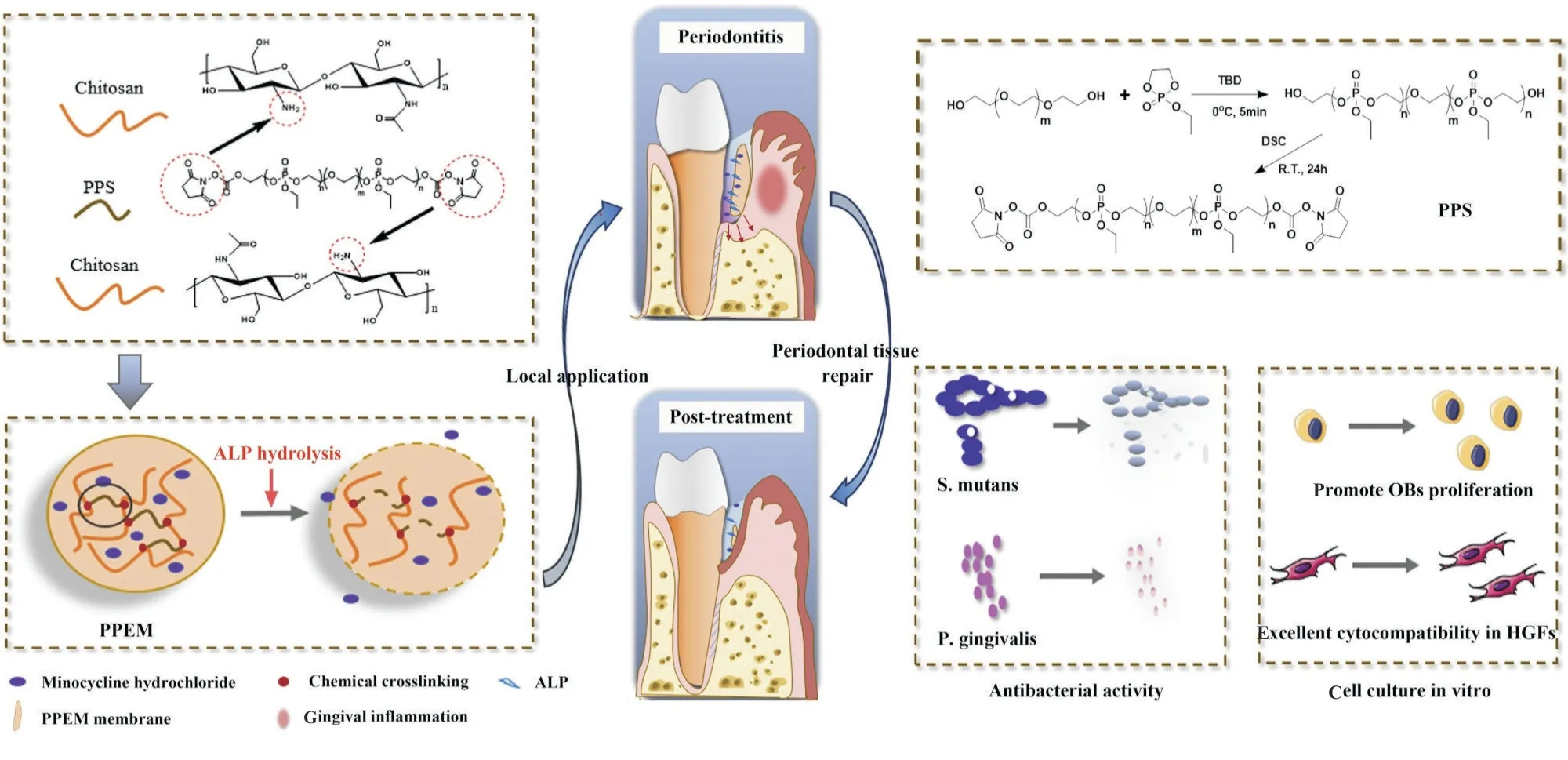
Fig. 6 Schematic illustration of preparation and application of chitosan-based membranes[25]
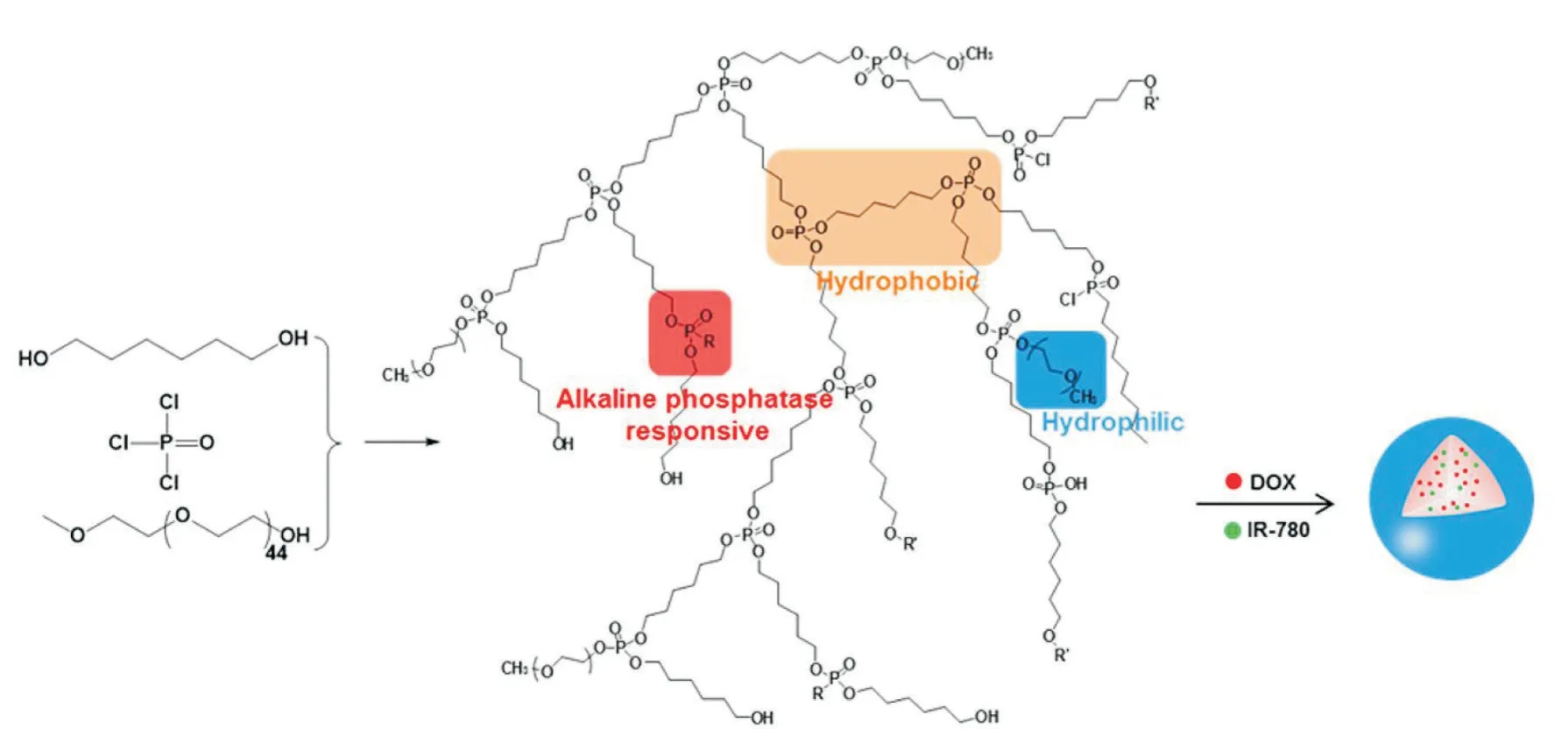
Fig. 7 Illustration of structure of DOX- and IR-780 coloaded hyperbranched polyphosphoester nanomedicines[11]
牙周炎是一种细菌诱导的慢性、破坏性的炎症性疾病,会损伤牙周组织,最终导致牙齿脱落[34,35]。牙周炎发作时,牙周组织中ALP 含量异常升高[36,37]。针对这一特性,Li 等[25]制备了一种含磷酸酯键且负载有抗生素—盐酸米诺环素的壳聚糖膜(Fig.6)。该载药薄膜具有ALP 响应性,一方面可控释盐酸米诺环素,达到牙周炎治疗目的;另一方面可加快壳聚糖膜降解,为牙周炎下的牙槽骨组织缺损修复提供了一种有效策略。
此外,肿瘤环境下也存在ALP 的过度表达,因此,含磷酸酯键的药物控释材料在肿瘤治疗领域也具有应用价值。Yao 等[11]合成了可降解超支化聚磷酸酯(hPPE),并用相分离法制备成胶束,用于抗癌药——阿霉素的递送[Fig.7]。hPPE 中的磷酸酯键受ALP 作用断裂,进而引发了纳米胶束的裂解和阿霉素的释放。Wu 等[26]设计了一种含磷酸化酪氨酸的酶响应自组装分子(LND-p-ES)。通过ALP 催化断裂磷酸酯键实现LND-p-ES 自组装形成纳米纤维,提高了癌细胞摄取纳米纤维的效率,从而达到将化疗药—洛尼达明(LND)靶向送达癌细胞的目的。为了延长药物在肿瘤细胞内的停留时间,Hong 等[38]设计了一种含磷酸酯键的自组装两亲性肽药物递送系统。两亲性肽在负载疏水性化疗药——DOX 后组装成球形载药纳米颗粒,磷酸酯键在ALP 的作用下断裂,使多肽的一级结构发生转变并形成纳米纤维,从而有效释放包裹DOX。该方法提高了肿瘤部位的局部药物积累,在抗肿瘤治疗中的具有潜在应用价值。
2.4 用于生物探针
生物探针是分子生物学和生物化学实验中用于指示特定物质的性质或物理状态的一类标记分子,具有传感、荧光成像等功能[39]。生物探针上修饰的磷酸酯键可在ALP 作用下断裂,引起探针分子亲疏水性或构象转变,从而具备荧光标记特性[40],因而在ALP 高表达的病灶区具有应用价值。
肿瘤环境下ALP 含量异常增高,因而含磷酸酯键的生物探针在肿瘤诊断领域具有应用价值。Ye等[27]在疏水性多肽上连接了含磷酸酯键的近红外(NIR)荧光团P-Cy 和顺磁螯合物DOTA-Gd,得到含磷酸酯键的多肽探针P-CyFF-Gd。磷酸酯键在ALP作用下断裂并触发多肽探针原位自组装并触发荧光反应(Fig.8(A))。该探针具有无创、高灵敏度、高分辨率成像等优势,NIR 引导下可实现肝肿瘤的实时标记。Gao 等[28]合成了由七甲氰荧光团和磷酸单酯构成的NIR 探针QcyP(Fig.8(B))。在ALP 作用下,磷酸酯键断裂,导致共轭π-电子体系的重排,触发了探针的“开关”,可以精准识别肝肿瘤细胞。Zhong 等[41]报道了一种含有发光基团——香豆素和磷酸酯键的多肽衍生物(pYD)(Fig.8(C))。pYD 的磷酸酯键在ALP 作用下断裂,并原位自组装形成发光纳米纤维,实现肿瘤显影。Li 等[42]合成了含有磷酸酯键的喹啉-丙二腈基纳米探针(DQM-ALP)。探针的磷酸酯键在ALP 的作用下断裂,疏水内核聚集诱导荧光反应,实现ALP 的高分辨率显影。
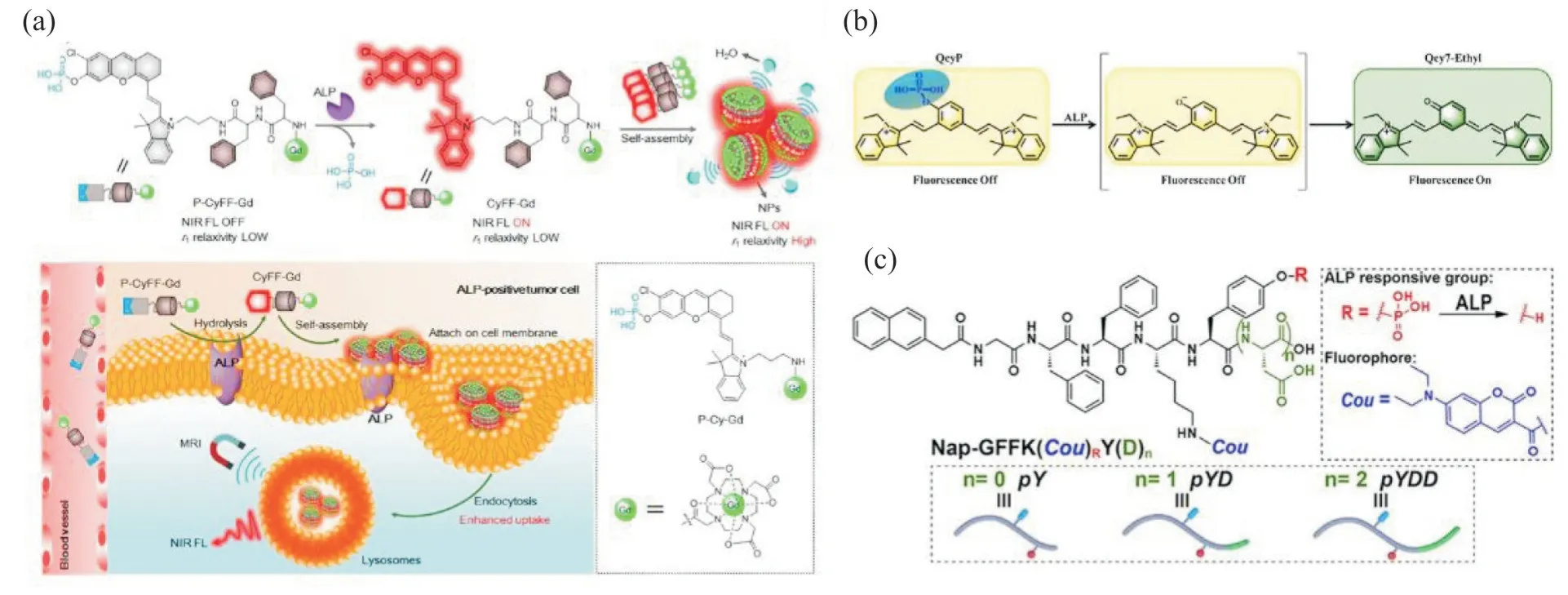
Fig. 8 Application of phosphate ester bond-based intelligent response system intumor tracer
此外,由于各种磷酸酯衍生物对骨矿物质和钙盐具有高亲和力,已被广泛用作骨成像和骨病治疗的靶向治疗剂[43]。在骨组织修复初期,新骨形成情况难以通过计算机断层扫描或磁共振成像显示[44],因此高分辨率实时活体成像技术成为新骨生长发育的重要探测手段。ALP 在新生骨组织中含量较高,可作为一种骨形成的早期生物标志物。Park 等[29]合成了包含酚类二羟基噻吩荧光基团和磺酸基磷酸盐的NIR 探针。磷酸酯键在ALP 作用下断裂后可发出荧光,实现ALP 响应性的荧光开启(Fig.9(A))。将这种探针标记在磷酸钙支架上,可以监测支架植入后早期ALP 的表达,从而评估支架内骨矿物沉积情况。Yang 等[30]构建了一种聚己内酯/硅酸钙复合支架,半胱氨酸(LET-3)在支架表面通过自组装技术形成纳米粒子, 用于ALP 水平监测和成像(Fig.9(B))。其中LET-3 中含有磷酸酯键,能够被ALP 特异性断裂,激活其NIR 成像特性。将含有磷酸酯键的生物探针与骨组织工程支架结合是检测新骨形成的一种很有前景的策略,在组织修复体内示踪领域具有应用潜力。
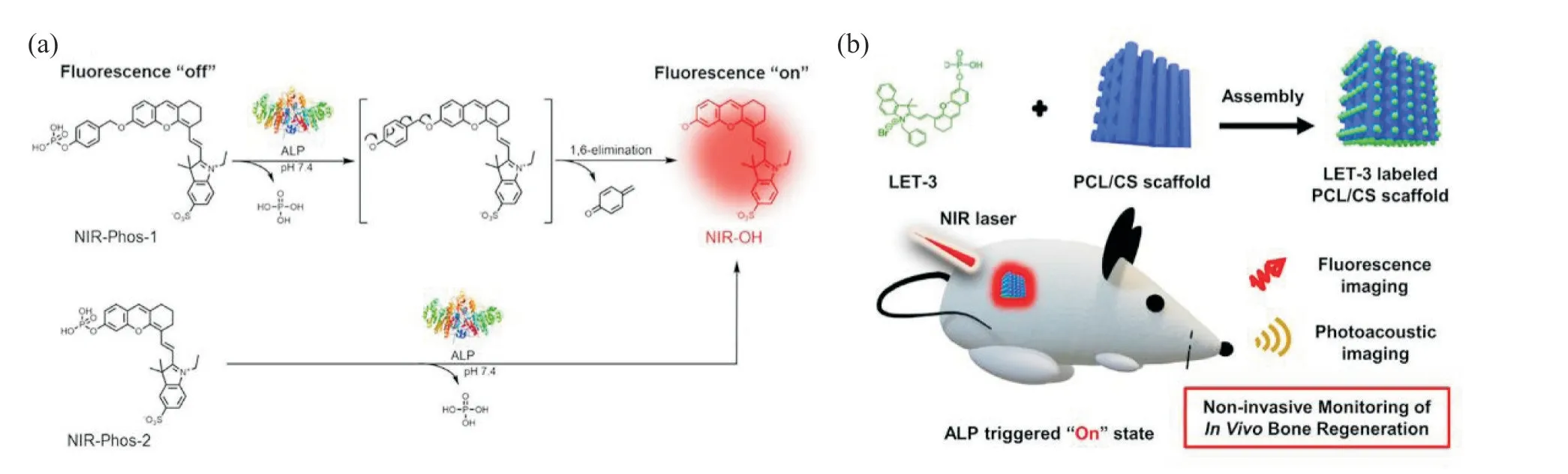
Fig. 9 Application of phosphate ester bond based intelligent response system in bone detection
3 总结与展望
磷酸酯键具有高度稳定性、亲水性、酶响应性、促进生物矿化等性能,因而备受研究者瞩目。在细胞培养中,通过磷酸酯键的智能响应性断裂可实现促进细胞增殖分化的作用;在骨修复领域,磷酸酯键的智能响应性可使材料降解周期与骨生长周期相匹配,同时促进矿化,加速骨缺损修复;基于磷酸酯键的智能响应药物控释系统可作为抗生素和抗癌药载体,实现靶向释放;基于磷酸酯键的智能响应体系还可作为生物探针实现高分辨率肿瘤成像及新骨生成检测。
未来, 如何通过分子结构及材料组成设计,提高磷酸酯键特异性响应ALP 的灵敏度,并拓宽磷酸酯键基智能响应体系的应用领域是研究者们的目标。

