兔出血症病毒衣壳蛋白VP60 抗原区的原核表达及其免疫保护效果
杨柳 ,林永润 ,牟豪 ,许国洋 ,余远迪 ,沈克飞 ,付利芝
1.重庆市畜牧科学院,重庆402460;2.重庆市兽用生物制品工程技术研究中心,重庆402460;3.西南大学荣昌校区,重庆402460
兔出血症(rabbit hemorrhagic disease,RHD)是由兔出血症病毒(rabbit hemorrhagic disease virus,RHDV)感染引起的一种急性、接触性和高致死性传染病,以发病兔全身实质器官水肿、出血性变化和淤血为主要特征[1]。1989 年,世界动物卫生组织(Office International des Épizooties,OIE)将 RHD 列为B 类传染病,该病对经济学和生态学可产生重要影响[2]。
目前广泛使用的RHD 组织灭活疫苗是将含RHDV 的动物组织匀浆,经甲醛灭活后制备而成,在防控RHD 中发挥了重要作用,但该疫苗的制备过程不符合动物福利要求,且病毒量难以控制,不易保存,存在灭活不彻底向环境散毒的风险[3],因此,研发新型疫苗显得尤为重要。RHDV 为单股正链RNA病毒,病毒粒子呈球形、无囊膜、20 面体对称,不易进行体外大量培养。RHDV 衣壳蛋白VP60 是主要结构蛋白,相对分子质量约60 000,180 个VP60 单体组成病毒粒子核衣壳。VP60 蛋白是病毒的免疫保护性抗原,在诱导宿主免疫反应中发挥重要作用,是RHD疫苗研究的靶标抗原[4]。有研究采用 E.coli[5]、酿酒酵母[6]、昆虫细胞[7]、猪痘病毒[8]及植物[9]等系统表达了VP60 蛋白,但由于其相对分子质量较大,原核或真核系统表达时均存在表达不稳定及表达量偏低的缺点,增加了亚单位疫苗生产成本。MARTINEZTORRECUADRADA 等[4]研究发现,位于 VP60 蛋白N-末端第 31 ~ 250 位(L 区)和 C-末端第 477 ~ 579位(H 区)的氨基酸是VP60 蛋白的抗原区域;孟春春等[10]将这两抗原区域和Th 细胞表位融合表达,并用融合蛋白免疫家兔,获得的抗体可抵抗致死剂量RHDV 攻击。为降低目标蛋白相对分子质量、减少两抗原区的相互干扰及保持抗原区的功能,本实验选用柔性连接肽串联两抗原区段,经原核表达及纯化后,免疫家兔,以期获得抗RHDV 的特异性抗体,有效抵抗RHDV 感染,为相应疫苗的研发提供实验依据。
1 材料与方法
1.1 病料 病死兔来自重庆某兔场。
1.2 质粒、菌株及毒株 载体pMD18-T 购自日本TaKaRa 公司;原核表达载体pET30a(+)及感受态E.coli DH5α 和感受态E.coli BL21(DE3)购自天根生化科技(北京)有限公司;RHDV SZ / 2013 强毒株病毒液(用RHDV SZ/2013 强毒株感染家兔,取感染致死兔肝脏,制备成组织研磨液,采用人O 型红细胞凝集试验测定病毒血凝效价为1 ∶256)。
1.3 主要试剂 病毒RNA / DNA 提取试剂盒(Viral RNA / DNA Extraction Kit Ver 5.0)、限制性内切酶HindⅢ、EcoRⅠ和 T4 DNA 连接酶及 PCR Master Mix(2 ×)均购自日本TaKaRa 公司;反转录试剂盒(PrimeScriptTMRT-PCR Kit)、质粒小提试剂盒及胶回收试剂盒购自美国Omega 公司;HRP 标记的羊抗兔IgG 购自北京康为世纪生物科技有限公司;兔抗RHDV 多克隆抗体由重庆市兽用生物制品工程技术研究中心实验室保存;RHDV IgG 抗体ELISA 检测试剂盒(20170218)购自山东绿都生物科技有限公司;DAB 显色试剂盒购自北京中杉金桥生物技术有限公司;Ni2+-NTA 金属螯合蛋白质纯化柱购自北京诺和生物技术有限公司;Bradford 蛋白浓度测定试剂盒购自上海翊圣生物科技有限公司。
1.4 实验动物 家兔购自重庆龙翔肉兔养殖场,35日龄,体重约1.0 kg,试验前观察7 d,兔健康无病。经 RT-PCR 及抗体 IgG ELISA 检测,确认 RHDV 抗原、抗体均为阴性。
1.5 引物设计及合成 根据GenBank 中登录的RHDV JX / 97 株衣壳蛋白基因(DQ205345.1)序列,应用GeneTool 软件,设计VP60 引物及菌落PCR 检测引物。VP60-F:5′-TGTGAATTCATGGAGGGCAAAACCCGCAC-3′(下划线部分为EcoRⅠ酶切位点),VP60-R:5′-GCAAGCTTTCAGACATAAGAAAAGCCATGG -3′(下划线部分为HindⅢ酶切位点),扩增产物大小为 1 740 bp;菌落 PCR-F:5′-CAACGAATTCGACCCTGGTGTAGT-3′(下划线部分为EcoRⅠ酶切位点),菌落 PCR-R:5′-CGCGAAGCTTTTAAACATAGCTAAAGC-3′(下划线部分为HindⅢ酶切位点),扩增产物大小为1 014 bp。引物由生工生物工程(上海)股份有限公司合成。
1.6 目的基因的扩增 取病死兔肝脏,称重,加入10 倍体积的0.9%氯化钠溶液,匀浆,反复冻融,13 800 × g 离心 10 min,取上清 200 μL,用病毒RNA / DNA 提取试剂盒提取总RNA,反转录试剂盒反转录为cDNA,以其为模板,VP60-F/R 为引物,进行PCR 扩增。PCR 反应体系为:2 × Taq PCR Master Mixes 25.0 μL,cDNA 4.0 μL,Primer-F /R(10 μmol/L)各 1.0 μL,ddH2O 19.0 μL,共 50.0 μL。PCR 反应条件为:94 ℃预变性 5 min;94 ℃变性 1 min,55 ℃退火45 s,72℃延伸1.5 min,共30 个循环;72℃再延伸10 min。同时设无模板的PCR 反应体系作为阴性对照。PCR 产物经1.0%琼脂糖凝胶电泳检测。
1.7 目的基因的生物信息学分析 回收目的基因,连接至载体pMD18-T,转化感受态E.coli DH5α,经蓝白斑筛选,取阳性克隆,送生工生物工程(上海)股份有限公司测序。将测序DNA 进行BLAST 比对;采用软件MEGA 4 进行系统进化树分析;利用ORF Finder在线分析软件(https://www.ncbi.nlm.nih.gov/orffinder/)分析测序DNA 编码蛋白,并参考文献[4]明确VP60氨基酸序列的两抗原区段。
1.8 重组表达质粒的构建 用柔性连接肽(Gly4Ser)3 串联2 个抗原区段,按E.coli 密码子偏好性优化设计编码串联氨基酸的DNA,在序列上下游末端分别加入HindⅢ及EcoRⅠ酶切位点,DNA 序列送生工生物工程(上海)股份有限公司合成。将原核表达载体pET30a(+)及合成DNA 片段均经HindⅢ及EcoRⅠ进行双酶切,产物经1.0%琼脂糖凝胶电泳分析。胶回收目的基因片段及载体片段,以T4 DNA 连接酶于16 ℃连接过夜;连接产物及空载体pET30a(+)分别转化感受态E.coli BL21(DE3);挑取单克隆,以菌落PCR-F/R 为引物进行菌液PCR 鉴定,鉴定正确的阳性克隆送生工生物工程(上海)股份有限公司测序。将测序正确的重组表达质粒命名为pET30a(+)-LH。
1.9 重组蛋白的表达 将阳性单克隆及空载体转化菌分别接种至LB 液体培养中,于37 ℃培养至菌液A600= 0.4 时,加入 IPTG 至终浓度 1 mmol / L,37 ℃诱导培养,分别于 0、1、2、3、4、5 h 收获诱导菌液和空载体诱导菌各1.0 mL,13 800 × g 离心2 min,收集菌体,经12% SDS-PAGE 分析。收集最适诱导时间的阳性克隆菌体,超声破碎,分别收集上清和沉淀,进行12% SDS-PAGE 分析。
1.10 重组蛋白的纯化及鉴定 将最佳诱导时间的重组诱导菌及空载体诱导菌的超声破碎沉淀用缓冲液(8 mol / L 尿素,2 mmol / L EDTA,2 mmol / L 巯基乙醇,20 mmol/L Tris-HCl,pH 8.0)溶解过夜;13 800× g 离心10 min,收集上清。参考文献[11],采用Ni2+-NTA金属螯合蛋白层析柱进行纯化,再参考文献[12]方法对纯化蛋白进行复性处理,采用Bradford 蛋白浓度测定试剂盒测定复性蛋白浓度。纯化产物经12% SDSPAGE 分离蛋白后,转移至 NC 膜上,用 1%BSA 于 4 ℃封闭过夜;PBST 洗涤3 次,加入兔抗RDHV 多克隆抗体(1 ∶500 稀释),室温孵育 2 h;PBST 洗涤 3 次,加入 HRP 标记的羊抗兔 IgG(1 ∶5 000 稀释),于室温孵育2 h;PBST 洗涤3 次,DAB 显色试剂盒显色。
1.11 重组蛋白免疫保护效果的检测 将重组蛋白与弗氏佐剂按1 ∶1 的体积比混合,充分乳化后,经兔背部皮下注射,1.0 mg / 只,共免疫 3 次,每次间隔2 周。同时设对照组(注射弗氏佐剂与0.9%氯化钠溶液的乳化产物,其他同试验组)。分别于免疫前、首次免疫后14、28、42 d 经耳静脉采血,分离血清,采用RHDV IgG 抗体ELISA 试剂盒检测血清中RHDV抗体水平。末次免疫2 周后,经家兔腿部肌肉注射RHDV SZ / 2013 强毒株病毒液,2 mL / 只。攻毒后每天观察家兔症状,死亡兔及时剖解观察;10 d 后对全部家兔进行剖解观察。记录肝、肺和肾等脏器的病理变化。
2 结 果
2.1 目的基因的鉴定 RHDV VP60 基因PCR 产物经1.0%琼脂糖凝胶电泳分析,于约1 700 bp 处可见单一目的基因条带,大小与预期相符,见图1。
2.2 目的基因的生物信息学分析 目的基因序列与RHDV 山东分离株VP60 基因的核苷酸相似性最高,达95.86%,将该毒株命名为RHDV Chongqing /2016。目的基因编码579 个氨基酸,明确了VP60 两抗原区段为氨基酸序列的N-末端L 区和C-末端H区,见图2。系统进化树分析结果显示,该病毒属于RHDV,在进化树上处于独立分枝,见图3。
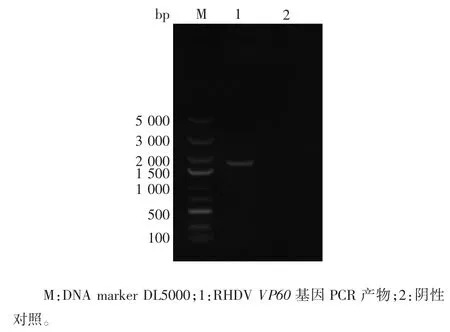
图 1 RHDV VP60 基因PCR 产物电泳图Fig.1 Electrophoretic profile of PCR product of RHDV VP60 gene
2.3 重组表达质粒的鉴定 重组菌菌液PCR 产物经1.0%琼脂糖凝胶电泳分析,于约1 000 bp 处可见单一目的基因条带,大小与预期相符,空载体转化菌未见该目的条带,见图4。测序结果表明,目的基因序列与优化合成的DNA 序列一致。表明重组表达质粒pET30a(+)-LH 构建正确。
2.4 表达产物的鉴定 表达产物的相对分子质量约50 000,大小与预期相符;随诱导时间的延长,蛋白表达量逐渐增加,于4 h 时达最高,因此确定最适诱导时间为4 h。见图5。超声破碎上清未见明显目的蛋白条带,沉淀可见相对分子质量约50 000 的目的蛋白条带,大小与预期相符,见图6。表明重组蛋白主要以包涵体形式表达。
2.5 纯化产物的鉴定 纯化产物相对分子质量约50 000,大小与预期相符,空载体诱导菌未见该目的蛋白条带,见图7。纯化产物可与兔抗RHDV 多克隆抗体发生特异性结合,于相对分子质量约50 000 处可见特异性结合条带,大小与预期相符,纯度达88.3%;空载体诱导蛋白未见该结合条带。见图8。
2.7 重组蛋白的免疫保护效果 试验组家兔首次免疫14 d 即产生了抗RHDV 特异性抗体,随时间延长呈逐渐升高的趋势,且较稳定;对照组各时间点抗RHDV 特异性抗体均较低。见图9。试验组家兔攻毒后10 d 无死亡,整个试验期间采食正常,无病症出现,保护率达100%;剖检可见家兔肝、肺和肾等脏器均正常,未见出血症状。对照组家兔于攻毒后72 h 内全部死亡,症状为食欲减退、精神不振,死亡前咬兔笼、尖叫、挣扎,鼻腔中有泡沫状出血、眼结膜充血;剖检可见家兔肝肿大、黄褐色、质脆,表面散在灰白色针尖至粟粒大坏死灶,两肾有不同程度淤血、变性,心腔内有积留黑红色血液和血块。

图2 VP60 ORF 及其编码相应氨基酸Fig.2 VP60 ORF and encoded amino acid sequence
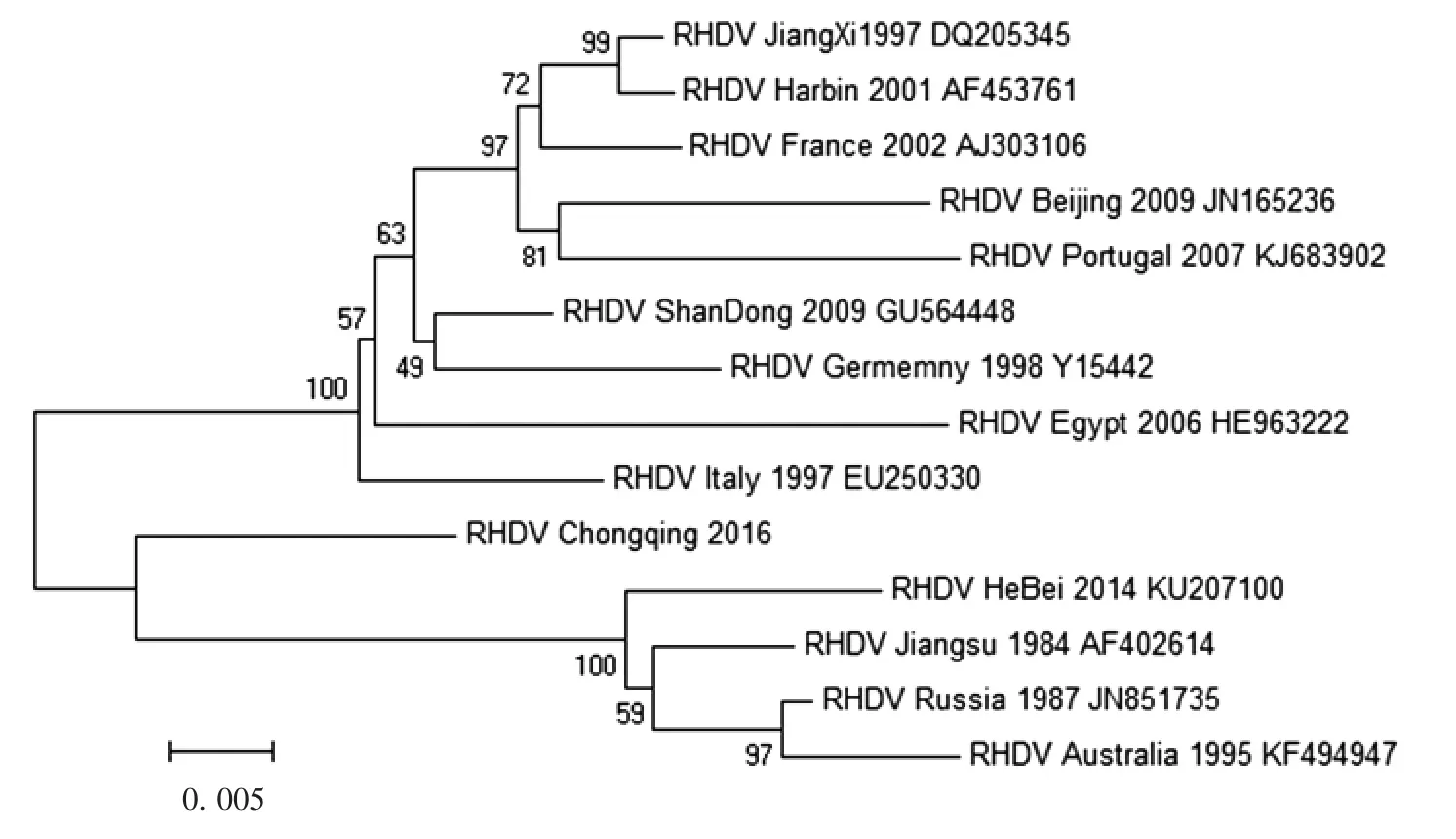
图 3 RHDV Chongqing / 2016 毒株VP60 基因的核苷酸进化树Fig.3 Phylogenetic tree of nucleotide of RHDV Chongqing / 2016 based on VP60 gene
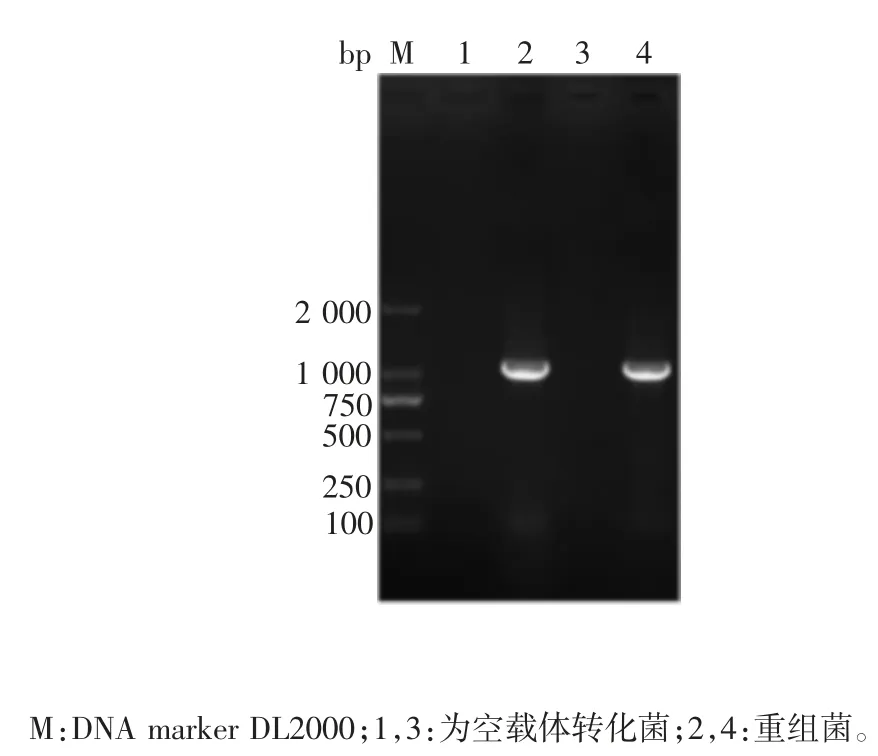
图4 重组菌的菌液PCR 鉴定Fig.4 Identification of recombinant bacteria by PCR
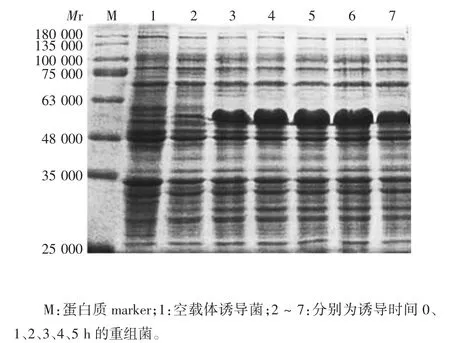
图5 重组蛋白表达产物的SDS-PAGE 分析Fig.5 SDS-PAGE profile of expressed recombinant protein
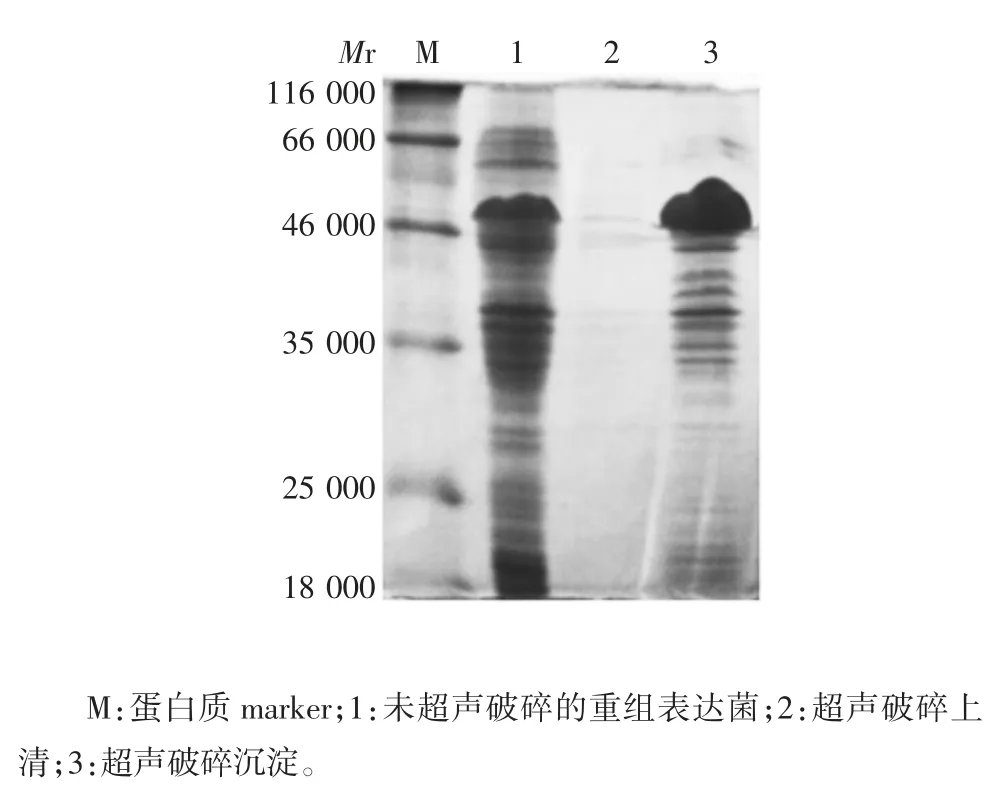
图6 重组蛋白表达形式的分析Fig.6 Analysis of form of expressed recombinant protein
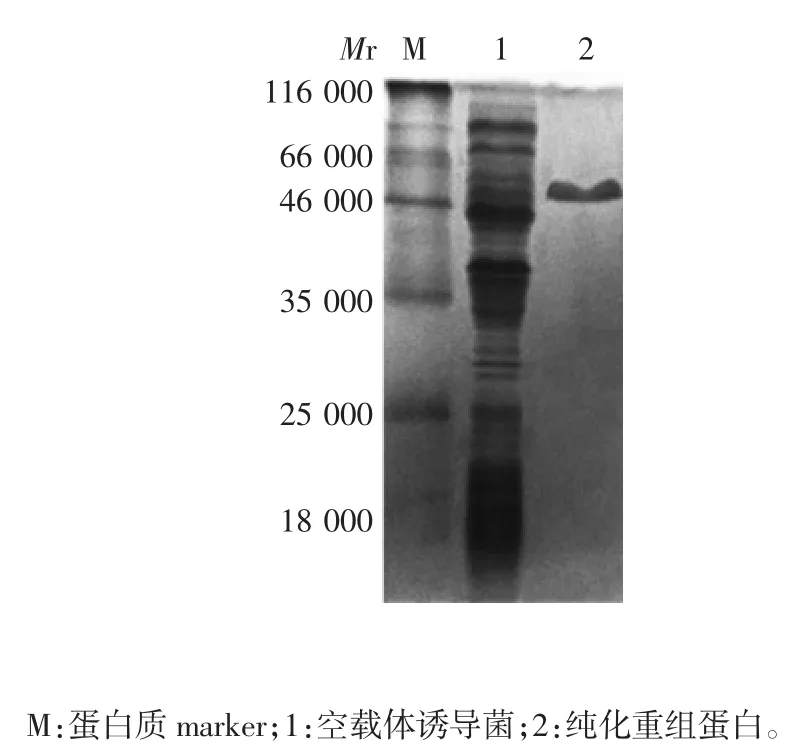
图7 纯化蛋白的SDS-PAGE 分析Fig.7 SDS-PAGE profile of purified protein
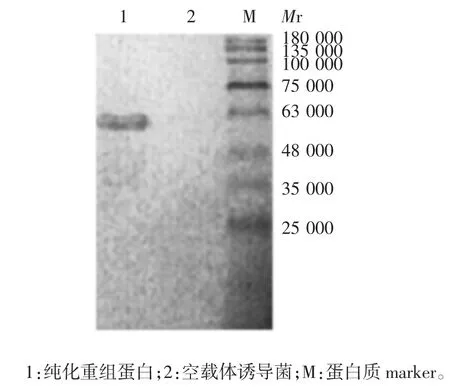
图8 纯化蛋白的Western blot 分析Fig.8 Western blotting of purified protein
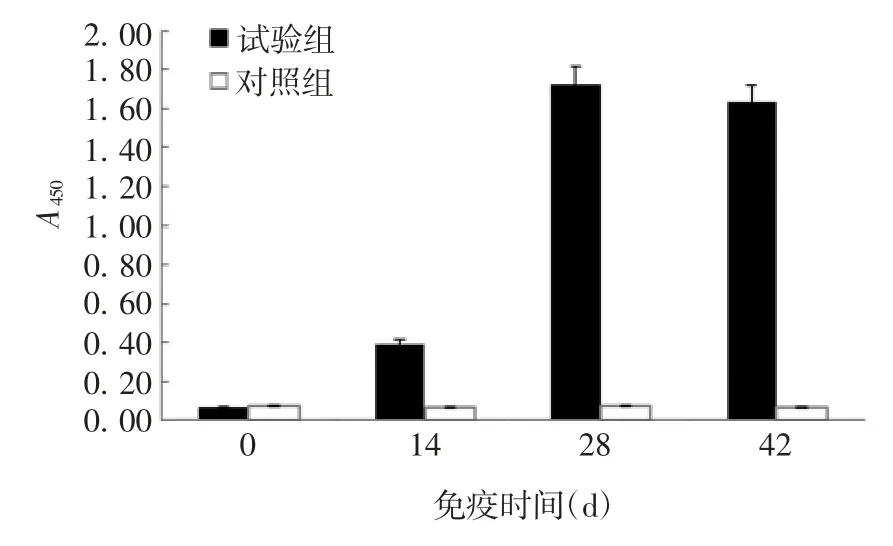
图9 不同免疫时间家兔血清中的RHDV 抗体水平Fig.9 RHDV antibody level in sera of rabbits at different time points after immunization
3 讨 论
RHD 是危害兔养殖业健康发展的一种重要传染性疫病[13-14],该病分布广泛、危害严重,给兔养殖业造成了严重经济损失。目前,采用传统的组织灭活疫苗免疫防控RHD 存在诸多不足。通过分子生物学手段,从病毒核酸分子入手,研发预防RHDV 感染的新型疫苗已成为当前研究的热点[15-16]。RHDV仅有单一血清型,疫苗可为不同病毒株感染提供交叉保护[17],该病毒衣壳VP60 蛋白在诱导宿主免疫反应中发挥重要作用,具有相对保守的氨基酸序列[18]。因此,VP60 蛋白为新型RHD 疫苗的研制提供了可能。
根据RHDV 衣壳蛋白VP60 的抗原结构特点,本研究以 RHDV SZ / 2016 株 VP60 的两个主要抗原区段为研究目标,选用柔性连接肽(Gly4Ser)3 将其串联起来,构建了表达衣壳蛋白VP60 两抗原区域的重组表达质粒,转化感受态E.coli BL21(DE3)中,经IPTG 诱导4 h,目标蛋白获得高效表达。随后采用Ni2+-NTA 柱进行了蛋白初步纯化,纯度达88.3%,纯化效果较好。柔性连接肽的使用,保持了两功能域之间的距离,使连接的功能域之间不互相干扰,从而更好地发挥各自作用[19]。
Western blot 分析结果表明,表达产物对感染RHDV 家兔的阳性血清有较好的反应原性。动物试验结果表明,纯化的重组蛋白免疫家兔后,可产生针对RHDV VP60 蛋白的特异性抗体,且对RHDV攻击产生了良好的免疫保护效果,保护率为100%。与RHDV 的衣壳蛋白VP60 比较,该构建方式获得的重组蛋白氨基酸序列较短,相对分子质量明显降低;另外,本研究还基于E.coli 密码子偏好性将编码串联蛋白的DNA 序列进行优化处理,整条核苷酸序列经修饰后减少了稀有密码子,不仅有利于保护性抗原稳定高效地表达,还便于串联蛋白的后续纯化与制备。但本实验原核表达的串联蛋白是以包涵体的形式存在,如何有效大量获得可溶性串联蛋白质还需进一步深入研究。本研究为预防RHD 的基因工程亚单位疫苗的研发提供了实验依据。

