先天性外中耳畸形及功能性耳再造
张天宇李辰龙
复旦大学附属眼耳鼻喉科医院,耳鼻喉科研究院,眼耳鼻整形外科,卫健委听觉医学重点实验室(上海 200031)
先天性外中耳畸形又称小耳畸形,主要表现为耳郭畸形、外耳道狭窄或闭锁、中耳畸形等。由于该类先天畸形的多器官受累特征及其影响的复杂性,同时也由于其相对低的发病率,在全世界都未得到足够地重视和系统的研究,使得对该类疾病规律的认识不足、治疗效果受限。而最具挑战的是,如何协调整形外科困难的耳郭整形再造与耳科棘手的外耳道、中耳重建,以期同时达到耳郭再造与听力康复,实现功能性耳再造[1]。因而,多年来国内外在外中耳畸形治疗的手术适应症、手术方案及手术时机等方面缺乏相应的医疗规范。
2019年5月29日,在波兰第32届Politzer协会年会暨第二届世界耳科大会上,由张天宇教授与欧美业内知名专家,发表先天性外中耳畸形及功能性耳再造国际共识建议一文《International Consensus Recommendations on Microtia,Aural Atresia and Functional Ear Reconstruction》,全文发表于Politzer协会官方杂志《The Journal of International Ad‐vanced Otology》[2]。本共识的发布,为进一步规范耳畸形的临床诊疗提供参考和依据。本文将对共识的核心内容进行解读。
1 先天性外中耳畸形的分类
1.1 耳郭畸形的分类
先天性外中耳畸形主要分为耳郭形态畸形和结构畸形两大类[3]。根据目的的不同,共识介绍了耳郭结构畸形两种常用的分度方式,一种是临床诊断中常用的Weerda分度,根据畸形程度不同可分为4度(图1):Ⅰ度畸形为轻度畸形,大多数正常结构清晰可辨,Ⅱ度畸形为中度畸形,部分正常结构可辨,Ⅲ度畸形为重度畸形,正常结构消失,典型表现为“花生耳”,Ⅳ度为无耳畸形;另一种是耳再造手术中设计不同皮瓣由Nagata提出分型(图2),根据不同术式分为耳甲腔型、小耳甲腔型和耳垂型三种。Weerda分度主要用于指导耳畸形的临床诊疗,而Nagata分型是全耳郭再造手术设计的重要参考依据。通常外耳畸形越重,外耳道及中耳发育越差。

图1 Weerda分度Fig.1 Weerda’s classification of microtia
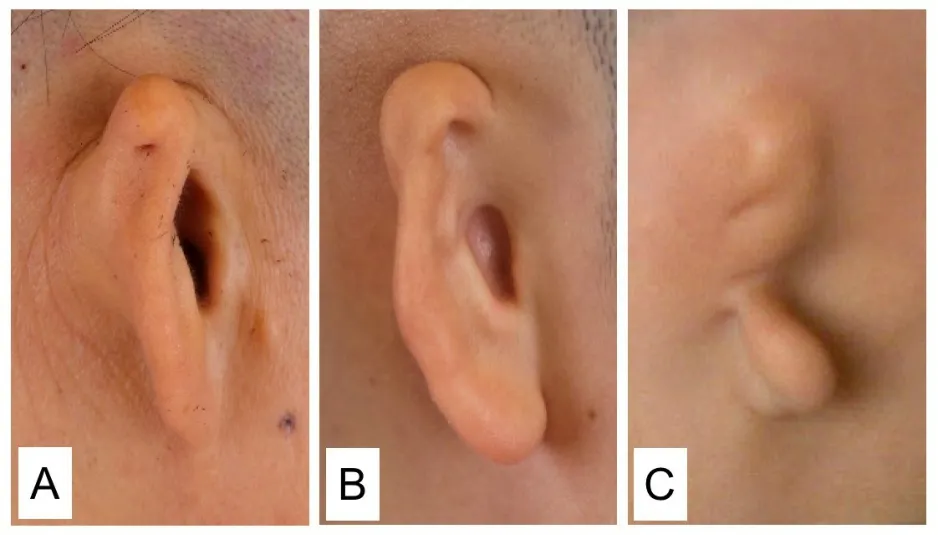
图2 Nagata分型。A:耳甲腔型;B:小耳甲腔型;C:耳垂型。Fig.2 Nagata’s classification of microtia.A:concha type;B:small concha type;C:earlobe type
1.2 外耳道畸形的分类
根据外耳道发育的不同,结合其临床特征和手术观察,共识将外耳道畸形分为外耳道狭窄、外耳道部分闭锁和外耳道完全闭锁三类(图3)。外耳道狭窄是指外耳道软骨段或骨性段变窄,存在小鼓膜或鼓膜形态畸形;外耳道部分闭锁是指外耳道软骨段或骨性段部分存在,有骨性闭锁板,鼓膜缺失或发育不全;外耳道完全闭锁是指外耳道软骨段和骨性段完全闭锁,鼓膜缺失。

图3 外耳道畸形分类。A:外耳道狭窄(冠状位);B:外耳道部分闭锁(冠状位);C:外耳道完全闭锁(冠状位);D:外耳道狭窄(轴位);E:外耳道部分闭锁(轴位);F:外耳道完全闭锁(轴位)。Fig.3 Classification of congenital aural atresia.A:stenosis(coronal position);B:partial atresia(coronal position);C:to‐tal atresia(coronal position);D:stenosis(axial position);E:partial atresia(axial position);F:total atresia(axial position).
关于外耳道畸形的分类,国内外有不同的分类方法。1955年Altmann根据外耳道与中耳发育状况将其分为轻、中、重三型。1989年Schuknecht将外耳道畸形分为四型,其中A型B型为外耳道狭窄,C型D型为外耳道闭锁,作为手术选择的参考依据。1992年Jahrsdoerfer评分系统的提出,使上述两种外耳道分型方法的价值降低。国内冷同嘉等将外耳道畸形分为外耳道狭窄和闭锁两类,2015年《先天性外中耳畸形临床处理策略专家共识》同样认为,外耳道畸形可分为外耳道狭窄和外耳道闭锁两类。对于外耳道闭锁者,施行外耳道再造有效改善听力的机会较小,且并发症多,多持慎重态度[4]。外耳道部分闭锁患者由于其保留了部分外耳道结构,仍具有耵聍腺分泌耵聍的保护和一定的外耳道自净功能,相对于外耳道完全闭锁患者,其外耳道再造术后改善听力的机会较多,且并发症发生率低,因而本国际共识将外耳道闭锁细分为部分闭锁和完全闭锁两类。
2 先天性外中耳畸形的治疗
2.1 耳郭畸形的治疗
全耳郭再造的手术方式主要有两种,自体肋软骨法和人工材料法。共识认为自体肋软骨法的手术时机应在患儿6周岁以后,其中9周岁以后最佳,该年龄段患儿发育良好,能够提供足量的肋软骨用于雕刻耳郭支架。共识还提出了肋软骨空心化这一新理念,在身体快速发育的青春期(12-15周岁),肋软骨容易发生空心化改变,肋软骨质地疏松,弹性及硬度变差,雕刻的耳郭支架塑形和固定困难,且稳定性差。
成年之后,肋软骨容易发生钙化或者骨化,肋软骨质地变硬变脆,雕刻困难或者雕刻时易断裂以及术后出现变形。共识正文中并未深入探讨肋软骨骨化的处理,在后续Letter to the Editor中,我们认为肋软骨骨化时应当整块雕刻以保持支架的稳定性,在去除钙化部分时,由于肋软骨的外层柔软性好,应当充分保留。通常并不建议使用钻头进行雕刻,但是当钙化严重无法雕刻时,钻头雕刻仍是选择之一[5]。通过采用肋软骨B超技术,可以在耳再造术前有效判断肋软骨的空心化以及钙化情况,相对于肋软骨CT而言,避免了辐射对身体的影响(图4)[6]。
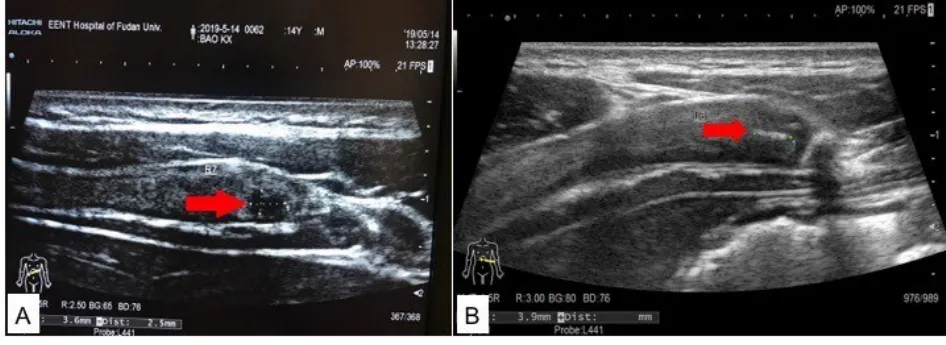
图4 肋软骨B超。A:肋软骨空心化(箭头处);B:肋软骨钙化(箭头处)。Fig.4 Costal cartilage B-ultrasound;A:honeycombed phe‐nomenon(arrow);B:calcification phenomenon(arrow).
全耳郭再造术前应当充分评估耳后皮肤的质地。皮肤松弛且活动性好是自体肋软骨全耳郭再造的理想条件,当耳后皮肤厚且活动度差时,应当对耳后皮肤进行预扩张或采用颞顶筋膜瓣法耳再造。
2.2 外耳道畸形的治疗
如何重建外耳形态、恢复外耳道生理功能,实现听力康复是“功能性耳再造”技术体系中的关键(图5)。耳内-耳甲切口外耳道成形技术,充分利用外耳道残余皮肤重建鼓膜和部分外耳道上皮,并根据鼓室内情况行鼓室成形及听骨链重建,对耳后皮肤结构不造成损伤,极少影响全耳郭再造术的开展,适用于外耳道狭窄和外耳道部分闭锁患者[7]。针对外耳道部分闭锁患者,在充分保留外耳道残余皮肤的基础上,还可利用软骨片修复鼓膜以降低鼓膜外移的发生风险。

图5 功能性耳再造。Fig.5 Functional ear reconstruction.
外耳道闭锁患者的Jahrsdoerfer评分≥7分时,可考虑行外耳道再造术,共识认为患者的手术年龄应大于6岁,但仍需慎重。外耳道再造术后患者随着年龄增长,其外耳道骨性增生再狭窄闭锁行二次手术的风险较高,闭锁外耳道再造二次修复的概率为25%—36%,共识建议耳道再造的最佳时期为青春期之后,青春期之后乳突中耳发育基本完成,开放乳突部分气房形成的骨性外耳道创面新骨增生减少[8]。
对于不能通过外耳道再造术改善听力的患者而言,可以采用软带式、黏贴式等骨导助听器提高听力,年龄大于5岁后可考虑骨导助听器植入[9]。对于双耳畸形伴听力损失的患者,共识建议通过佩戴骨导助听器以改善其听力、言语理解和声源定位能力。虽然骨导助听器在单耳畸形中的效果存在争议,但仍建议尝试佩戴。
3 先天性外中耳畸形临床诊疗流程图
外耳道重建术应当在自体肋软骨全耳郭再造术之后或联合开展,以降低耳再造手术的皮瓣风险;外耳道重建术应当在人工材料法全耳郭再造术之前或者联合开展,如果在人工材料全耳郭再造之后开展外耳道重建术,则会有支架暴露的风险,并且手术空间不足操作困难[10]。
如果外耳道狭窄患者不合并外耳道胆脂瘤,可先行自体肋软骨耳郭再造术,但需密切随访外耳道。若患者表现为外耳道胆脂瘤或伴发外耳道感染则需首先行外耳道成形术,避免外耳道胆脂瘤进一步破坏毗邻结构;若患者已行耳郭再造术并完成立耳,仍可行外耳道成形术,但将减少术者的操作空间并增加手术难度[11]。
骨导助听器植入前应开展详细的颞骨CT和听力检测,并试戴软带式骨导助听器。可供选择的助听装置有骨桥、人工中耳、经皮式骨导助听器、穿皮式骨导助听器等。通常骨导助听器植入在全耳郭再造术之后,也可联合立耳手术完成。如先开展骨导助听器植入,术前还应确认植入的位置,避免影响后续的全耳郭再造术(图6)。

图6 先天性外中耳畸形临床诊疗流程图Fig.6 Flowchart of Functional Ear Reconstruction
4 未来研究方向
在综合征和非综合征耳畸形病例中,运用多组学研究手段结合生物学领域新技术寻找先天性外中耳畸形的致病基因,构建细胞、动物模型等进行验证,多角度多维度研究其发生机制。
组织工程技术利用少量患者自体残耳软骨细胞,接种于可吸收的复合支架材料,构建形成耳郭软骨,是耳再造的重要研究方向。实现组织工程耳郭的大规模临床应用,组织工程软骨的生物力学特性和长期表型稳定等关键科学问题需进一步阐明[12]。
如何恢复外耳道的自净、耵聍分泌、抗感染等生理功能,是外耳道尤其是闭锁外耳道生理性再造的研究重点。未来可开展外耳道上皮移行、皮肤耵聍腺等研究,实现外耳道功能的生理性再造。
——外耳道成形技术进展

