同卵双生单人表型眼-耳-脊柱综合征1例
代佳秋 朱琳 王思霁 陈子琦 向长超 欧阳曦 康厚墉
重庆医科大学附属第一医院耳鼻咽喉科(重庆 400000)
1 病例资料
患者,女,9岁,汉族。自幼右耳耳廓畸形并外耳道闭锁。5岁时因腹痛就诊于当地医院,腹部超声检查发现右侧肾缺如,患儿发育较同龄人一致,智力正常,言语发育好。患儿为第一胎,同卵双胎之一,孕38周足月生产,出生时体重2.55kg,出生无缺氧史,无明显黄疸等。其孪生姐姐无耳廓畸形及肾缺如。母亲孕5月有感染史,无特殊用药,无糖尿病等代谢疾病史。父亲左足第四、第五趾并趾畸形,简单查体未发现听力障碍及颜面部畸形,未行相关听力学检查。否认耳廓畸形、耳聋及肾缺如家族史。
体检:生命体征正常,表情自然,神清,查体及对答配合,视力正常,面部对称,无唇裂、眼球皮样囊肿。右耳原耳廓处多数结构无法辨认,残耳呈腊肠状,Marx分度Ⅱ度,外耳道闭锁,残耳前方有一细小瘘口(见图1),左耳耳廓发育正常,耳道通畅,鼓膜完整。面部发育稍不对称,右侧口角较左侧稍高,双侧肋脊角区无叩击痛。

图1 患儿术前外貌特征A.正面观;B.侧面观Fig.1 Appearance of Patient before operation.A.front view;B.lateral view
辅助检查:①纯音测听:纯音听力测试右耳传导性聋,语言频率平均听阈气导70dB,骨导10dB,左耳听力正常。②颞骨高分辨CT右侧外耳道狭窄,右鼓室腔小、听骨链、耳蜗、半规管及前庭骨性结构正常,左侧正常(见图2)。③肋软骨三维重建可见胸3-胸4椎间隙变窄,胸6椎体形态失常,呈蝴蝶椎改变,胸5、6椎体融合,胸6-7间隙变窄,左侧第8-9后肋联合,右侧第6、7后肋及腋段融合,前段呈分叉状改变(见图3)。

图2 患儿颞骨CT图像,右侧耳廓畸形外耳道狭窄,内耳及中耳结构正常,左侧正常Fig.2 CT image of temporal bone.Right auricle abnormality and stenosis of external auditory canal;normal structure of in‐ner ear and middle ear;normal left side

图3 椎体及肋骨畸形A.正面观;B.侧面观Fig.3 Deformity of vertebrae and ribs;A.front view;B.lat‐eral view
2 讨论
OAVS是一种累及多器官系统的严重先天畸形,临床表现复杂多样,目前报道的其发病率约为1:45000[1,2],其典型表现为眼、耳、脊椎异常,其中眼部异常可表现为眼球角膜缘皮样囊肿、皮脂瘤、眼睑缺损、小眼或无眼等;耳部异常表现为小颌、小耳、附耳、耳前瘘管、感音神经性聋、传导性聋、外耳道闭锁、面神经异常等[3]。除此之外,OAVS还经常合并其他系统发育异常。颅面部畸形可表现为半面短小、面部不对称、巨口、牙齿发育异常等;心血管系统畸形可表现为先天性心脏病(法洛四联症,间隔缺损,大血管移位,主动脉弓形异位、右位心);泌尿生殖系统异常表现为单侧肾发育不全,双输尿管,肾异位,肾积水,输尿管积水;中枢神经系统异常表现为胼胝体脂肪瘤,小头畸形,脑膨出,脊椎畸形,Arnold-Chiari畸形,其他系统出现畸形的概率约为50%。研究表明典型表现(眼、耳、脊椎)越严重,其出现其他系统异常的概率越高[4]。目前,OAVS尚无统一的诊断标准,目前普遍认为副耳是此类疾病的共同表型,耳廓畸形或副耳合并半面短小是诊断OAVS的最轻标准[5]。普遍接受的诊断标准是包括以下两种或两种以上的异常:耳畸形(包括小耳畸形和副耳屏)、半面发育不良(包括小颌畸形)、眼球皮样囊肿或脂皮样囊肿或椎体异常(融合或半椎体)。在本病例中,患儿未表现出眼睛发育异常,但同时出现了耳廓畸形及椎体发育异常,并出现累积其他系统的情况(单侧肾缺如)。OAVS正确完善的诊断是治疗的前提。对于疑似OAVS患者,应完善其他系统评估以发现其他系统缺陷,尽早于相关科室就诊。而颌面部畸形严重影响患者的外貌和心理健康,应尽早手术矫治。对于耳廓畸形,目前公认的手术时间为8岁左右,年龄过小肋软骨尚未发育完全,而年龄过大择肋软骨出现钙化,影响雕刻效果[6,7]。近年来也出现了一些人工材料用以代替肋软骨,如medpor支架,其优点在于不需要术者术中雕刻,对手术技巧要求不高,其次肋软骨支架对血供要求较高,而人工材料择对血供无依耐性,同时也适用于肋软骨钙化的患者[8]。OAVS多为传导性聋,根据畸形程度选择助听器或手术治疗均能提高患耳听力。其中Frenzel等在2013年根据高分辨CT的结果提出了一个术前评价标准,致力于更好的评估手术治疗的可行性,纳入的评价指标有乳突和中耳的气化情况、前庭窗、面神经走行等,总分是16分,16~13分是简单组、12~9分是中等组、8~5分是困难组、4~0分是高风险组,简单组通过手术获得良好听力的可能性大,而困难组则不建议行中外耳成形术[9]。对于不符合手术条件的患者,可行BAHA、人工耳蜗植入术[10]。本例中患儿已于我院完成Ⅰ期及Ⅱ期耳廓成形术(见图4-5),颞骨CT发现其中耳结构完整,听骨链分化好,行中外耳成形术有很高的机会获得较好听力,本例患儿计划二期术后软骨支架稳定存活后再行外耳道及鼓室成形术以改善听力。
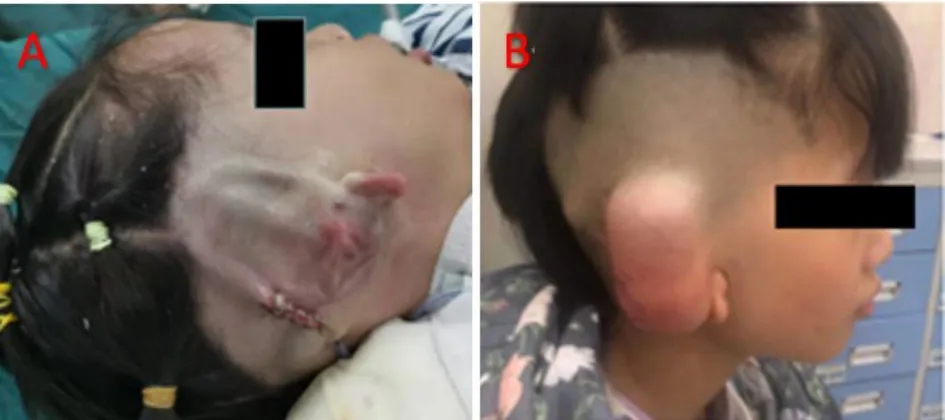
图4 一期术后侧面观。A.术后即刻;B.水囊注水后Fig.4 Lateral view after the first stage.A.Immediately after operation;B.After water injection

图5 Ⅱ期术后形态Fig.5 The view after the second stage
OAVS发病机制目前尚不清楚,目前认为是环境及遗传多种因素共同作用的结果。咽弓在胚胎第4周开始发育,由间充质细胞组成,而颅面发育的一个重要特征是脑神经嵴细胞的形成。因此该过程中某些基因及蛋白质的表达可能决定了OAV的表型特征及严重程度。目前研究认为妊娠期糖尿病、血管活性药物,吸烟和多胎妊娠等环境因素均会影响该病的发生[3]。近年来遗传因素越发受到学者的关注,也提出了一些遗传学证据及模式。对于有明显家系的患者,能观察到常染色体显性遗传特征。而大多数患者为散发病例,也发现了一些基因突变或染色体异常。比如涉及WNT5B基因的5p13.3-pter区域缺失。22q区域异常也多次被观察到,其一般表现为部分区域缺失或者22三体。而Lopez E的研究则第一次确定了一个致病基因MYT1。其研究认为突变型MYT1无法调控全反式维A酸受体而导致OAVS发生,但拥有该突变的病例比例较低[11]。值得一提的是,本例患儿为孪生儿,其孪生姐姐颌面部外观正常,亦未发现相关系统异常。此前已有研究指出,多胎出现OAVS概率较单胎更高。K.Lawson等调查的调查结果表明双胎及多胎妊娠OAVS患病率高于一般人群,他们认为导致这种现象的原因是在分化过程中双胎之一出现血管出血或梗塞导致组织供血不足进而分化异常[12]。但其研究仅认为环境因素导致发病,未对遗传因素进一步评估。本例中患儿父亲存在并趾畸形,虽然暂未发现其家族存在相似的病例,但我们认为仍不能排除遗传因素,其家系遗传信息将于后续研究中进一步报道。
OAVS是一种复杂的临床综合征,临床表现复杂多样,但只要抓住其特征性表现即能作出该综合征的诊断。在治疗上应该多学科协助进行,其发病率较低,在多胎妊娠中发病率较一般人群高,目前大部分观点认为其发病是环境及遗传共同作用的结果,但仍有待更深入的研究,为该疾病的早期诊断及防治提供理论依据。
——外耳道成形技术进展
——护肾

