非小细胞肺癌患者外周血PD-L1蛋白的表达及其对治疗效果的评估作用*
王丽, 刘成凤, 魏丽群, 尚静, 彭瑛, 张燕
(1.乐山市中医医院 肿瘤血液科, 四川 乐山 614000; 2.西南医科大学附属医院 检验部, 四川 泸州 646000; 3.西南医科大学附属中医医院 肿瘤血液二科, 四川 泸州 646000)
研究发现,肺癌的已成为了人类死亡的重要因素之一[1-2]。研究指出,非小细胞肺癌(non-small-cell lung cancer,NSCLC)患者的预后不良与肿瘤转移具有密切的关联[3]。循环肿瘤细胞是自发或经外界因素进入外周血循环的肿瘤细胞[4],肿瘤转移的初始阶段癌细胞可少量存活并形成转移灶[5]。T淋巴细胞是可被抗原特异性激活的肿瘤免疫应答效应细胞[6],而程序性细胞死亡配体1(recombinant programmed cell death protein 1 ligand 1,PD-L1)是一种通过与PD-1受体结合而调控免疫应答的负性T细胞类共刺激分子[7]。PD-L1基因在体内广泛表达,受体主要为PD-1,因PD-1可对T细胞进行调控,因此PD-1配体与其结合后会抑制T细胞活化[8]。肿瘤学检查的传统方法主要是影像学和组织病理学方法,但均存在一定的缺点,如影像学检测无法对微小转移灶进行发现和跟踪,组织病理学检查的重复性差,这些检查对肿瘤的发展进程无法实时监测[9]。近年来液态活检技术因循环肿瘤细胞获取简便、创伤小、易于连续监测的优点已成为实时疗效监测和肿瘤无创诊断的工具,该技术发展潜力巨大,在肿瘤领域具有一定的临床研究价值[10-11],但关于外周血循环肿瘤细胞活检技术用于预测临床疗效及预后的研究较少,且PD-L1蛋白表达在临床疗效中的诊断效果更为少见,因此本研究拟通过分析NSCLC患者外周血循环肿瘤细胞中PD-L1蛋白表达与治疗效果的相关性,为NSCLC患者的治疗和预后检测提供实验依据。
1 对象与方法
1.1 对象
选择2018年10月—2019年4月临床诊断和病理学分析确诊的原发性NSCLC患者作为实验组,纳入标准:(1)NSCLC初治患者;(2)年龄≥18周岁,性别不限;(3)入组前1个月内未进行NSCLC相关治疗;(4)认知、精神疾沟通能力均正常;(5)自愿参与本次研究并签署知情同意书。排除标准:(1)合并其他恶性肿瘤或全身感染者;(2)合并心、肝、肾等脏器功能不全者;(3)妊娠期或哺乳期者。纳入32例患者作为实验组,男18例、女14例,年龄21~67岁、平均(48.21±6.44)岁,体质量指数(body mass index,BMI)21~26 kg/m2、平均(23.32±1.79)kg/m2。同时选取32例健康志愿者作为对照组,男20例、女12例,年龄20~70岁、平均(46.79±6.15)岁,BMI 21~25 kg/m2、平均(22.48±1.57)kg/m2。2组受试者一般资料比较,差异均无统计学意义(P>0.05)。本研究已获得医院伦理委员会批准(20180902)。
1.2 方法
1.2.1治疗方法 实验组患者采用替吉奥联合奈达铂化疗,口服替吉奥(江苏恒瑞医药股份有限公司,国药准字H20113281)40 mg/次、2次/d,连续14 d;静脉滴注奈达铂(江苏奥赛康药业股份有限公司,国药准字H20064294)、500 mL/次、75 mg/m2溶入生理盐水、1次/d,连续42 d。
1.2.2静脉血采集 采集2组受试者治疗前1 d的清晨空腹静脉血10 mL置于乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA;德国Merck公司)抗凝管中,血液采集完成的1 h内进行肿瘤细胞的富集。
1.2.3磁珠富集和循环肿瘤细胞评估 使用质量分数40%的羟乙基淀粉550料液、质量分数60%的泛影葡胺料液制取并过滤获取2组受试者的淋巴细胞分离液,将淋巴细胞分离液和血液混合加热至25 ℃,加抗凝血7.5 mL和等量磷酸盐缓冲溶液(phosphate buffered solution,PBS;山东博科生物产业有限公司)混匀,缓慢贴壁倒入加热后的淋巴细胞分离液上层面,室温、2 000 r/min离心15 min;取环状乳白色单核细胞层,加PBS 5 mL洗涤处理2次,室温2 000 r/min离心15 min,并将沉淀细胞重悬置于磁珠缓冲液(备案号20180004,洛阳吉恩特生物科技有限公司)中,并加抗体20 μL,4 ℃孵育15 min;加磁珠缓冲液2 mL,离心取上层,取重悬细胞500 μL经过磁珠甲基丙烯酸甲酯-苯乙烯共聚物(methyl methacrylate-styrene copolymer,MS)分流柱,重复2次洗涤MS分流柱,采集分流出的溶液,室温3 000 r/min离心15 min,弃上清液,取沉淀物均匀放置于载玻片,风干,4%多聚甲醛固定;荧光显微镜下观察循环肿瘤细胞阳性表达(细胞呈长型、椭圆形、圆形,其核质比血细胞体积大,淡黄色、棕黄色及棕黑色分别表示弱阳性、中等阳性及强阳性)并计算阳性率[12]。
1.2.4PD-L1蛋白检测 取富集后循环肿瘤细胞玻片,加封闭液,室温孵育30 min,加稀释后PD-L1抗体、CD45荧光抗体,室温孵育2 h,CYP2洗3次、3 min/次,加稀释后荧光抗体DRG,37 ℃孵育30 min,加DAPI细胞染色液10 μL,盖玻片封片,置于荧光显微镜下读片,将PD-L1(+)DAPI(+)CD45(-)的细胞判定为PD-L1阳性循环肿瘤细胞;以人肺腺癌细胞系NCI-H1975为阳性对照,以健康人外周血作为阴性对照组。其中PD-L1兔单克隆抗体购自上海Roche公司,PD-L1蛋白检测试剂盒购自江苏莱尔生物医药科技有限公司。
1.2.5血清干扰素-γ(interferon γ,IFN-γ)和群集分化8(cluster differentiation 8,CD8)+T细胞浸润水平检测 采集实验组患者治疗前1 d清晨空腹静脉血10 mL,3 000 r/min离心15 min,取上层血清,使用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)试剂盒对血清IFN-γ进行检测,并于荧光显微镜下观察并计算CD8+T细胞比率。
1.2.6临床疗效和预后判断[13]观察实验组患者治疗结束后30 d的临床疗效,按RESIST疗效评价标准,CR(完全缓解)全部病灶消失维持4周,PR(部分缓解)病灶缩小≥30%维持4周,SD(稳定)缩小不足30%或增大不足20%,PD(进展),病灶增加20%,同时规定治疗结束后30 d内复发为预后较差,未复发为预后良好。
1.2.7临床资料收集 收集实验组患者的临床指标,包括性别、年龄、肿瘤组织学类型、吸烟、疾病疾病家族史、远处转移及肿瘤原发灶(tumor, T)、区域淋巴结受累(node, N)、远处转移(metastasis, M)及TNM分期。
1.3 统计学分析

2 结果
2.1 外周血循环肿瘤细胞
实验组患者外周血循环肿瘤细胞检出率明显高于对照组,差异有高度统计学意义(P<0.01)。见表1。
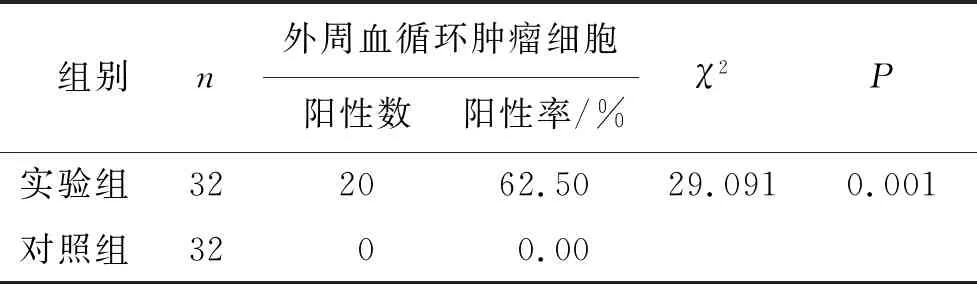
表1 实验组和对照组受试者外周血循环肿瘤细胞
2.2 实验组患者外周血循环肿瘤细胞中PD-L1蛋白的表达
20例循环肿瘤细胞阳性的实验组患者外周血中有14例检测到不同程度的PD-L1荧光信号,阳性表达率为70.00%,其中弱阳性、中等阳性及强阳性表达分别为7、4及3例。见图1。
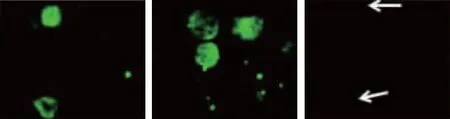
弱阳性 中等阳性 强阳性
2.3 实验组患者外周血循环肿瘤细胞PD-L1蛋白表达与临床病理特征的关系
实验组患者外周血循环肿瘤细胞中PD-L1蛋白表达与患者年龄、性别、组织学检测及疾病家族史等无关(P>0.05),与吸烟、TNM分期和远处转移有关(P<0.05)。见表2。
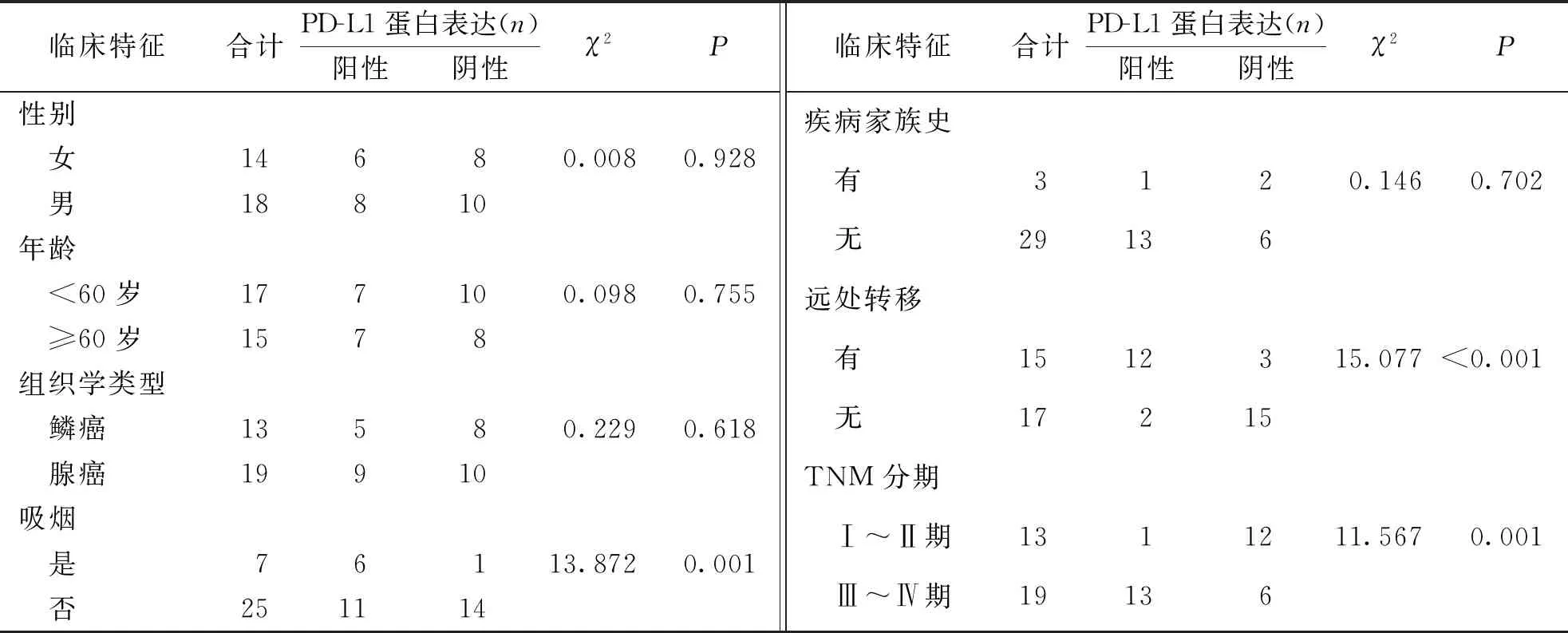
表2 实验组患者外周血循环肿瘤细胞PD-L1表达与NSCLC临床病理特征的关系
2.4 实验组患者外周血血清IFN-γ及CD8+ T与循环肿瘤细胞PD-L1表达与的相关性
实验组患者外周血循环肿瘤细胞PD-L1蛋白表达阴性者血清IFN-γ水平及CD8+T细胞或单核细胞比例高于阳性者,差异有统计学意义(P<0.05);IFN-γ≤29 ng/L时与PD-L1蛋白表达呈正相关(r=0.658,P<0.05),IFN-γ>29 ng/L时二者呈负相关(r=-0.476,P<0.05);CD8+T细胞或单核细胞比例≤43%时与PD-L1蛋白表达呈正相关(r=0.733,P<0.05),CD8+T细胞或单核细胞比例>43%时二者呈负相关(r=-0.357,P<0.05)。见表3。
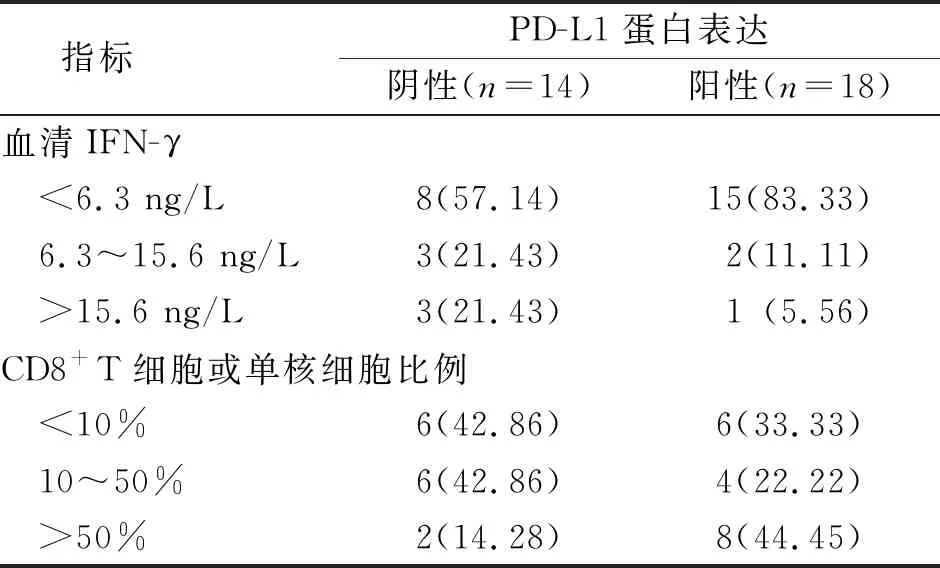
表3 实验组患者外周血循环肿瘤细胞PD-L1表达与血清IFN-γ及CD8+T的关系[n(%)]
2.5 实验组患者外周血循环肿瘤细胞中PD-L1表达与临床疗效及预后的相关性
Spearman分析显示,实验组患者外周血循环肿瘤细胞中PD-L1表达与其临床疗效呈负相关(r=-0.622,P<0.001);实验组患者外周血循环肿瘤细胞中PD-L1表达与其预后呈负相关(r=-0.557,P<0.001)。见表4。
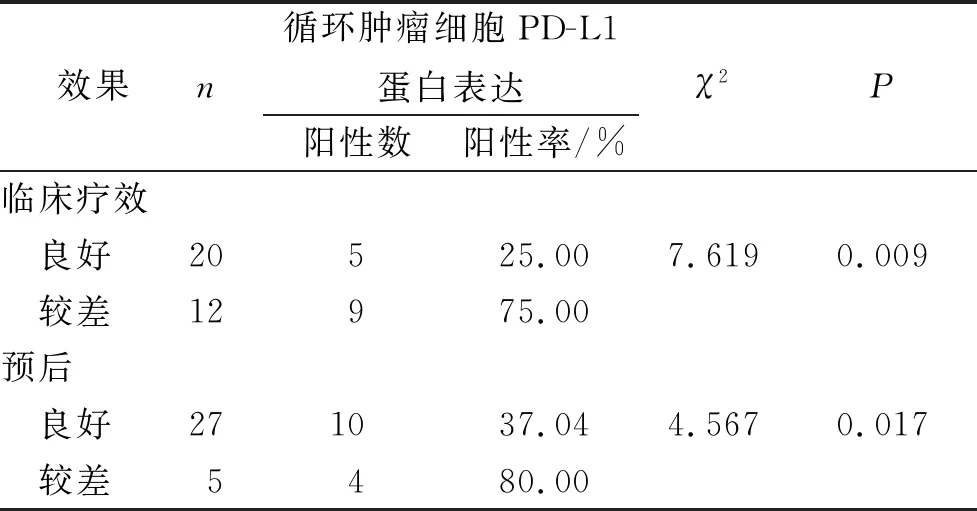
表4 实验组患者外周血循环肿瘤细胞PD-L1表达与临床疗效及预后的关系
3 讨论
肺癌是常见的恶性肿瘤,由于其早期症状的不明显性,极易错过手术治疗的最佳时间,导致确诊时间较晚,死亡风险较高[14]。因此,早期发现和诊断是治疗肺癌、延长患者生活质量和生存时间的最好方法[15]。胃癌、胰腺癌及肺癌等多种恶性肿瘤均可通过诱导PD-L1蛋白高表达形成机体免疫抑制性,以此逃避机体产生的抗肿瘤反应[16]。研究报道,各类肿瘤细胞内PD-L1蛋白均呈现高表达,且与癌细胞免疫逃逸相关[17-18]。有报道发现PD-L1蛋白表达与肿瘤间质细胞有着一定关系,在原发性肝癌患者的癌旁单核巨噬细胞可通过促进PD-L1分子表达避开T细胞免疫[19-20]。本研究发现外周血循环肿瘤细胞检出率实验组高于对照组,且与患者吸烟、疾病分期和远处转移具有一定的相关性,治疗后无论疗效如何循环肿瘤细胞阳性检出率均下降,同时PD-L1蛋白在疗效较差组的循环肿瘤细胞血液内表达较疗效良好组升高,这说明PD-L1在NSCLC的肺泡巨噬细胞和淋巴细胞内的表达水平高于癌细胞内水平,其阳性表达可能和NSCLC及淋巴结转移具有正相关性,且和预后具有明显的负相关性。Liu等[21]发现47例NSCLC患者的循环肿瘤细胞及淋巴细胞、巨噬细胞的阳性表达率为48.93%、61.70%,同时其表达情况与肺癌患者淋巴转移和临床分析具有正相关性,与预后生存具有负相关性;Sughayer等[22]对208例NSCLC患者体内PD-L1蛋白表达进行研究,结果显示PD-L1阳性检出率达到65.3%,并与淋巴转移和吸烟史呈负相关性。上述研究均与本研究结果相似。
本研究结果显示循环肿瘤细胞PD-L1蛋白表达与患者吸烟、疾病分期和远处转移密切相关,Spearman分析结果则提示PD-L1表达与临床疗效、预后均呈负相关关系,提示通过对NSCLC患者的外周血循环肿瘤细胞中PD-L1表达水平进行检测,有利于探究患者免疫微环境中的免疫抑制特征,帮助临床肿瘤免疫治疗的有效应用。
IFN-γ可提高抗原递呈能力,提高巨噬细胞功能,提高Th1细胞的活性及细胞免疫力,调节T细胞的活化与增殖[23]。细胞毒性T淋巴细胞可分泌多种免疫调节因子,杀伤抗原物质,是机体重要的免疫防线[24]。本研究中实验组患者中阴性者血清IFN-γ水平及CD8+T细胞或单核细胞比例均高于阳性者,且二者与PD-L1蛋白表达均存在相关性,这提示NSCLC细胞可通过PD-L1分子对微环境中IFN-γ水平及CD8+T细胞或单核细胞比例进行调节,对免疫功能产生影响,提示通过监测PD-L1蛋白表达能够了解NSCLC患者的免疫能力。然而Nunesx等[25]对手术治疗NSCLC患者进行研究发现,52例患者组织中PD-L1均表达,但与患者的年龄、吸烟史、性别、TNM分期等无相关性,与患者的预后效果亦无关。这与本研究结果不同,可能与本研究样本量较少有关,今后应进一步探究,提高研究的准确性。另外,本研究纳入对象均为初发NSCLC患者,未对复发NSCLC患者进行研究分析,亦可能会导致研究结果偏差。
综上所述,检测NSCLC患者循环肿瘤细胞的血液中PD-L1表达情况可帮助指导临床治疗,但对于实现NSCLC患者治疗效果的评估仍存在一定的局限性,如PD-L1的表达受多种因素的影响,从而使得其特异性较差。因此,今后可通过更为深入的研究确定PD-L1作为预测NSCLC治疗效果有效生物标志物的可行性,并研制出涵盖多层面的预测生物标志物体系。

