LMP基因多态性与脊髓灰质炎疫苗诱导抗体应答的相关性*
王艳鹏, 史磊, 韩雪, 李菁, 李传印, 张新文, 杨净思, 姚宇峰, 史荔, 刘舒媛
(中国医学科学院 & 北京协和医学院 医学生物学研究所, 云南 昆明 650118)
疫苗是预防感染性疾病的最有效手段,但即使是已证实高度有效的传统疫苗,也很难达到100%的保护效果。以脊髓灰质炎疫苗为例,早期的报道显示,脊髓灰质炎灭活疫苗(inactivated poliomyelitis vaccine, IPV)或脊髓灰质炎减毒活疫苗(oral poliomyelitis vaccine, OPV)全程接种后,保护效果可达到90%以上[1]。而前期开展的IPV+两价口服脊髓灰质炎减毒活疫苗(bivalent oral poliovirus vaccine, bOPV)序贯免疫接种临床研究表明,2剂IPV和1剂bOPV免疫后,脊髓灰质炎病毒Ⅰ、Ⅱ、Ⅲ型抗体阳转率分别为98.9%、79.5%及100%,而在非易感者中,Ⅱ型抗体阳转率仅为39.3%[2]。另一方面,疫苗诱导产生的抗体滴度也显示出极大的个体差异,可从0~16 384不等[3]。研究发现,中国和韩国人群接种乙脑减毒活疫苗后,血清保护率可达到94%以上[4-5],但在印度人群中仅为67.2%[6]。新生儿、婴幼儿在接种乙肝疫苗后,80%~90%的人可产生抗乙肝表面抗体;而2~5岁儿童中抗体阳转率为91%,成年人中仅为30%~90%[7]。以上研究表明疫苗接种后的抗体反应是多种因素共同作用的结果,如年龄、性别、人种、疫苗抗原的种类等都可能影响疫苗的免疫效果,尤其是个体的遗传因素在免疫应答中发挥着重要作用。一项对双生子的研究发现,乙肝、脊髓灰质炎、破伤风、白喉疫苗的抗原特异性应答与遗传因素的关联性分别为77%、60%、44%及49%,即60%的脊髓灰质炎疫苗所诱导的抗体水平由遗传因素决定[8]。疫苗接种后,需要经主要组织相容性复合体(major histocompatibility complex, MHC) Ⅰ类或Ⅱ类抗原呈递通路诱导有效的细胞免疫和体液免疫应答,低相对分子量蛋白酶体(low molecular weight polypeptide, LMP)是Ⅰ类抗原呈递通路的重要分子之一,又被称为β蛋白酶体亚单位(proteasome subunit beta, PSMB),包括LMP2和 LMP7。LMP主要作用是将内源性或外源性抗原水解为合适的肽段,随后抗原肽经抗原相关转运体(transporter associated with antigen processing, TAP)转运至内质网与特异的MHC Ⅰ类分子结合形成Ⅰ类肽加工复合体(peptide loading complex, PLC),表达于细胞表面供CD8+T细胞识别,进而启动免疫应答。研究发现,敲除LMP2和LMP7基因的小鼠的CD8+T淋巴细胞数量降低到野生型小鼠的60%~70%,而细胞表面 MHC Ⅰ类分子的表达水平是野生型小鼠的55%~90%[9]。LMP基因位于MHC Ⅱ类基因区域内[10],其基因多态性与丙肝、结核等多种疾病的发生相关[11]。推测LMP基因变异可能改变LMP结构,从而影响抗原肽的转运以及与MHC Ⅰ类PCL的形成,而导致机体的免疫应答改变,单核苷酸多态性(single nucleotide polymorphism, SNPs)是人类基因组中常见的遗传变异。本研究选取LMP2基因SNPs 位点rs17587和LMP7基因的SNPs位点 rs2071543进行基因分型,首次开展了LMP基因多态性与脊髓灰质炎疫苗诱导的抗体应答相关性研究,尝试探讨机体遗传因素在脊髓灰质炎疫苗诱导的免疫应答中的可能作用,为疫苗基因组学研究奠定基础。
1 资料与方法
1.1 资料
1.1.1研究对象 选取广西壮族自治区357名2~3月龄健康未接种过脊髓灰质炎疫苗的婴幼儿进行研究,所有个体在接种前28 d内均无其它疫苗接种史,并取得监护人知情同意。
1.1.2主要仪器和试剂 QIAamp全血基因组 DNA 提取试剂盒(QIAamp DNA Blood Mini Kit,QIAGENE公司,德国),基因分型试剂(TaqMan Genotyping Master Mix,ABI公司,美国),TaqMan探针分型试剂盒(rs17587探针试剂盒编号为C___8849004_1_,rs2071543探针试剂盒编号为C__15869253_10,ABI公司,美国),ND-2000微量紫外可见分光光度计(Thermo Fisher Scientific公司,美国),QuantStudio 6实时荧光定量PCR仪(ABI公司,美国)。
1.2 方法
1.2.1疫苗接种和样本收集 采用0、1及2月龄免疫程序,对研究个体接种2剂IPV和1剂bOPV。免疫前和3针免疫后第28天采集空腹静脉血2.5 mL,3 000 r/min离心5 min分离血清,-20 ℃保存供抗体检测用;同时采集空腹静脉血5 mL,EDTA 抗凝,供DNA提取用。
1.2.2中和抗体检测 采用微量中和试验检测脊髓灰质炎病毒Ⅰ、Ⅱ、Ⅲ型中和抗体滴度,计算抗体阳转率和中和抗体几何平均滴度(geometric mean titer, GMT),中和抗体效价经log2转换后进行分析比对。
1.2.3DNA提取 采用DNA提取试剂盒提取外周血基因组DNA。使用超微量紫外可见分光光度计进行DNA浓度和纯度检测后,-80 ℃保存。
1.2.4LMP基因SNPs分型 采用TaqMan探针基因分型法对LMP2基因的SNPs位点rs17587(G>A)和LMP7基因的SNPs位点rs2071543(G>T)的进行基因分型(位点信息见表1)。PCR反应体积为5 μL,包括Mix 2.5 μL、双蒸水 1.25 μL、引物0.25 μL、DNA样本1 μL,反应条件为95 ℃预变性10 min,92 ℃变性15 s、60 ℃退火延伸1 min,共40个循环,最后40 ℃长延伸5 min。使用TaqMan Genotyper Software软件对结果进行分析,选取每个位点不同基因型的样本进行测序验证。

表1 LMP基因2个SNPs位点的相关信息
1.3 统计学方法
使用PLINK软件(Shaun Purcell研发, 1.9版本)进行样本哈迪-温伯格平衡(Hardy-Weinbergequilibrium)检验,计算每个SNPs位点的等位基因和基因型频率。采用GraphPad Prism 7软件(Graphpad公司, 7.0版本)进行统计学分析,采用unpairedttest分析性别及等位基因间脊髓灰质炎病毒中和抗体GMT水平差异,采用One-way ANOVA分析基因型间脊髓灰质炎病毒中和抗体GMT水平差异。每个SNPs的统计学差异均采用Bonferroni校正,当统计学结果中P<0.025(0.05/n,n=2),说明差异具有统计学意义。
2 结果
2.1 研究对象基本情况
本研究共选取357名婴幼儿,其中男197例、女160例,3种型别的脊髓灰质炎病毒中和抗体GMT水平在男女婴幼儿间比较,差异无统计学意义(P>0.05)。见表2。
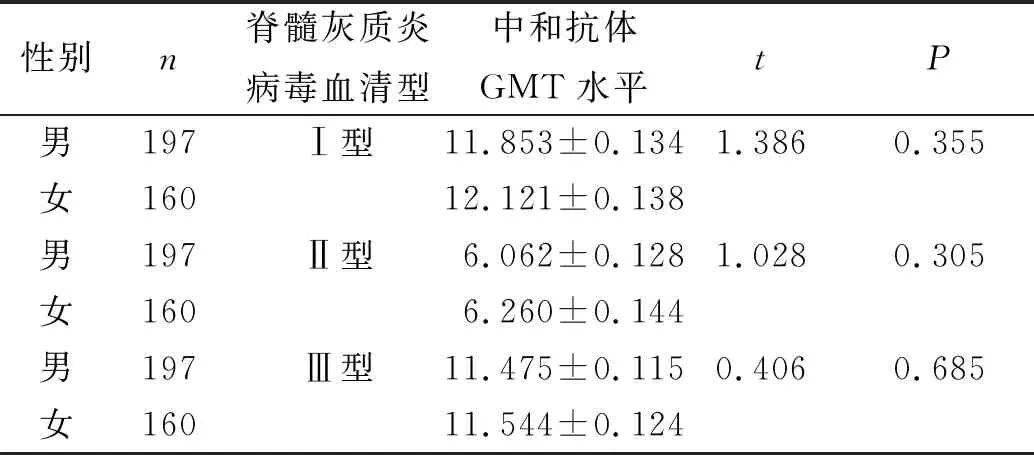
表2 不同性别婴幼儿的3种型别的脊髓灰质炎病毒中和抗体GMT水平比较
2.2 样本的代表性检验
结果显示, rs17587位点(P=0.202)和rs2071543位点(P=0.259)的基因型频率在人群中的分布符合Hardy-Weinberg平衡(P>0.05),表明所选取的样本具有群体代表性。
2.3 不同脊髓灰质炎病毒血清型、不同等位基因婴幼儿中和抗体GMT水平
结果显示,携带rs17587-A等位基因个体的脊髓灰质炎病毒Ⅰ、Ⅱ、Ⅲ型中和抗体GMT水平与携带G等位基因个体的中和抗体GMT水平比较,差异无统计学意义(P>0.05);携带rs2071543-G等位基因个体的脊髓灰质炎病毒Ⅰ、Ⅱ、Ⅲ型中和抗体GMT水平与携带T等位基因的中和抗体GMT水平比较,差异无统计学意义(P>0.05)。见表3。
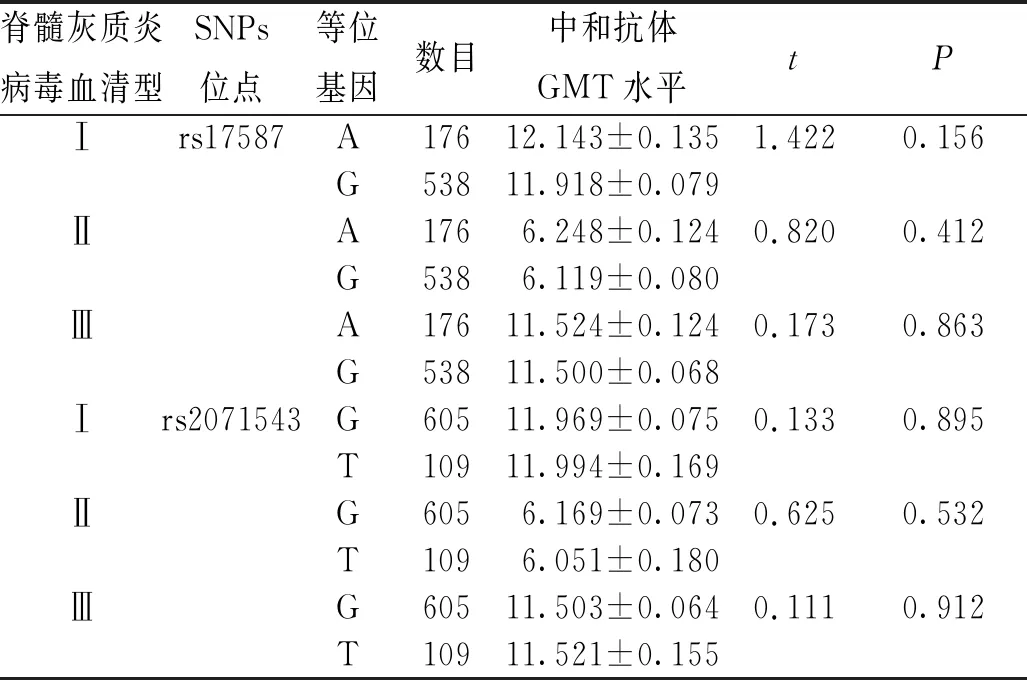
表3 不同脊髓灰质炎病毒血清型、不同等位基因婴幼儿中和抗体GMT水平比较
2.4 不同脊髓灰质炎病毒血清型、不同基因型婴幼儿中和抗体GMT水平
结果显示,LMP基因rs17587-AA基因型携带者的脊髓灰质炎病毒Ⅱ型中和抗体GMT高于AG和GG基因型携带者(P<0.05),但经Bonferroni校正后,LMP基因rs17587-AA基因型携带者的脊髓灰质炎病毒Ⅱ型中和抗体GMT高于GG基因型携带者,但差异无统计学意义(P>0.05);rs17587位点和rs2071543位点不同基因型携带者的脊髓灰质炎病毒Ⅰ、Ⅲ型中和抗体GMT水比较,差异无统计学意义(P>0.05)。见表4。
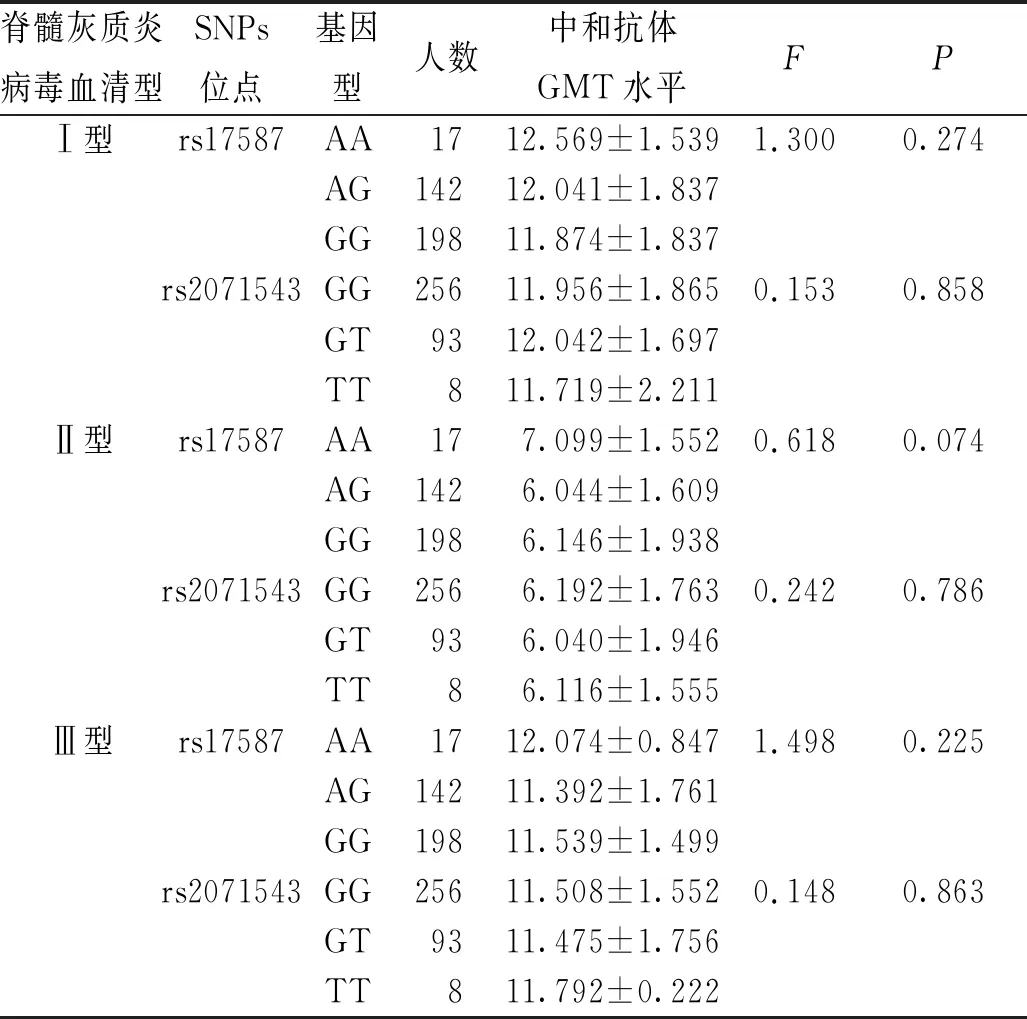
表4 不同脊髓灰质炎病毒血清型、不同基因型婴幼儿中和抗体GMT水平
2.5 LMP基因2个SNPs位点与脊髓灰质炎病毒Ⅱ型抗体阳转的相关性
脊髓灰质炎疫苗基础免疫1月后,脊髓灰质炎病毒Ⅰ、Ⅲ型抗体完全阳转,而Ⅱ型阳转率为79.8%。因此,将样本分为Ⅱ型抗体阳转组[包括免疫前血清Ⅱ型脊髓灰质炎病毒中和抗体阴性(血清脊髓灰质炎病毒中和抗体效价<1 ∶8),免疫后血清脊髓灰质炎病毒中和抗体为阳性(血清脊髓灰质炎病毒中和抗体效价≥1 ∶8)的个体,以及免疫前血清Ⅱ型脊髓灰质炎病毒中和抗体阳性且免疫后血清中和抗体≥4倍增长的个体]和非阳转组(包括免疫前Ⅱ型脊髓灰质炎病毒中和抗体为阴性且免疫后血清中和抗体效价仍为阴性的个体以及免疫前血清Ⅱ型脊髓灰质炎病毒中和抗体为阳性且免疫后血清中和抗体效价<4倍增长的个体),比较2组间2个SNPs位点的等位基因及基因型频率。结果显示,不同等位基因以及基因型携带者的脊髓灰质炎病毒中和抗体阳转率比较,差异无统计学意义(P>0.05)。见表5。
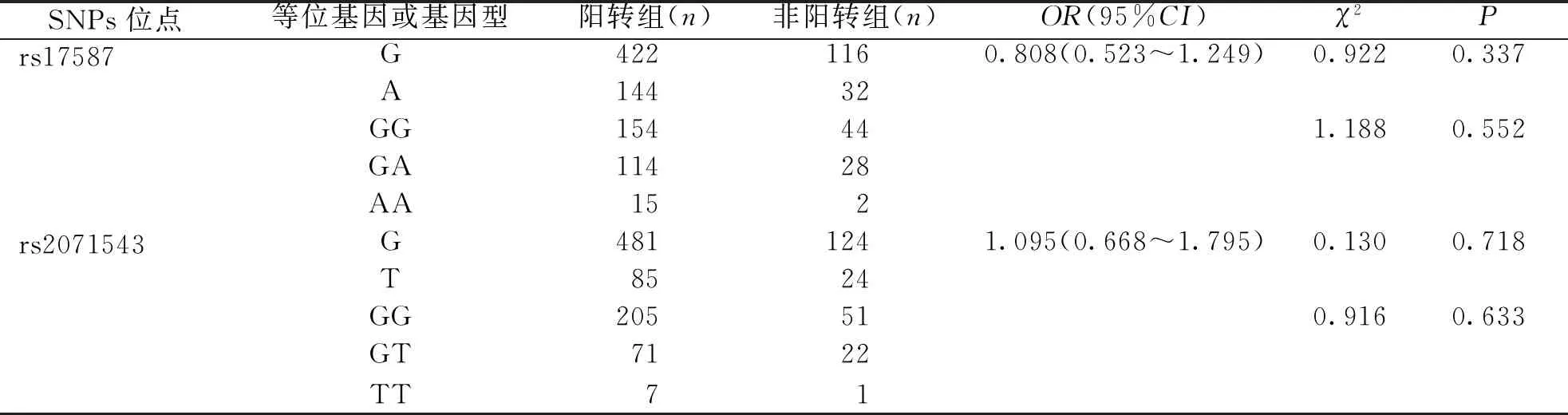
表5 Ⅱ型脊髓灰质炎病毒抗体阳转率与LMP基因多态性的相关性
2.6 LMP基因SNPs与免疫前脊髓灰质炎病毒抗体水平的关系
前期研究发现,母传抗体可影响脊髓灰质炎疫苗接种后的抗体应答。脊髓灰质炎疫苗接种后,脊髓灰质炎病毒Ⅱ型抗体在接种1剂sIPV+2剂bOPV组、接种2剂sIPV+1剂bOPV组,Ⅲ型抗体在接种2剂sIPV+1剂tOPV组易感者(免疫前抗体阴性)和非易感者(免疫前抗体阳性)中差异具有统计学意义。因此,本研究将样本分成免疫前阴性组和免疫前阳性组,比较其等位基因及基因型频率在2组间的分布差异。结果显示,LMP基因SNPs位点rs17587和rs2071543的等位基因及基因型频率在2组中比较,差异无统计学意义(P>0.05)。见表6。
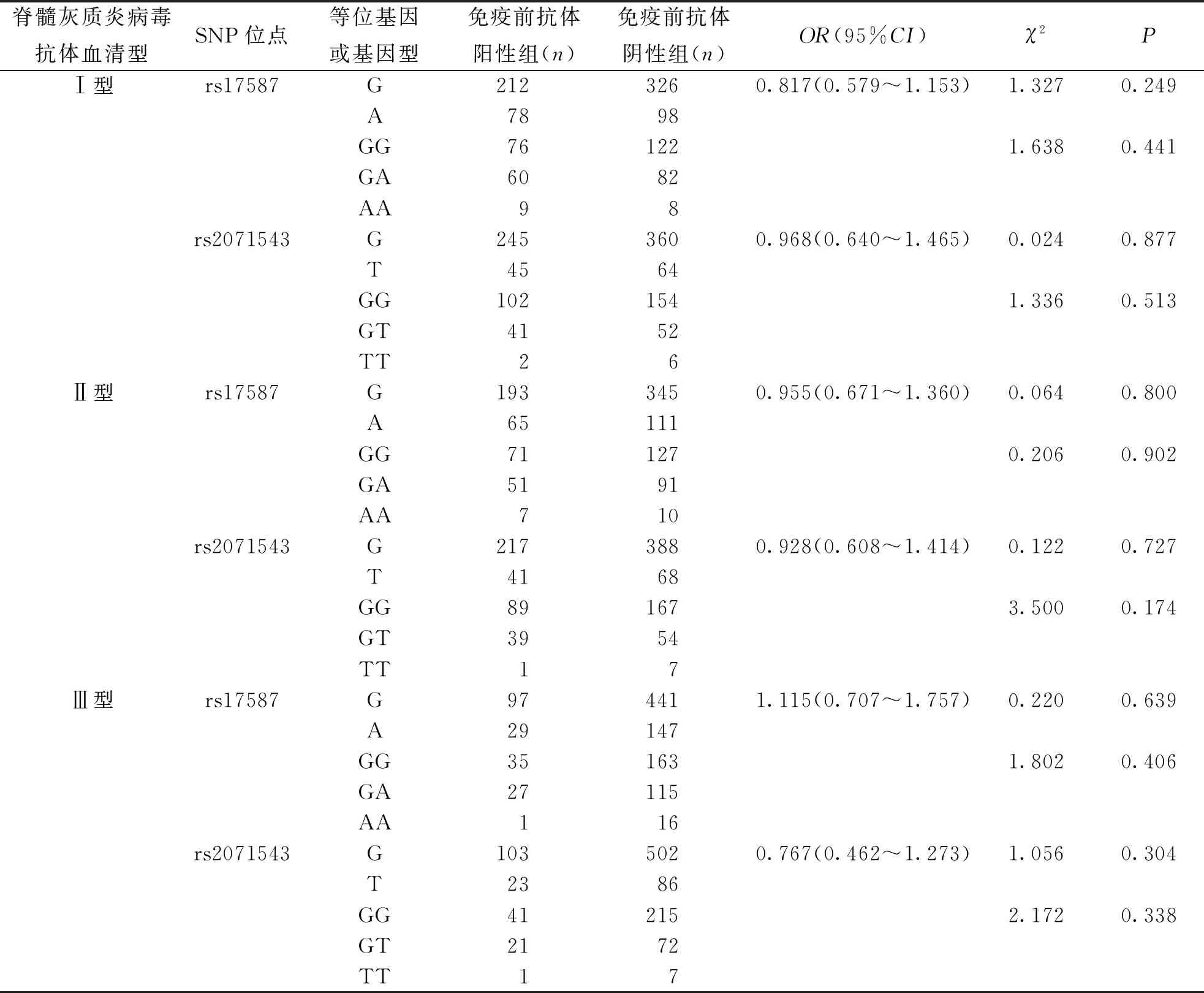
表6 免疫前抗体阳性组和阴性组LMP基因2个SNPs位点的等位基因和基因型频率比较
3 讨论
MHC在疫苗诱导的抗体应答中起到了重要的作用。研究表明MHC与乙肝疫苗反应的相关性占据了所有遗传因素的40%[12];而在风疹疫苗诱导的抗体反应中则占据了20%[13]。此外,MHC等位基因的多态性影响着麻腮风疫苗、乙脑疫苗、乙肝疫苗等诱导的抗体水平[13-16]。除MHC外,MHC区域的多个SNPs多态性也与乙肝、肺炎球菌等疫苗接种后特异性抗体及血清IgG、IgM水平有关[9]。
作为MHC Ⅰ类抗原呈递基因通路的重要组成部分,LMP2和LMP7在MHC Ⅰ类CD8+T细胞通路的内源性和外源性抗原提呈中发挥着重要的作用[17]。在疫苗免疫应答过程中,机体抗原递呈系统基因的多态性可通过影响疫苗相关抗原的提呈,进而影响机体的免疫应答,形成不同的抗体反应。多项研究表明抗原通路基因的多态性会对疫苗的抗体应答产生影响[18-19]。
LMP2基因rs17587位点G>A的改变可导致精氨酸变成组氨酸,此改变会对蛋白酶体活性有影响,其中GG基因型与GA基因型相比,蛋白酶体活性增加。例如,Mishto等[20]发现rs17587会影响脑组织中的蛋白酶体活性。据报道,rs17587位点的A等位基因可能与更高的宫颈癌风险相关(P=0.001)[21]。LMP2基因的多态性与非小细胞肺癌的关联性研究中发现,rs17587单倍型rs1351383-rs17587-rs2127675 G-C-G在非小细胞肺癌组中以及肺腺癌分层组中的分布显著高于对照组[22]。本研究中,rs17587-AA基因型携带者的脊髓灰质炎病毒Ⅱ型中和抗体GMT水平高于rs17587-AG基因型携带者(P=0.023,Padj=0.046),但rs17587-AA与rs17587-GG的基因型比较差异无统计学意义。在脊髓灰质炎病毒Ⅱ型抗体阳转率的分析中也未见差异。提示rs17587的多态性可能不是影响脊髓灰质炎疫苗抗体应答的遗传因素。
LMP7基因rs2071543位点G>T的改变同样导致了氨基酸的变化,即甘氨酸变成赖氨酸。有研究表明,LMP7中的rs2071543位点的氨基酸的变化会导致非极性氨基酸取代了带电荷的急性氨基酸,可能会造成LMP功能的改变,改变蛋白酶体的活性,影响降解效率[23]。在一项关于宫颈癌的研究中发现,rs2071543位点宫颈上皮内瘤样病变和宫颈癌有关[21]。在一项荟萃分析中发现,rs2071543位点TT基因型增加了患乳腺癌、结直肠癌、胶质母细胞瘤、胰腺癌以及黑色素瘤的风险,携带TT基因型的个体患癌症的风险是携带GG基因型个体的2倍[24]。但在本研究中并未发现携带rs2071543不同等位基因或基因型的个体在脊髓灰质炎疫苗免疫后脊髓灰质炎病毒3种型别的中和抗体GMT水平的差异有统计学意义(P>0.05)。
母传抗体对疫苗免疫应答的干预是疫苗接种的常见问题。高雅楠等[25]发现,免疫前抗体水平可干扰IPV接种后Ⅰ、Ⅱ型抗体的应答,免疫前阴性者的应答效果优于免疫前阳性者。在IPV、OPV序贯免疫中也发现了同样现象[18]。本研究对LMP基因的关联分析发现,rs17587和rs2071543位点的等位基因频率和基因型频率在脊髓灰质炎病毒3种型别的免疫前抗体阴性组和免疫前抗体阳性组间比较,差异无统计学意义(P>0.05),提示LMP基因多态性与脊髓灰质炎疫苗诱导的抗体应答不相关。
综上,LMP基因虽然在MHC Ⅰ类抗原呈递中发挥重要作用,但rs2071543位点和rs17587位点的多态性与脊髓灰质炎疫苗免疫后抗体应答无相关性,不是影响脊髓灰质炎疫苗诱导的抗体应答的遗传因素。

