雷替曲塞与PF方案同步放疗治疗食管癌的疗效比较
夏颖 杨磊 许斌 赵慧娟 祝寅 梁靓
食管癌是我国发病率和病死率较高的消化道恶性肿瘤之一,在疾病早期其临床症状并不明显,多数食管癌患者因吞咽进行性困难或胸后部疼痛等典型症状就诊时已处于中晚期[1]。针对不适宜手术切除治疗的Ⅱ~Ⅲ期食管癌患者,临床上多采用同步放化疗治疗。5-氟尿嘧啶联合顺铂(PF方案)是食管癌的标准同步放化疗方案,但严重不良反应影响其在临床中的应用[2-3]。本文比较雷替曲塞同步放疗与PF方案同步放疗治疗Ⅱ~Ⅲ期食管癌的近期疗效。
1 资料与方法
1.1 临床资料 选取2018年1月至2019年4月经影像学及组织病理学检查确诊为Ⅱ~Ⅲ期食管鳞癌的初治患者79例。纳入标准:病灶不能手术切除或拒绝手术,KPS评分≥70分,预计生存期>6个月,无放化疗禁忌证,无其他恶性肿瘤病史。按随机数字表法分为观察组(雷替曲塞同步放疗组)39例和对照组(PF方案同步放疗组)40例。两组患者基线特征比较,差异均无统计学意义(P<0.05)。本项目经本院伦理委员会批准,患者及家属均签署知情同意书。
1.2 方法 两组患者均采取医科达直线加速器6 MV-X线进行三维适形或调强放疗,根据相关指南勾画靶区和危及器官。剂量为95%计划靶区,60 Gy的处方剂量分割30次,2.0 Gy/次,1次/d,5次/周。化疗方案:观察组为雷替曲塞2.5 mg/m2,d1静脉滴注。对照组为5-氟尿嘧啶 500 mg/m2,d1~5,顺铂 25 mg/m2,d1~3静脉滴注。化疗均于放疗第1天及第29天应用,共化疗2个周期。同时进行止吐、护胃等辅助治疗。
1.3 疗效评价 (1)治疗前均完善相关血常规、生化、鳞癌相关抗原(SCC)含量、细胞角蛋白片段19(CYFRA21-1)含量、心电图、钡餐造影、胸腹部CT、肺功能等检查。在放疗第7、14、21、28天及放疗结束后1个月再次检测血常规。在放疗第14、28天及放疗结束后1个月再次检测肝肾功能。在放疗结束后1个月复查钡餐造影、胸腹部CT、肺功能。在放疗结束后3个月再次检测血清SCC含量、CYFRA21-1含量。(2)参照世界卫生组织实体瘤治疗疗效评价标准(RECIST)1.1版评价疗效,分为完全缓解(CR)、部分缓解(PR)、稳 定(SD)及进展(PD)。总有效率=(CR+PR)例数/总例数×100%。采用门诊或电话随访1年,1年生存率=1年后存活例数/总例数×100%。(3)参照美国肿瘤放射治疗协作组(RTOG)急性放射损伤分级标准和美国国立癌症研究所不良反应评价标准(NCI-CTCAE)3.0普通毒性标准评价患者不良反应,包括血液学毒性、肝肾功能损害、消化道反应、放射性食管炎等。
1.4 统计学方法 采用SPSS 19.0统计软件。计量资料以(±s)表示,组间比较采用两独立样本t检验;计数资料以n(%)表示,组间比较采用χ2检验;等级资料比较采用Wilcoxon检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者近期疗效及1年生存率比较 见表1。

表1 两组患者近期疗效及1年生存率比较[n(%)]
2.2 两组患者治疗结束后3个月KPS评分改善情况 见表2。

表2 两组患者治疗后KPS评分比较[n(%)]
2.3 两组患者治疗结束后3个月SCC及CYFRA21-1含量比较 见表3。
表3 两组患者治疗前后SCC及CYFRA21-1含量比较(±s)
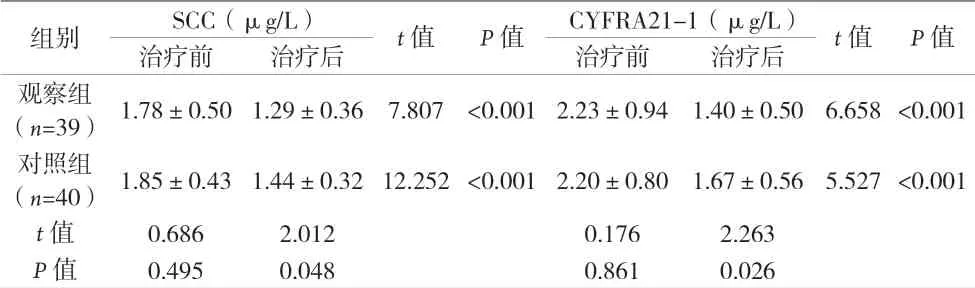
表3 两组患者治疗前后SCC及CYFRA21-1含量比较(±s)
组别 SCC(µg/L) t值 P值 CYFRA21-1(µg/L) t值 P值治疗前 治疗后 治疗前 治疗后观察组(n=39)1.78±0.50 1.29±0.36 7.807 <0.001 2.23±0.94 1.40±0.50 6.658 <0.001对照组(n=40)1.85±0.43 1.44±0.3212.252<0.001 2.20±0.80 1.67±0.56 5.527<0.001 t值 0.686 2.012 0.176 2.263 P值 0.495 0.048 0.861 0.026
2.4 两组患者不良反应发生比较 见表4。

表4 两组患者不良反应发生比较[n(%)]
3 讨论
对于不适宜根治性切除的局部中晚期食管癌患者,同步放化疗有明显优势,可以明显增加局部控制率,提高生存率,延长生存期[3]。PF方案是食管癌的标准化疗方案,但其有明显的不良反应,如消化道反应及血液学毒性等。在给药方式方面,5-FU半衰期为11.4 min,需要持续静脉滴注,给药时间长,使用不便[4]。黄毅超等[5]报道放疗联合替吉奥相较于单纯放疗治疗食管癌可以提高1年生存率,但仍增加部分不良反应。雷替曲塞选择性抑制胸苷酸合成酶活性,进而降低细胞内的DNA合成与修复能力[6-7]。雷替曲塞在体外和体内均可以增强食管鳞癌细胞的放射敏感性。雷替曲塞联合放疗降低食管鳞癌细胞的存活率及增殖率,增加细胞凋亡,且呈时间和剂量依赖性。其机制可能是雷替曲塞上调CDC2/cyclin-b1复合物及增加DNA损伤修复,导致G2/M期阻滞,从而增加放射敏感性。TE-13肿瘤细胞异种移植小鼠模型体外实验也显示雷替曲塞与放疗联合明显抑制肿瘤体积及肿瘤重量[8]。相对于单独放疗,雷替曲塞联合放疗治疗中晚期老年食管癌疗效明显增加,不良反应较轻,可以耐受[9-10]。另有国内学者报道,相比5-氟尿嘧啶,雷替曲塞有更强的放射增敏效果[11-12]。在给药方式方面,雷替曲塞15 min给药,具有更高的患者依从性。雷替曲塞的半衰期长(50~100 h),故其抗肿瘤作用时间长。本研究结果显示,雷替曲塞同步放疗治疗Ⅱ~Ⅲ期食管癌总有效率和1年生存率与PF方案同步放疗疗效相当,但安全性更高。两组CR、RR、1年生存率比较,差异无统计学意义。但相比对照组,观察组CR、RR、1年生存率均有提高趋势,同时在治疗结束后3个月,观察组SCC含量及CYFRA21-1含量显著降低,生活质量评分改善明显优于对照组,差异有统计学意义。SCC、CYFRA21-1在食管癌中有异常显示,且与预后相关。有学者报道,血清CEA和CYFRA21-1含量下降的食管癌患者生存率明显优于未下降组。食管癌单纯放疗后3年内死亡患者的CEA和CYFRA21-1水平明显高于生存患者[13-14]。故雷替曲塞同步放化疗治疗疗效确切,且在降低SCC含量、CYFRA21-1含量和生活质量评分改善方面更有优势。考虑与雷替曲塞半衰期长有关,其抗肿瘤作用时间更长。在消化道反应、放射性食管炎及白细胞下降等不良反应发生率,观察组明显更低。但观察组肝功能损害发生率高于对照组,建议合并肝功能异常患者在选择雷替曲塞作为同步化疗药物时更谨慎。
综上所述,雷替曲塞同步放疗与标准PF方案同步放疗治疗Ⅱ~Ⅲ期食管癌的疗效相当,不良反应更轻,且给药方便,值得在临床工作中推广使用。

