胃饥饿素治疗小鼠支气管哮喘的作用机制及对细胞焦亡的影响
努尔阿米娜·铁力瓦尔迪, 李 新, 韩利梅, 尼格拉·伊力哈木, 齐曼古力·吾守尔
(新疆医科大学第二附属医院 呼吸内科, 新疆 乌鲁木齐, 830063)
支气管哮喘是一种常见的呼吸系统慢性疾病,其特征常见于收缩刺激引起的气道炎症、重塑和反应过度[1-2]。细胞焦亡又称细胞炎性坏死,是一种程序性细胞死亡,表现为细胞不断胀大直至细胞膜破裂,导致细胞内容物释放而激活强烈的炎症反应[3-4]。胃饥饿素是28个氨基酸组成的多肽[5], 可以促进食欲,并参与短期摄食控制和长期能量代谢控制[6]。研究[7]显示胃饥饿素可调节促炎细胞因子的分泌,并具有抗炎作用,哮喘加重患者的胃饥饿素水平明显降低。目前研究显示胃饥饿素能够缓解哮喘的内质网应激起到治疗作用。但胃饥饿素对哮喘的疗效及细胞焦亡在其中发挥的作用尚不明确。本研究通过构建小鼠哮喘模型,研究胃饥饿素对哮喘的治疗作用及对细胞焦亡的影响,现报告如下。
1 资料与方法
1.1 实验动物与构建模型
从辽宁长生生物获得8~10周龄的SPF级(无特定病原菌级)雄性C57BL/6小鼠30只,整个实验过程均处于标准条件下(22~24 ℃和60%湿度, 12 h光照/12 h黑暗),将其置于层流柜中,并使用标准食物(SPF级饲料)。所有动物程序获得了新疆医科大学第二附属医院动物保护委员会的批准。
将小鼠随机分为对照组、模型组[卵清蛋白(OVA)造模]和治疗组(OVA联合胃饥饿素),每组10只。通过OVA(Sigma-Aldrich,USA)诱导哮喘小鼠模型,造模方法为分别在第0、14天腹腔注射含OVA(10 μg)和氢氧化铝(20 mg)的0.2 mL致敏剂进行处理,对照组用生理盐水代替。激发过程用1%体积浓度OVA制成的雾化剂,于第28~30天置于5 L密闭容器中,使小鼠暴露在OVA气雾中,每天30 min, 对照组采用生理盐水进行代理。治疗组通过嵌入小鼠皮下组织的ALZET微型渗透泵(型号2004, Durect Co, USA)在OVA第1次造模前1 d注射胃饥饿素(每天1×10-9mol/kg)(Phoenix Pharmaceuticals, USA)[6]。对照组和OVA组均装有带载液的泵。
1.2 气道反应性测定
腹腔注射动物用戊巴比妥钠麻醉(50 mg/kg)。通过颈椎中切口暴露气管并切开,然后插入18号针头。将由计算机控制的小型动物呼吸机连接至小鼠。用10 mL/kg的潮气量(呼吸频率为150次/min)和呼气末正压(2 cmH2O)准正弦通气,产生与自发呼吸相似的平均肺容量(包括将呼吸机的呼气口连接到水柱上)。通过呼吸机,内联雾化器直接产生浓度为50 μg/mL~50.0 mg/mL生理盐水的甲基胆碱气雾剂,以评估气道反应的差异。计算呼吸阻力 (RRS) 值,连续收集每次给药后的甲基胆碱。最大RRS值描述为盐水喷雾后基线的变化百分比。
1.3 肺部组织形态学染色
小鼠处死后,结扎左肺并摘除,左肺用4%甲醛固定,石蜡包埋后进行苏木精-伊红染色法(HE)染色,采用Masson染色检测纤维化,最后于尼康TS2型倒置显微镜下观察肺部组织形态,放大倍数为200倍。
1.4 肺组织巨噬细胞检测
采用免疫组织化学方法进行巨噬细胞染色,将切片与CD68抗体(Abcam,USA)于4 ℃冰箱中孵育并保存过夜,将载玻片从冰箱中取出,放入磷酸盐缓冲液(PBS)中冲洗3次,每次5 min, 擦干组织周围的PBS后加入二抗,然后置于37 ℃温箱中0.5 h, 将载玻片从温箱中取出,放入PBS中洗3次,每次5 min, 擦干组织周围的PBS后加上显色剂(显色剂的配置: 在1 mL水中加1滴二氨基联苯胺(DAB),摇匀,然后加1滴H2O2, 摇匀,再加1滴磷酸缓冲液,摇匀后,于尼康TS2型倒置显微镜下观察肺部组织形态情况,放大倍数为200倍。
1.5 支气管肺灌洗液(BALF)细胞分类计数
将1 mL注射器插入右主支气管,取1 mL PBS灌洗右肺,反复3次,回收率为80%以上。回收灌洗液后离心10 min, 收集上清液储存于-20 ℃冰箱。细胞沉淀制作涂片,以4%甲醛固定后行HE染色,于倒置显微镜下(放大倍数为200倍)计数400个细胞,分别计数嗜酸性粒细胞和中性粒细胞。
1.6 肺泡灌洗液炎症因子检测
使用酶联免疫吸附法(ELISA)(Bioscience,USA)测定BALF中的肿瘤坏死因子-α(TNF-α)和干扰素-γ(IFN-γ)水平。白细胞介素-5(IL-5)和白细胞介素-13(IL-13)的定量检测为Milliplex Cytokine Panel板(意大利)上机检测。
1.7 Western blot
用含0.1%苯甲磺酰氟(PMSF)的RIPA裂解液在冰上裂解细胞20 min, 细胞收集于1.5 mL EP管并离心,然后将上清液转移至无菌EP管中。使用BCA 蛋白检测法测量样品中的蛋白质浓度。通过聚丙烯酰胺凝胶电泳(SDS-PAGE)分离相同质量的蛋白质,并转移至硝酸纤维素膜(NC膜)。将蛋白质与含5%脱脂奶粉的磷酸盐吐温缓冲液(PBST)在室温下孵育1 h, 然后与一抗在4 ℃下孵育2 h, 孵育结束, 1×TBST洗3次,每次15 min。用1×TBST稀释HRP标记的二抗(Proteintech), 稀释比例1∶3 000, 将稀释后的二抗[山羊抗兔IgG H&L(HRP)(ab6721, 1∶10 000, Abcam)]与膜共同孵育45~60 min。孵育结束, 1×TBST洗3次,每次15 min。使用ECL化学发光液(Thermo)与膜孵育3 min, 用吸水纸吸尽液体在天能观胶仪进行检测拍照。以β-actin为内参,使用Bandscan 5.0软件分析蛋白条带,检测表达水平。
1.8 统计学分析
使用GraphPad Prism软件6.0对结果进行绘制分析。使用t检验分析比较2组间的差异。使用单因素方差分析比较3组间的差异。结果表示为平均值±标准偏差。P<0.05为差异有统计学意义。所有实验均重复3次。
2 结 果
2.1 动物行为改变情况
与对照组比较,模型组小鼠在激发期出现不同程度的鼻翼煽动和呼吸急促、食欲下降的现象。此外,个别小鼠出现腹肌抽搐及口唇紫绀等症状。治疗组小鼠在激发期有鼻翼煽动和呼吸急促表现,但未发现腹肌抽搐、口唇紫绀及食欲下降等症状,并且呼吸急促表现未随激发时间的延长而进一步加重。对照组小鼠在整个处理过程中无异常表现。
2.2 肺组织损伤情况
HE染色及巨噬细胞(CD68)染色结果显示,与对照组相比,模型组炎性细胞浸润及组织纤维化程度更加严重,而治疗组巨噬细胞浸润程度改善,3组相对炎性评分比较,差异具有统计学意义(P<0.05); Masson染色结果显示治疗组可显著改善哮喘模型导致的纤维化程度。见图1。

A: 3组HE染色、CD68染色、Masson染色图(放大倍数200倍); B: 3组相对炎性细胞评分; C: 3组相对上皮基底膜厚度。与对照组比较, *P<0.05; 与模型组比较, #P<0.05。图1 各组肺组织形态学改变及巨噬细胞浸润情况
2.3 气道反应性检测
气道反应性由侵入性呼吸系统对乙酰甲胆碱的抵抗力决定。与对照组相比,模型组呼吸系统气道阻力的剂量反应曲线增加。治疗组通过胃饥饿素的治疗显著降低了哮喘小鼠的呼吸系统的阻力(P<0.05)。见图2。

与对照组比较, *P<0.05; 与模型组比较, #P<0.05。图2 各组气道反应性检测
2.4 白细胞和炎性细胞因子的表达
模型组中哮喘模型鼠的BALF中总白细胞(图3A)以及嗜酸性粒细胞(图3B), 淋巴细胞(图3C)和嗜中性白细胞(图3D)显著增加(P<0.05); 与模型组相比,治疗组白细胞总数显著降低(P<0.05)。模型组哮喘小鼠的BALF中的TNF-α(图4A)、IFN-γ(图4B)、IL-5(图4C)和IL-13(图4D)水平高于对照组,差异有统计学意义(P<0.05)。治疗组通过胃饥饿素治疗后,TNF-α、IFN-γ、IL-5及IL-13表达水平低于模型组,差异有统计学意义(P<0.05)。见表1。
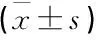
表1 各处理组炎症因子表达情况 pg/mL

A: 总细胞数量; B: 嗜酸性粒细胞; C: 淋巴细胞; D: 中性粒细胞。

A: TNF-α表达情况; B: IFN-γ表达情况; C: IL-5表达情况; D: IL-13表达情况。
2.5 胃饥饿素通过减少细胞焦亡治疗小鼠哮喘
免疫组化显示, NLRP3小体在肺组织中表达。治疗组经过胃饥饿素治疗后,肺组织中NLRP3表达量显著降低(P<0.05)。Westen Blot显示,治疗组在胃饥饿素治疗后, NLRP3、Caspase-1及白细胞介素-1B(IL-1B)表达水平显著降低(P<0.05)。见图5。

A: 免疫组化检测NLRP3(放大倍数200倍); B: NLRP3、Caspase-1、IL-1B免疫印迹条带; C: NLRP3、Caspase-1、IL-1B表达水平量化。与对照组比较, *P<0.05; 与模型组比较, #P<0.05。图5 各组细胞焦亡情况检测
3 讨 论
本研究通过构建小鼠哮喘模型,成功验证胃饥饿素治疗能够明显改善哮喘所致的炎症反应和肺组织纤维化的作用。此外,通过探讨细胞焦亡在胃饥饿素治疗哮喘的机制发现,胃饥饿素能够通过减轻哮喘所致细胞焦亡的程度,从而起到治疗哮喘的作用,这为今后的哮喘治疗提供了新的思路,并为未来靶向治疗提供了理论依据。由OVA引起的支气管哮喘小鼠模型是经典的哮喘动物模型,具有组织病理学和气道高反应性的特征[8]。本试验中, OVA处理的小鼠表现出明显的病理性气道改变和高反应性,而经过胃饥饿素治疗后均可有效改善这些呼吸系统症状。这些结果表明,胃饥饿素能够有效治疗哮喘导致的呼吸系统改变现象。研究[9-11]表明,胃饥饿素在抑制脓毒症、烧伤和饮食引起的能量代谢失衡时,可以抑制TNF-α和IFN-γ的表达,与本研究结果类似。本研究中,由OVA诱发的哮喘小鼠模型的BALF中,胃饥饿素显著抑制了TNF-α和IFN-γ水平的升高。目前,已知TNF-α和IFN-γ既是炎症反应标志物,又是参与哮喘发展的关键细胞因子[12]。本研究结果显示,胃饥饿素可能抑制这些炎症因子的表达,进而改善哮喘。
细胞焦亡表现为细胞不断胀大直至细胞膜破裂,导致细胞内容物释放,激活强烈的炎症反应[3]。其主要通过炎症小体介导的Caspase-4、5、11的激活,造成包括GSDMD在内的多种Gasdermin家族成员发生剪切和多聚化,造成细胞穿孔,进而引起细胞死亡[4]。NLRP3炎性小体及Caspase-1的表达能够反映细胞焦亡的程度[13-14]。此外, NLRP3炎性小体能够影响下游GSDMD,进一步促进细胞焦亡的发生[15]。哮喘是一种炎症相关性疾病,且细胞焦亡与炎症紧密相关,故本研究探讨了细胞焦亡在哮喘中的机制。本研究进一步检测了NLRP3和Caspase-1的表达情况,结果显示小鼠哮喘模型发生细胞焦亡的程度较重,施加胃饥饿素治疗后能够明显改善细胞焦亡程度,提示胃饥饿素可能是通过减轻细胞焦亡程度,从而发挥治疗哮喘的作用。然而,本研究并未对引发焦亡的深入机制进行探讨,作者在未来的研究中会关注其作用机制的改变情况。
综上所述,本研究表明,胃饥饿素可以通过减轻细胞焦亡程度,改善呼吸系统中的炎症反应,进而治疗哮喘,提示胃饥饿素可能是治疗哮喘的新的药物靶标。

