2型糖尿病伴肥胖患者解偶联蛋白3基因及浆细胞膜蛋白-1基因的表达研究
吴 侃, 范晓利, 吴亚平, 张婧婧
(江苏省南京市江宁医院 内分泌科, 江苏 南京, 211100)
研究[1]显示,肥胖症与遗传、患者生活习惯、生活环境等均有一定的联系。2型糖尿病(T2DM)患者合并肥胖可加重机体代谢紊乱,导致血压异常、血脂异常等。解偶联蛋白3(UCP3)是线粒体跨膜转运蛋白,可增加机体能量消耗,减轻体质量[2]。浆细胞膜蛋白-1(PC-1)可有效结合胰岛素受体而抑制受体信息传导,进而产生胰岛素抵抗[3]。研究[4]显示, PC-1基因编码区外第4外显子121位谷氨酰胺/赖氨酸多态性与机体肥胖、糖尿病等密切相关。本研究探讨UCP3、PC-1基因多态性对T2DM伴肥胖患者预后的影响,现报告如下。
1 资料与方法
1.1 一般资料
收集本院2018年6—12月120例T2DM伴肥胖患者(男58例,女62例)、120例T2DM非肥胖患者(男59例,女61例)、120例肥胖患者(男59例,女61例)、120例非T2DM非肥胖健康者(男60例,女60例)的临床资料。本研究经医学伦理会批准,所有患者均自愿参与本研究。
纳入标准: ① T2DM伴肥胖患者符合糖尿病伴肥胖诊断标准[5],包括空腹血糖≥7.0 mmol/L, 餐后2 h血糖≥11.1 mmol/L, 体质量指数为25~35 kg/m2; ② 患者均签署知情同意书。排除标准: ① 继发性高血压、严重充血性心力衰竭患者; ② 合并恶性肿瘤、造血系统障碍等疾病者; ③ 有甲状腺髓样癌(MTC)既往史或家族史患者,以及2型多发性内分泌肿瘤综合征患者; ④ 炎症性肠病和糖尿病性胃轻瘫患者; ⑤ 已知对盐酸二甲双胍和诺和力以及药品中相关成份过敏者; ⑥ 严重肝、肾功能不全的患者; ⑦ 严重的感染和外伤的患者; ⑧ 不接受资料收集者。
1.2 方法
受试者采用聚合酶链反应(PCR)和限制性内切酶片段长度多态性(PCR-RFLP)检测UCP3Tyr210Tyr(C-T)多态性基因型及PC-1基因第4外显子121位谷氨酰胺/赖氨酸多态性。取清晨空腹静脉血4 mL, 加入枸橼酸钠抗凝剂混匀,室温下高速离心,分离血浆与红细胞层之间的白细胞层,保存于-80 ℃离心管中。加入4倍体积裂红液混匀,高速离心后弃上清,重复至细胞团呈粉色。加入8倍体积生理盐水混匀,高速离心后弃上清,加入3 mL裂白液, 10 mg/mL蛋白酶E 200 μL, 10%SDS溶液400 μL, 混匀后37 ℃过夜。加入1/4体积饱和氯化钠,颠倒混匀,离心20 min。取上清液置于试管中,加入2倍体积无水乙醇,轻摇至DNA析出,使用70%乙醇清洗2~3次,加入TE缓冲液,-20℃保存。
UCP3基因多态性分析: 提取患者外周血基因组DNA进行PCR扩增。PCR反应条件: 95 ℃变性12 min, 60 ℃下退火30 s, 95℃下变性30 s, 45个循环后,于72 ℃延伸10 min。PCR引物见表1。取静脉血加入EDTA抗凝剂分离白细胞,抽取DNA。自PC-1基因第4外显子序列加入缓冲液成分, 4种DNTP、上下游引物(PCR上游引物序列: 5′-ATGTGTTCACTTTGGACATGTTG-3′; 下游引物序列: 5′-GACGTTGGAAGATACCAGGTTG-3′), 94 ℃下5 min, 冰溶冷却后加入DNA多聚酶,液体石蜡封顶,按照标准步骤进行PCR扩增。PCR反应条件为: 94 ℃下45 min, 72 ℃下退火45 s, 63 ℃下45 s, 35个循环后,于72 ℃延伸10 min。PCR反应产物进行1.5%琼脂糖凝胶分析。取鉴定后的扩增产物,加入1.0 (L的限制性内切酶AvaⅡ, 37 ℃下4 h, 以2.5%琼脂糖凝胶检测酶切片段,以标准分子量片段检测酶切产物分子量。测定患者腰臀比(WHR)、血压、血清总胆固醇(TC)、空腹血糖(FBG)、餐后2 h血糖(2 hPG)。

表1 PCR引物及序列
1.3 统计学方法

2 结 果
2.1 UCP3及PC-1基因扩增及酶切产物结果鉴定
UCP3Tyr210Tyr(C-T)多态性基因型检测中DNA提取得到了436 bp的PCR产物,以AvaⅡ内切酶进行酶解反应后,酶切后电泳带型为50、184、202 bp。若427位核苷酸C突变为T,则有1个酶切位点将丢失,含C427T突变的纯合子(TT)仅为2个条带,即50、386 bp; 杂合子CT可见50、184、202、386 bp。PC-1基因第4外显子扩增产物电泳图谱检测结果显示,产物分子量为238 bp。以AvaⅡ内切酶进行酶解反应后,会产生Q、K这2个等位基因,QQ(148、90 bp)、QK(238、148、90 bp, 第1、2泳道)、KK(238 bp,单一条带,第3、4泳道)这3种基因型。见图1、2。
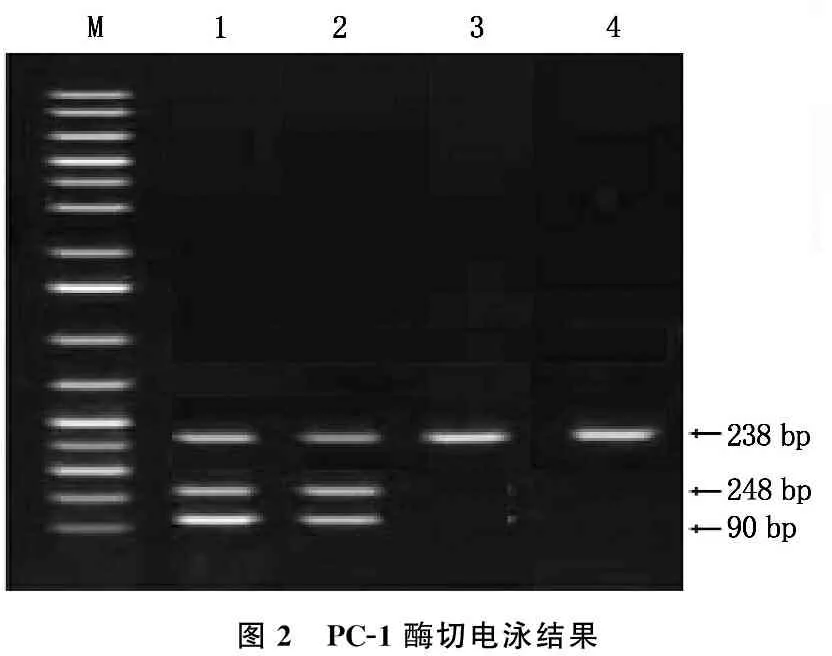
图2 PC-1酶切电泳结果
2.2 UCP3及PC-1不同基因型临床资料分布
UCP3Tyr210Tyr(C-T)多态性基因型检测中,带T的基因型组与CC基因型组临床资料分布比较,差异无统计学意义(P>0.05)。PC-1多态性基因型检测中,带Q的基因型组与KK基因型组BMI、平均收缩压及舒张压、TC、FBG、2 hPG比较,差异有统计学意义(P<0.05)。见表2。
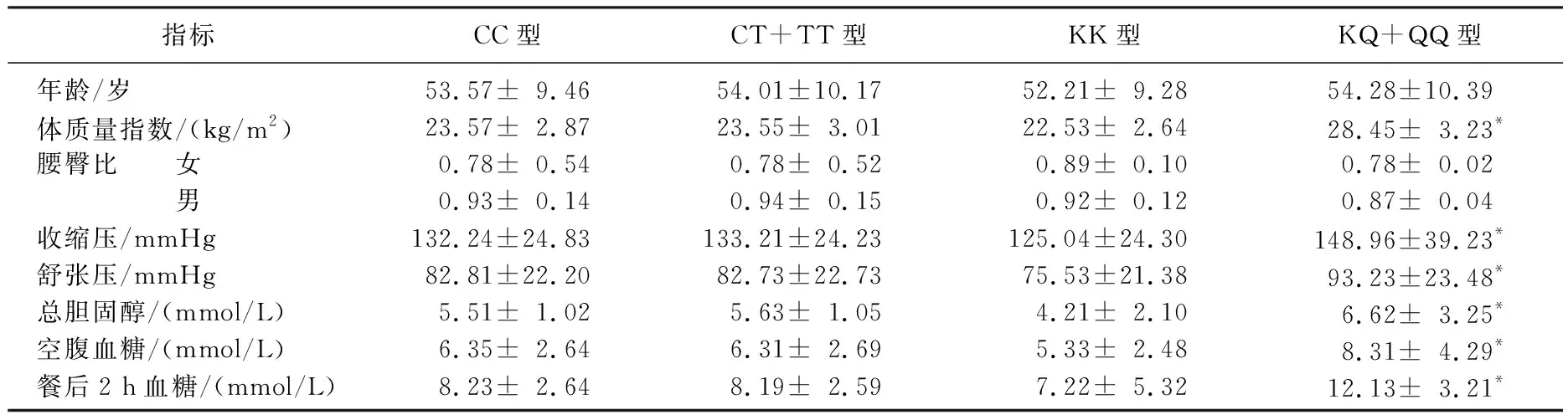
表2 UCP3及PC-1不同基因型临床资料分布
2.3 不同群体UCP3及PC-1等位基因频率分布
T2DM伴肥胖组、T2DM非肥胖组、肥胖组以及非T2DM非肥胖健康组受试者UCP3等位基因中C与T分布频率均较低,肥胖组、非T2DM非肥胖健康组PC-1等位基因中K等位基因频率高于T2DM伴肥胖组、T2DM非肥胖组。见表3。
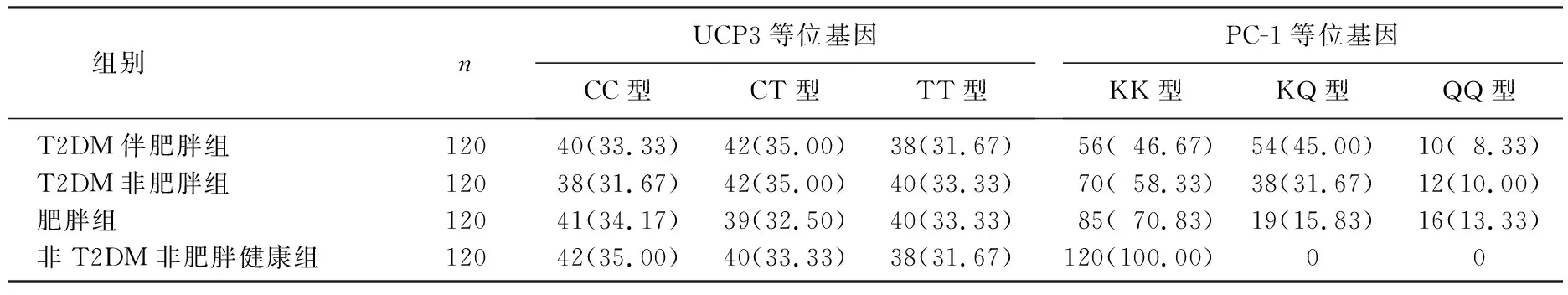
表3 不同组受试者UCP3及PC-1等位基因频率分布[n(%)]
2.4 不同组受试者PC-1基因频率比较
组间比较结果显示,非T2DM非肥胖健康组与肥胖组(x2=6.452,RR=5.290,P=0.016)、T2DM非肥胖组(x2=4.658,RR=4.260,P=0.028)、T2DM伴肥胖组(x2=10.982,RR=9.280,P=0.002)的差异均有统计学意义,其中T2DM伴肥胖群体具有PC-1 Q等位基因而肥胖的相对危险性是非糖尿病非肥胖群体的9.28倍。
3 讨 论
肥胖可导致高血压、高血脂、高尿酸等疾病,同时也是T2DM的危险因素。UCP3及PC-1等遗传因子是近年来肥胖研究的热点领域,其中UCP包括UCP1~UCP5基因,而UCP3基因主要在骨骼肌细胞中表达,对机体产热有重要作用,是肥胖的候选基因,可介导氧化过程及二磷酸腺苷(ADP)磷酸化的解偶联,促进能量以热能形式释放。UCP3基因表达增高可有效降低活性氧产物,或通过降低细胞膜电压等增加活性氧产生[6-9]。
CHA M H等[10]研究发现, UCP3Tyr210Tyr(C-T)多态性基因型检测中,基因型为TT的患者均表现为糖尿病,而血糖正常的患者无此种基因型。此结果提示UCP3基因多态性可能在糖尿病患者发病中有重要作用,可能会改变患者体脂组成,从而影响患者肥胖程度[11]。本研究结果显示,UCP3Tyr210Tyr(C-T)多态性基因型检测中,带T的基因型组与CC基因型组临床资料比较,差异无统计学意义(P>0.05), 可能是不同种族对基因影响程度不同所致,或者是因为本研究选取样本量较少,未排除偏倚性、环境等因素影响。
研究[12-13]证实, PC-1可有效抑制胰岛素受体酪氨酸激酶(IRTK)因子,从而影响胰岛素信号传递,导致机体出现胰岛素抵抗,进而引发糖尿病患者血糖、胰岛素水平升高,因此PC-1对糖尿病患者的胰岛素抵抗有重要作用。T2DM患者在胰岛素信号传导通路上的受体缺陷较正常人更明显[14-15]。本研究结果显示, PC-1多态性基因型检测中,带Q的基因型组与KK基因型组的体质量指数、平均收缩压及舒张压、TC、FBG、2 hPG比较,差异有统计学意义(P<0.05); 肥胖组、非T2DM非肥胖健康组PC-1等位基因中K等位基因频率高于T2DM伴肥胖组、T2DM非肥胖组。上述结果提示Q等位基因不仅与肥胖患者发病有一定关系,还可导致患者出现高血压、高脂血症等并发症[16-17]。
本研究K、Q基因型频率均经遗传平衡定律检验,符合Hardy-Weinberg平衡原则。非T2DM非肥胖健康组与肥胖组(x2=6.452,RR=5.290,P=0.016)、T2DM非肥胖组(x2=4.658,RR=4.260,P=0.028)、T2DM伴肥胖组(x2=10.982,RR=9.280,P=0.002)的差异均有统计学意义,其中T2DM伴肥胖群体具有PC-1 Q等位基因而肥胖的相对危险性是非糖尿病非肥胖群体的9.28倍。上述结果提示Q等位基因可能是患者的易感基因,即Q等位基因对胰岛素受体亲和力更高,对胰岛素受体信号传递抑制作用更强[18-19]。王毅等[20]研究表明, PC-1中Q等位基因对胰岛素敏感性破坏机制更强,患者胰岛素抵抗进展更快,与本研究结果一致。目前,临床上对UCP3、PC-1基因研究较少,本研究将UCP3、PC-1作为T2DM伴肥胖患者的候选基因,进一步研究将扩大样本量,分析基因多态性与病情的相关性,以便于临床更深入地了解疾病发病机制,预测病情严重程度,达到早期防治效果。
综上所述, UCP3基因与T2DM伴肥胖无相关性, PC-1基因中Q等位基因是胰岛素抵抗的易感基因。因此,对T2DM伴肥胖家族史的人群进行早期诊断,指导其改变生活方式,以改善患者预后。

