乙型肝炎表面抗原酶联免疫吸附试验试剂在血液筛查中的临界值设置
李英莲, 陈富强, 王 静, 刘 虹, 颜 鑫, 陈剑锋
(山东省血液中心 检验科, 山东 济南, 250014)
随着酶联免疫吸附试验(ELISA)试剂质量的不断改进和采供血系统核酸检测全覆盖的实现,为适应血站技术的发展需求,国家卫生健康委对《血站技术操作规程(2015 版)》进行修改完善,制定了《血站技术操作规程(2019 版)》(以下简称《规程》)。《规程》对血液检测项目和方法中的检测策略进行了调整,规定人类免疫缺陷病毒(HIV)、乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)感染标志物应至少采用核酸和血清学试剂检测各1次。目前,血站实验室一般根据试剂说明书来设定试验参数,以被测物的吸光度值/临界值(S/CO值)判定结果,若说明书未建议设置灰区,则将S/CO值≥1判为反应性, S/CO值<1判为阴性。为降低弱阳性样本漏检率,有些实验室主动将结果反应性判定值下调,设置不同的灰区,但国家卫生管理部门对试剂的灰区设置并无统一规定,各血站对同一厂家试剂可能设定不一,有些实验室则不设置。由于《规程》确定了对HIV、HBV、HCV这3种病原体实施1遍ELISA检测策略的合法性,本研究对2017年本中心参加的国家卫计委临床检验中心牵头组织的“血液筛查试剂多中心评估项目”所得部分数据进行分析,探讨2种乙型肝炎表面抗原(HBsAg)ELISA 试剂设置灰区的必要性及设定范围,现报告如下。
1 资料与方法
1.1 研究资料
样本总数为3 383份,其中HBsAg阳性样本387份(原国家卫计委临床检验中心提供),阴性样本2 996份(济南地区日常无偿献血者样本)。
1.2 仪器与试剂
STAR自动化样本处理系统(Microlab STAR,瑞士Hamilton公司),全自动酶联免疫分析系统(Microlab FAME2420/2430,瑞士Hamilton公司); 上海一家生物有限公司生产的HBsAg诊断试剂盒(ELISA法,以下称“国产试剂”),意大利Diasorin公司生产的HBsAg诊断试剂盒Murex HBsAg Version 3(ELISA法,以下称“进口试剂”); 中和试验试剂为罗氏试剂(美国)和雅培试剂(美国),化学发光试剂为罗氏(美国)化学发光试剂和安图(中国)生物化学发光试剂。
1.3 检测方法
按照实验室常规操作和卫生部临床检验中心对血清盘的检测要求,使用4种试剂对样本进行平行检测,灰区下限分别设置为临界值(CO值)的0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0倍(即S/CO值分别为0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0),根据不同反应性判定值对检测结果进行判定。
1.4 样本最终结果的确定
4种试剂检测结果均呈反应性(S/CO值≥1.0)的样本,判为阳性,反之则判为阴性; 当4种试剂出现检测结果不一致时,挑出样本进行双孔复检,若有任何1种试剂1孔或2孔呈反应性(S/CO值≥1.0)则判为可疑,送卫生部临床检验中心进行确认,以反馈结果为准。临床检验中心使用雅培/罗氏公司的化学发光法试剂、雅培/罗氏公司的化学发光法中和试验试剂、索林公司的酶联免疫吸附试验(ELISA)试剂和核酸检测(NAT)技术进行补充实验和/或确认实验。
1.5 统计学分析
采用SPSS 22.0统计学软件分析数据,数据比较采用χ2检验,P<0.05为差异有统计学意义。计算不同S/CO值下试剂的约登指数,约登指数=(灵敏度+特异度)-1, 以S/CO值为横坐标、约登指数为纵坐标绘制曲线。
2 结 果
2.1 HBsAg阳性样本检测情况
423份HBsAg阳性样本中, S/CO值为1.0时,国产试剂出现46份假阴性,进口试剂出现28份假阴性,同时使用2种试剂时出现假阴性25份。S/CO值≥0.3时,进口试剂的灵敏度均高于国产试剂,差异有统计学意义(P<0.05)。见表1。

表1 423份HBsAg阳性样本检测结果
2.2 日常阴性样本检测情况
平行检测日常样本2 997份,其中1份样本4种试剂检测均呈反应性(S/CO值≥1.0), 不纳入本次分析范围。21份单试剂反应性样本送卫生部临床检验中心检测,反馈结果均为阴性,故阴性样本合计2 996份。S/CO值为0.2~1.0时, 2种试剂的特异度差异均有统计学意义(P<0.05)。见表2。
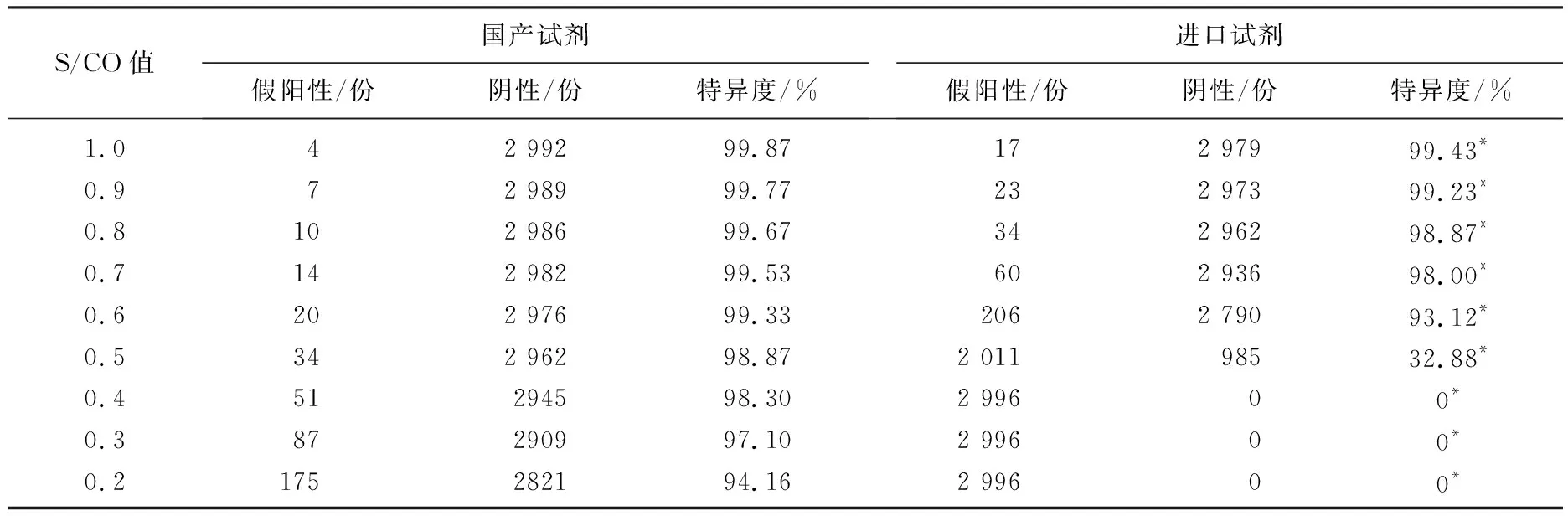
表2 2 996份日常阴性样本检测结果
2.3 约登指数
国产试剂在最大约登指数(0.957)时的S/CO值为0.4, 进口试剂在最大约登指数(0.971)时的S/CO值为0.7, 见表3。

表3 2种试剂在不同S/CO值下的灵敏度、特异度及约登指数比较
3 讨 论
《规程》中制订的有关献血者血液的检测策略,是各血站必须遵守的行业标准,是预防经输血传播相关传染病和确保临床用血安全的重要技术规范。《规程》检测策略中规定, HIV、HBV和HCV感染标志物应至少采用核酸和血清学试剂各进行1次检测。根据该检测策略,血站可对HIV、HBV和HCV这3种病原体实施1遍ELISA检测,目前各血站对于采取何种措施来确保检测结果的准确性持有不同意见,但选择一种灵敏度高的试剂以及设置合适的灰区防止弱阳性样本的漏检是大多数血站的考虑重点。京津冀15家血站的献血者及血液检测策略中, 14家血站实验室在ELISA检测时设定了灰区,范围为0.5~0.9, 其中乙肝第1种试剂使用实验室12家,设置灰区0.5~0.7的有7家,占试剂使用实验室总数的58.3%(7/12)[1]。ELISA灰区是实验室为检出弱阳性样本而自行设定的,能够降低试剂因分析灵敏度较低带来的漏检风险,但灰区的设定也会不可避免地增加一些假阳性结果,浪费掉原本合格的血液样本。
约登指数代表一种试剂检测真阳性与真阴性的总能力,其兼顾灵敏度和特异度,是分析血液筛查试剂检测性能的一种常用指标,指数越大表示真实度越高。虽然血液筛查试剂最重要的指标是灵敏度,但应用时也要考虑特异度,为了避免增加更多的假阳性,临床可以对检测出来的反应性样本补充确证试验,若为阴性则放行。
国家卫健委临床检验中心对2018年第一季度全国26个省(市、自治区)61家血站实验室质量指标进行分析,使用本次评价的国产试剂的血站有18家,其中1家设置灰区下限为0.5倍CO值, 4家设为0.7倍CO值, 5家设为0.8倍CO值, 3家设为0.9倍CO值,另外5家未设置灰区。本研究检测了423份HBsAg阳性样本,国产试剂在约登指数(0.957)最大(灰区下限为0.4倍CO值)时有11份阳性漏检,进口试剂在约登指数(0.971)最大(灰区下限为0.7倍CO值)时有4份漏检,由此可见,若实施1遍HBV ELISA检测,实验室应对选用试剂的灰区范围进行评估。目前血站操作规程和相关文件并未规定试剂的灰区设置标准,大多数实验室按照试剂使用说明书设定或自行设定,如国内有13家血站实验室使用了本次评估的国产试剂,其中1家设定S/CO值为0.7, 1家设为0.8, 6家设为0.9, 另外5家未设置灰区。
洛阳市中心血站在106份灰区(S/CO值为0.6~<1.0)样本中检出12 份阳性,说明ELISA法检测出的“灰区”标本中存在一定数量的阳性标本[2]。张秀慧等[3]对蚌埠市中心血站采集的136份灰区(S/CO值为0.7~<1.0)样本进行确认,发现10份呈阳性,表明了灰区设置的必要性。王庆敏等[4]对国内常用的7种HBsAg ELISA检测试剂盒灰区临界值进行研究,同样认为有必要设置灰区,但要结合本实验室的检测能力先进行实验室验证,然后确定反应性判定值范围,并认为反应性判定值设定为S/CO值≥0.3(国产试剂)、S/CO值≥0.6(进口试剂)为宜。陈洪生等[5]分析了2011—2013年解放军宁波血站发现的25份灰区(S/CO值为0.3~1.0)样本确证结果,发现S/CO值为0.3~0.5的标本,验证试验没有阳性,达到0.7时出现1份阳性。但北京市红十字血液中心检验科的一项研究[6]却认为,灰区不可能解决“窗口期”问题,引入更高级的检测技术才是关键,其试验结果支持取消灰区设置。另外一项研究[7]也表明,血清免疫逃逸变异 HBsAg是导致HBsAg ELISA灰区的重要原因,提升变异 HBsAg检测能力有助于临床诊断。
NAT技术能够有效缩短病毒检测的“窗口期”,进一步提升用血安全性。中国于2010年开始对血液筛查的NAT技术进行评估,《血站技术操作规程(2015年版)》将NAT纳入血液检测方法中,实现全国血站NAT全覆盖, ELISA检测与NAT技术各具优势,互为补充,两者联检可有效降低输血感染风险,且对HBV DNA的检出率极高[8-13], 避免了许多窗口期和隐匿性HBV感染者的血液制品流向临床。
NAT与HBsAg血清学ELISA检测阳性结果也存在不一致情况,深圳市血液中心对236 例乙肝中和试验确证阳性样本进行核酸检测, NAT检出率为71.2%(168/236)[14], 而广州地区HBsAg(+)/NAT(-)献血者在无偿献血者中的比率为0.19%, 在HBsAg双试剂确认阳性献血者中的比率为24.87%[15]。此外,陈显等[16]在28 份HBsAg灰区样本中检出7份阳性,且S/CO值为0.5~<0.6区域3份,对其中4名献血者于献血3个月后追踪随访, 3名确证试验阳性但NAT阴性,说明NAT技术在提升HBsAg灰区样本的检出率方面并无优势,另外各NAT系统的检出率也不相同[17], 故血站也应重视血液筛查试剂的选择和质量控制。本次评估的国产试剂的说明书中未设置灰区,进口试剂则规定S/CO值为0.90, 按照说明书规定值0.90进行判定, 423例阳性样本国产试剂漏检44例,进口试剂漏检18例,所以若实施1遍ELISA检测,进口试剂为首选,但需要对灰区样本进一步确认,以甄别其中的假阳性,为献血者回告和归队提供依据。

