阴道镜下宫颈活检对HSIL和宫颈浸润癌的诊断价值及宫颈浸润癌漏诊的影响因素
石鑫,宋风丽,史伟,郅玲玲,贺笑茜,于帅,马丽丽,高万里
(北京市大兴区人民医院妇产科,北京102600)
宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)是一组与宫颈浸润癌密切相关的癌前病变的统称[1],主要病理为宫颈原位癌和宫颈不典型增生,反映了宫颈组织癌变发展的病理变化:宫颈不典型增生(轻→中→重)→原位癌→早期浸润癌→浸润癌[2]。临床数据表明,宫颈癌是临床常见的女性恶性肿瘤,在女性恶性肿瘤中的患病率仅次于乳腺癌[3]。2021年世界卫生大会再次发布了《加速消除宫颈癌全球战略》[4],我国宫颈癌的患病率及致死率均居女性生殖系统恶性肿瘤首位,且宫颈癌患者呈年轻化趋势[5]。晚期宫颈癌的致死率较高,严重威胁女性的生命健康[6]。因此,及早确诊并采取针对性治疗措施有助于提高宫颈癌的疗效[7]。
目前,阴道镜下宫颈活检是临床诊断高级别鳞状上皮内病变(high-grade squamous intraepithelial lesion,HSIL)及宫颈浸润癌最常用的技术手段,有助于降低宫颈癌致死率[8]。阴道镜下宫颈活检是临床诊断宫颈癌前病变的主要方法,其临床诊断准确性和有效性已得到临床验证。近年临床研究表明,阴道镜下宫颈活检诊断HSIL及宫颈浸润癌存在一定的误诊和漏诊情况,其影响因素较多[9]。本研究通过分析阴道镜下宫颈活检诊断HSIL及宫颈浸润癌的准确性,探讨影响阴道镜下宫颈活检导致宫颈浸润癌漏诊的相关因素,以期为提高宫颈癌的诊断率提供帮助。
1 资料与方法
1.1一般资料 收集2010年1月至2019年12月北京市大兴区人民医院妇科收治的阴道镜下宫颈活检结果为HSIL(CINⅡ级和CINⅢ级)的469例患者的临床资料进行回顾性分析,年龄34~69岁,平均(48±6)岁。所有患者行阴道镜下宫颈活检,其中人乳头瘤病毒(human papilloma virus,HPV)高危阳性患者319例,HPV高危阴性患者150例;液基薄层细胞学检查示,HSIL 221例,低级别鳞状上皮内病变248例。纳入标准:①年龄>18岁;②阴道镜下宫颈活检前均行HPV检测及薄层液基细胞学检查,且宫颈活检提示HSIL;③自愿配合完善临床资料和随访者。排除标准:①合并其他恶性肿瘤者;②临床病历资料不全者。
1.2方法 收集患者的一般资料、病例资料、治疗资料等。经阴道镜下宫颈活检诊断HSIL的患者均行宫颈冷刀锥切术或宫颈环形电切术,以术后病理结果作为金标准,分析阴道镜下宫颈活检诊断HSIL及宫颈浸润癌的准确性。
宫颈环形电切术:使用由环形细金属丝制成的电手术装置——宫颈环形电切刀(北京索吉瑞科技有限公司生产,型号:ES-200PK)切除子宫颈病变组织。不同病变范围使用不同型号的环形电极,自病灶外缘5~6 mm处,1.0~2.5 cm切除范围深度。宫颈冷刀锥切术是用手术刀锥形切除病变宫颈组织。
阴道镜下宫颈活检:避免生殖道感染期及经期采样,采样前48 h避免阴道药物治疗及性生活。在阴道镜(德国徕卡LEICA公司生产,型号:LEICA MZ6)引导下,依据阴道镜操作规范,应用3%~5%醋酸溶液和卢戈碘液评估可疑宫颈病变区,多点取宫颈活组织送病理检查,若阴道镜下宫颈无异常表现,仍随机多点取样。世界卫生组织(2014)女性生殖系统肿瘤分类中将宫颈鳞状上皮内病变分为低级别鳞状上皮内病变和HSIL[10]。
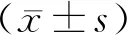
2 结 果
2.1阴道镜下宫颈活检结果与术后病理诊断结果比较 经阴道镜下宫颈活检诊断HSIL的469例患者中,术后病理诊断HSIL者396例,符合率为84.43%。术后病理降级35例,病理升级38例,其中漏诊浸润癌30例,见表1。
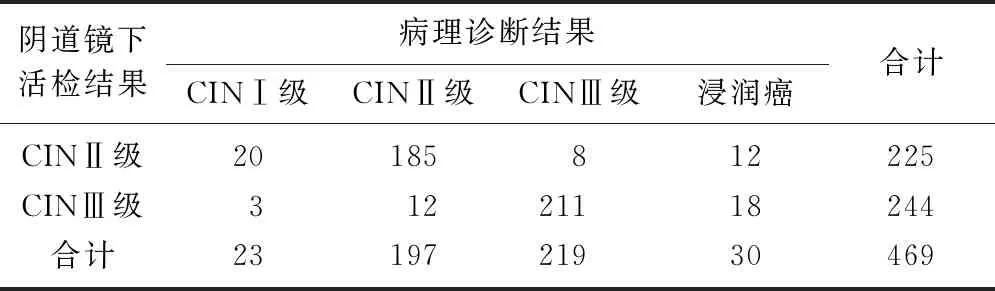
表1 阴道镜下宫颈活检结果与病理诊断结果比较(例)
2.2阴道镜下宫颈活检漏诊宫颈浸润癌的单因素分析 年龄>55岁的漏诊率高于≤55岁者,阴道镜检查不充分的漏诊率高于检查充分者,既往有阴道分娩史患者的漏诊率高于无阴道镜分娩史患者,宫颈病变面积<1/2的漏诊率高于≥1/2者,合并HPV16和(或)HPV18感染的漏诊率高于无感染者,无宫颈管搔刮的漏诊率高于宫颈管搔刮者(P<0.05),见表2。
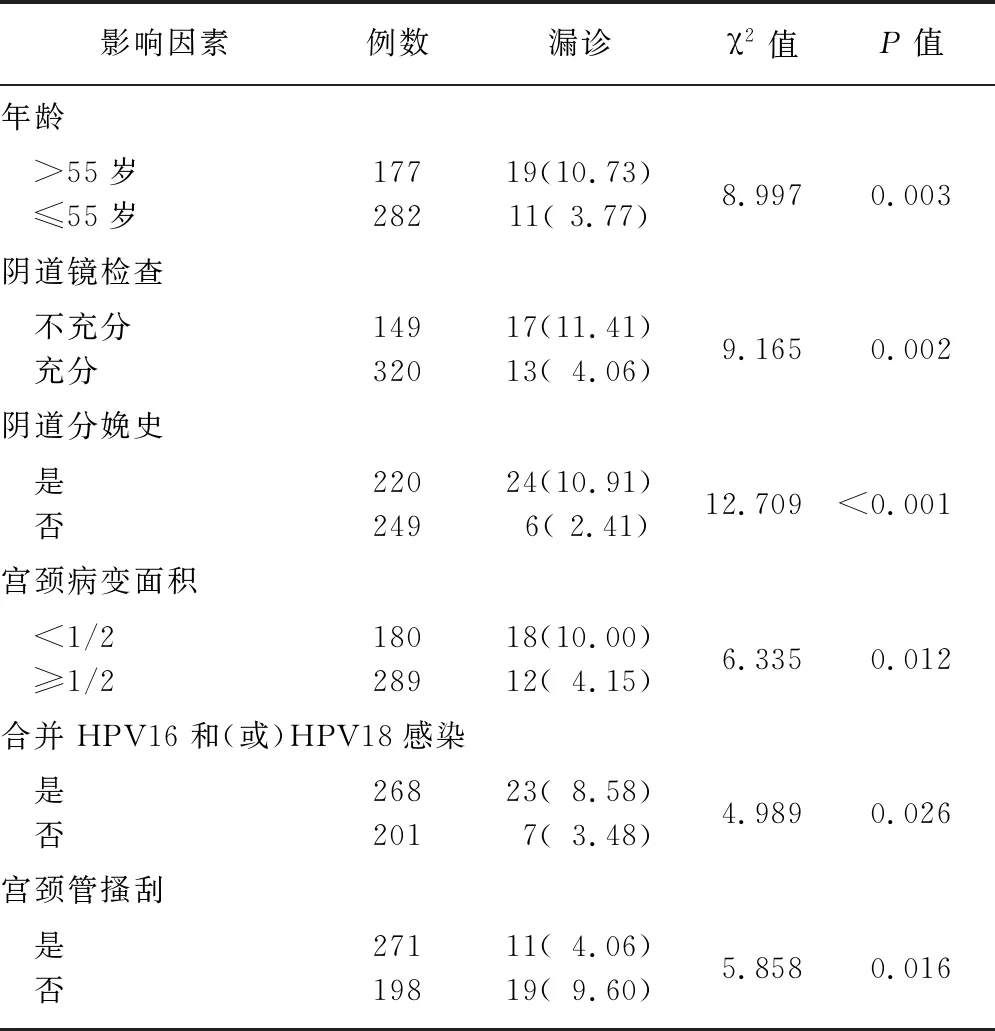
表2 阴道镜下宫颈活检漏诊宫颈浸润癌的单因素分析 [例(%)]
2.3阴道镜下宫颈活检漏诊宫颈浸润癌的多因素回归分析 将年龄(≤55岁=0,>55岁=1)、阴道镜检查充分性(充分=0,不充分=1)、阴道分娩史(否=0,是=1)、宫颈病变面积(≥2=0,<1/2=1)、合并HPV16和(或)HPV18感染(否=0,是=1)、宫颈管搔刮(是=0,否=1)纳入多因素Logistic回归分析,结果显示,年龄>55岁、阴道镜检查不充分、阴道分娩史、宫颈病变组织面积<1/2、合并HPV16和(或)HPV18感染、无宫颈管搔刮是阴道镜下宫颈活检漏诊宫颈浸润癌的影响因素(P<0.05),见表3。
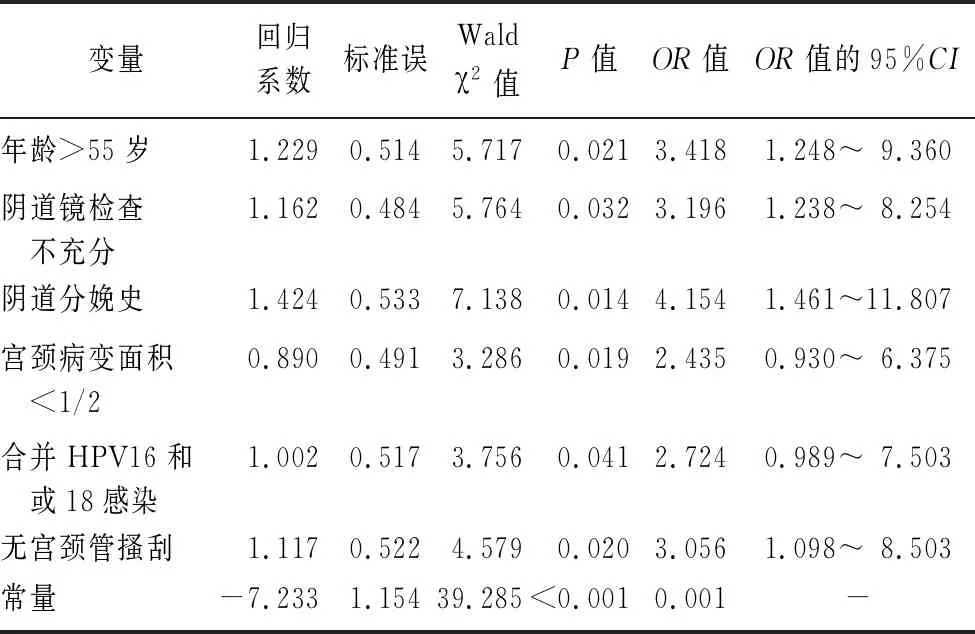
表3 阴道镜下宫颈活检漏诊宫颈浸润癌的Logistic回归多因素分析
3 讨 论
宫颈癌是临床常见的恶性肿瘤之一,目前发病率居女性恶性肿瘤的第4位,随着目前大多数女性体检意识和诊疗技术的提高,其发病率呈逐年上升和年轻化趋势[11]。宫颈癌早期筛查目前作为宫颈癌早诊断的重要临床手段,对宫颈癌的早期诊断、早期治疗及改善患者预后具有十分重要的意义。宫颈癌在初期无典型特征表现,病变较隐匿,约50%的宫颈癌患者无明显不适或典型症状,多于正常体检时发现[12]。因肉眼难以识别早期宫颈癌及CINⅢ级等早期原位癌及浸润癌,直接活检具有一定的盲目性和偶然性。阴道镜下宫颈活检是目前临床诊断宫颈病变的有效手段,诊断HSIL的准确率较高[13]。临床仅凭肉眼鉴别HSIL和浸润癌较困难,而直接活检的偶然性及盲目性较强,因此阴道镜下宫颈活检成为临床宫颈疾病筛查和诊断的重要手段,广泛用于宫颈癌等相关疾病的诊断[14]。阴道镜下宫颈活检可在直视下操作,有助于直接了解宫颈病变组织的解剖生理学特征,在宫颈病变诊断中起重要作用[15]。但采用阴道镜下宫颈活检诊断宫颈浸润癌存在一定的漏诊率[16]。本研究中,阴道镜下宫颈活检诊断HSIL的符合率为84.43%,术后病理降级35例,病理升级38例,漏诊宫颈癌30例。阴道镜下宫颈活检诊断HSIL的结果与术后病理诊断结果较一致,但有部分宫颈癌患者漏诊。因此,对HSIL高患病风险且可能存在隐匿性宫颈癌的患者,可直接行宫颈环形电切术,以提高早期宫颈癌的检出率,降低漏诊率。此外需要注意,术后病理诊断CINⅠ级患者多为降级患者[17]。
本研究结果显示,年龄>55岁、阴道镜检查不充分、阴道分娩史、宫颈病变面积<1/2、合并HPV16和(或)HPV18感染及未进行宫颈管搔刮是宫颈癌漏诊的影响因素(P<0.05)。国内研究显示,30岁以下、30~39岁、40~50人群宫颈活检诊断HSIL和宫颈浸润癌的检出率分别为7.7%、11.5%、22.0%,表明随着年龄增加宫颈浸润癌的检出率呈明显增加趋势[7]。其原因可能为老年患者的宫颈转化区位于宫颈管内,阴道镜检查较难发现宫颈管内病变,易漏诊宫颈癌[18],且老年患者阴道环境干涩萎缩,待检部位常无法充分暴露,阴道镜检查难度增加。阴道镜检查充分指宫颈鳞柱交界区完全暴露,阴道镜下图像清晰,可充分观察宫颈组织情况[19]。大部分绝经患者阴道镜下宫颈鳞柱交界区不能完全暴露,难以发现可疑病变,易漏诊宫颈癌,尤其是早期微小浸润癌。此外,子宫肌瘤、阴道壁松弛膨出等均影响阴道镜检查,常导致宫颈鳞柱交界区暴露不充分,影响病变判断[20]。另外,阴道镜操作者的经验、操作技巧和熟练程度、仪器设备的清晰度均与阴道镜检查满意度密切相关。阴道镜下宫颈活检时,有阴道分娩史患者的宫颈鳞柱交界区的判断较困难[21]。宫颈癌病变具有多灶性的特点,宫颈病变面积、宫颈活检取样标本的数量及其典型性均与宫颈癌的漏诊有关,早期病变范围较小,宫颈活检往往取材较浅、取样数量偏少均增加了阴道镜下宫颈活检的漏诊率[22]。持续高危型HPV感染导致的细胞恶变是宫颈癌发生的重要因素之一,HPV16和HPV18与70%的宫颈癌有关[23]。大量的流行病学和分子生物学研究证实,HPV感染与宫颈癌及宫颈癌前病变密切相关[24-26]。因此,临床应加强阴道镜操作的培训,并高度重视HPV16、HPV18感染患者,对阴道镜检查不充分及疑似病例进行充分检查、多点活检、宫颈管搔刮,以提高取样组织的代表性,降低漏诊率。
综上所述,阴道镜下宫颈活检是目前早期发现、诊断HSIL及宫颈癌的一种简单有效的方法,但由于阴道镜下多点活检取样具有明显局限性,易发生宫颈癌漏诊。对于HSIL患者,应综合分析是否存在年龄>55岁、阴道镜检查不充分、阴道分娩史、宫颈病变面积<1/2及合并HPV16和(或)HPV18感染等因素,进行充分检查,宫颈管搔刮进而降低阴道镜下宫颈活检宫颈浸润癌的漏诊率,提高临床的诊断效能。

