微RNA在食管癌研究中的新进展
刘燕群,邱世香,刘康,宋桂芹
(1.川北医学院a.基础医学院,b.医学影像学院,c.第二临床医学院,四川 南充 637000;2.南充市中心医院组织工程与干细胞研究所,四川 南充 637000)
食管癌是消化道最具侵袭性的肿瘤之一,2018年全球新发食管癌约57.2万例,因食管癌死亡病例50.8万,食管癌患病率居所有恶性肿瘤第7位,病死率居第6位,且存在显著的地区差异,中国的食管癌发病率居第5位[1-2]。食管癌的病理类型分为腺癌和鳞状细胞癌,其中食管鳞状细胞癌最常见。目前,食管癌的治疗主要以手术切除为主,辅以多学科联合治疗,如放疗、化疗。随着基因检测技术的发展,分子靶向治疗成为食管癌的二线治疗方案[3]。然而,由于食管癌的早期诊断较困难,确诊时多为中晚期,治疗效果欠佳,食管癌患者的5年生存率仅为20%~30%[4],其中肿瘤复发和转移是影响患者生存的主要因素。因此,了解食管癌发生的分子机制以及寻找新的分子标志物,对于食管癌的预防和治疗具有重要意义。
Guo等[5]首次发现,微RNA(microRNA,miRNA)在食管癌组织中存在差异表达谱。随后多项研究证实,miRNA在食管癌中存在差异表达,并参与食管癌靶基因转录后水平的调控,通过负性调控靶基因降解其转录产物或抑制其翻译,进而影响食管癌的增殖、迁移、侵袭及凋亡等生物功能,表明miRNA在食管癌早期临床诊断、预后判断以及基因治疗方面具有较大的研究价值和发展前景。现对miRNA参与食管癌的形成、进展及其作为潜在生物标志物或治疗靶标的应用予以综述,以阐明miRNA对食管癌的发生发展以及对食管癌患者临床诊治的影响。
1 miRNA概述
miRNA是长度介于17~25个核苷酸长的单链非编码RNA,在细胞核中miRNA编码基因在RNA聚合酶Ⅱ的作用下转录产生具有发夹结构的初级转录本,初级转录本进一步被Drosha和双链RNA结合蛋白DGCR-8加工成约为70个核苷酸的茎环前体分子(前体miRNA),这些前体分子通过核转运受体5和核蛋白Ran-GTP转运到细胞质,再经RNA内切酶Dicer酶切生成成熟miRNA,调控基因表达导致信使RNA(messenger RNA,mRNA)降解或翻译抑制[6],见图1。
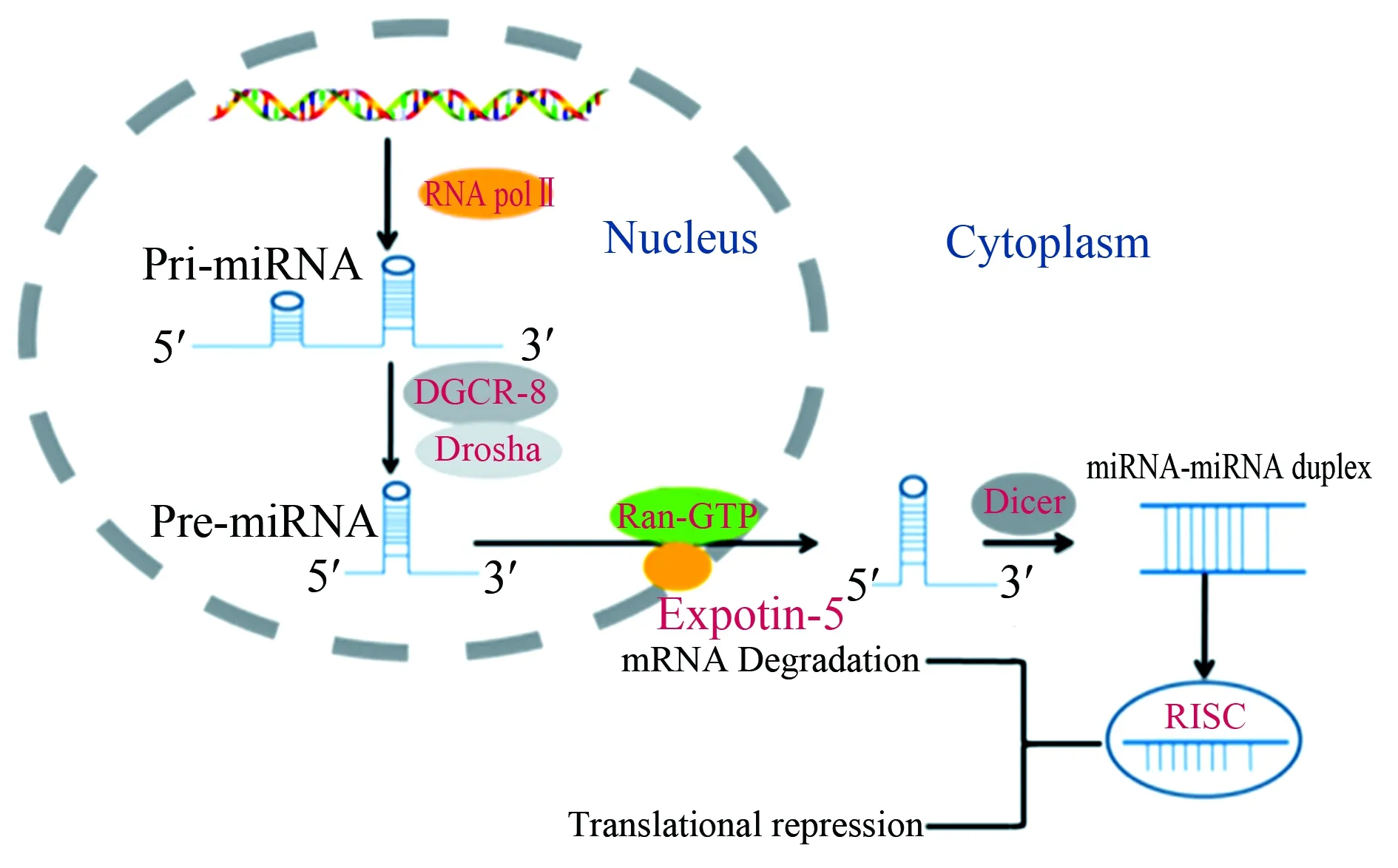
Nucleus:细胞核;Cytoplasm:细胞质;Pri-miRNA:初级转录本;Pre-miRNA:前体微RNA;RNA pol Ⅱ:RNA聚合酶Ⅱ;Ran-GTP:核蛋白;Exportin-5:核转运受体5;Dicer:RNA内切酶;miRNA-miRNA duplex:微RNA复合物;RISC:RNA诱导沉默复合体;mRNA Degradation:信使RNA降解;Translational repression:翻译抑制;miRNA:微RNA
miRNA可以通过碱基配对的方式调控目标mRNA的转录后修饰、翻译等过程。在植物中,成熟miRNA与目标mRNA的3′非翻译区的全部碱基配对,而哺乳动物中,成熟miRNA仅与目标mRNA的3′非翻译区的部分碱基配对[7],导致目标蛋白的表达减少或加速降解。miRNA在恶性肿瘤中的异常表达有多种机制,主要包括扩增、缺失和突变、表观遗传沉默,并可根据作用靶点的不同,发挥致癌或抑癌作用。多项研究表明,上调的miRNA一般作为癌基因,通过负性调控作用对一个或多个抑癌基因产生抑制作用,起到促进肿瘤进展的作用;而下调的miRNA一般作为抑癌基因,通过负性调控相应癌基因抑制癌基因的表达,从而减缓肿瘤的发展进程[8-33]。
2 miRNA参与食管癌的发生与发展
2.1食管癌中异常表达的miRNA 近年来,随着基因测序和分子生物学技术的快速发展,对miRNA在食管癌中作用研究的不断深入,越来越多的miRNA在食管癌组织和细胞中的表达异常被发现。多项研究发现,在食管癌中miRNA的异常表达主要以下调为主,miRNA通过降解靶基因或抑制其表达等负性调控手段干扰食管癌的增殖、凋亡、迁移和侵袭等生物学行为[6,8-33]。此外,食管癌中也有表达上调的miRNA,且通常对相应靶基因也起负性调控作用,通常作为癌基因,促进食管癌细胞的增殖、迁移和侵袭,抑制其凋亡。这些表达异常的miRNA对食管癌的作用多样,通过不同靶点、不同信号通路影响食管癌细胞的增殖、周期、凋亡、侵袭、迁移以及临床诊断和治疗等。食管癌中异常表达的miRNA、分子靶标及其生物学功能,见表1。
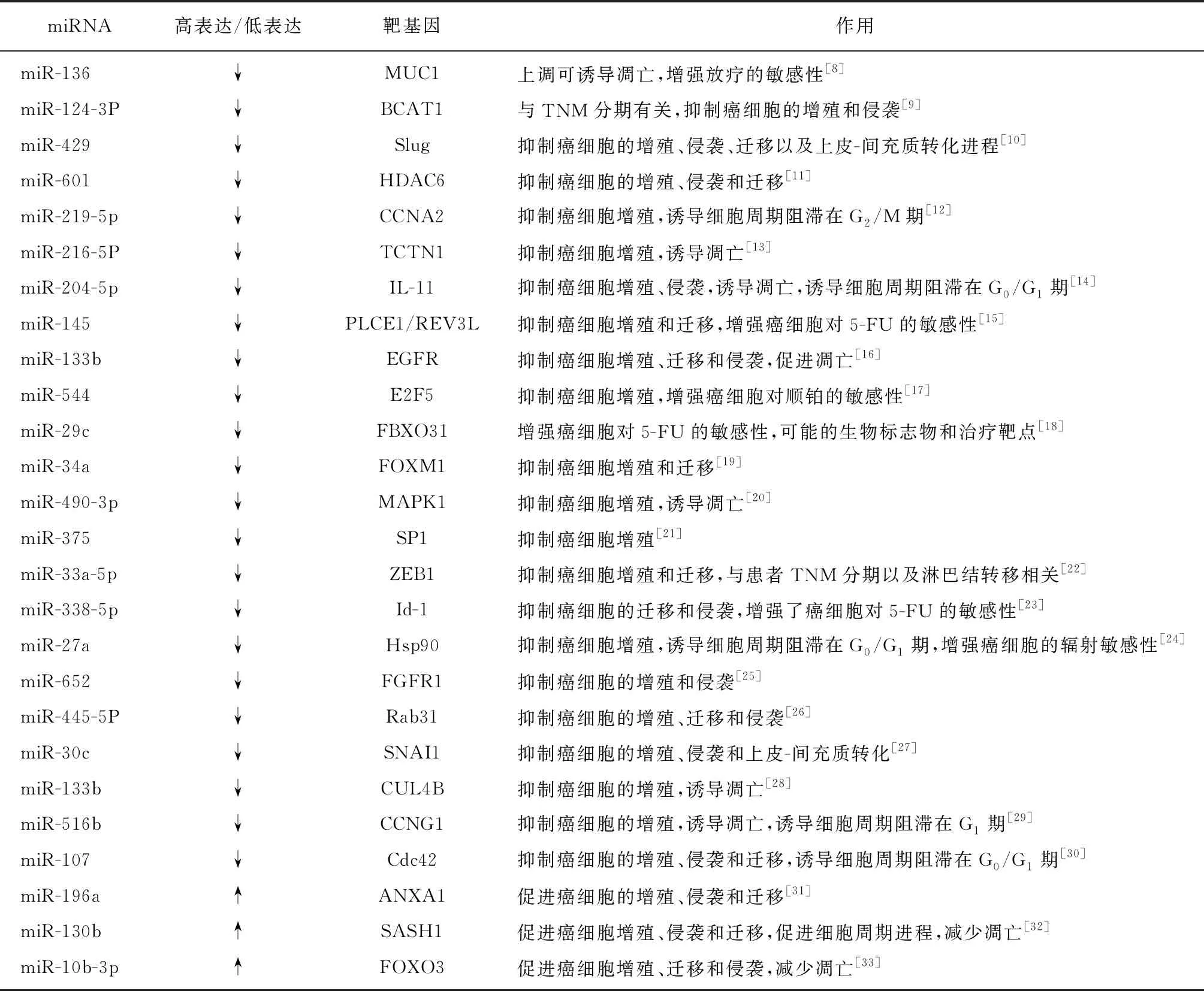
表1 食管癌中miRNA的异常表达情况
2.2miRNA的表达影响食管癌细胞的增殖和周期 细胞周期是一个复杂的过程,需要细胞周期蛋白的协调表达,从而导致细胞周期蛋白依赖激酶及其调节因子的顺序激活[34]。miRNA参与了食管癌细胞中编码细胞周期蛋白的mRNA的调控,并可影响细胞周期进展。Ma[12]研究发现,肿瘤组织和细胞中的miR-219-5P表达量明显低于正常组织和细胞,且肿瘤组织和细胞中的miR-219-5P通过反向调控细胞周期素A2,诱导细胞周期阻滞在G2/M期,抑制细胞增殖。另有研究发现,miR-204-5p、miR-27a、miR-107在食管癌组织和细胞中低表达,分别靶向白细胞介素-11、热激蛋白90、细胞分裂周期蛋白42,诱导食管癌周期阻滞在G1期,抑制食管癌细胞增殖[16,29,35-36]。miR-130b、miR-21、miR-10b在食管癌组织和细胞中高表达,通过反向调控靶基因的表达起到促癌作用,促进食管癌细胞的增殖[32,37-38]。可见,随着miRNA研究的深入,更多影响食管癌增殖和周期的miRNA将会被鉴定出,从而为食管癌的靶向治疗和早期诊断提供坚实的研究基础。
2.3miRNA的表达影响食管癌细胞的凋亡 细胞凋亡的发生是一系列基因激活、表达及调控等的作用,常见的介导细胞凋亡的通路有线粒体通路、内质网通路以及死亡受体通路,而参与其中的Bcl-2蛋白家族和胱天蛋白酶蛋白家族是调控细胞凋亡的重要因素,可激活细胞凋亡程序或释放促凋亡因子,使细胞发生凋亡[39]。在食管癌中异常表达的miRNA,一方面可通过影响Bcl-2家族成员的表达促进或抑制食管癌细胞的凋亡进程,另一方面可通过增强辐射诱导的细胞凋亡。Zheng等[40]发现,miR-145在食管癌组织和细胞中下调,调控靶基因丝氨酸/苏氨酸蛋白激酶3表达上调,在食管癌细胞中,过表达miR-145或敲低丝氨酸/苏氨酸蛋白激酶3,细胞抗凋亡蛋白Bcl-2水平均降低,促凋亡Bcl-2相关X蛋白水平升高,促进食管癌细胞凋亡,且食管癌中过表达的miR-145使DNA定向聚合酶ζ催化亚基的表达以及蛋白水平明显降低,进而导致Bcl-2表达水平降低,Bcl-2相关X蛋白和活化的胱天蛋白酶3表达水平升高,诱导食管癌细胞凋亡增加[15]。同样,在食管癌细胞中,结构蛋白家族成员1表达上调,促进了食管癌细胞的增殖,进而抑制细胞凋亡,过表达的miR-216a-5p抑制了结构蛋白家族成员1的表达,导致抗凋亡蛋白Bcl-2水平降低,促凋亡蛋白Bcl-2相关死亡启动子水平升高,促进了食管癌细胞的凋亡[13]。此外,miR-136、miR-27a在食管癌细胞中低表达,靶基因黏蛋白1和热激蛋白90在食管癌细胞中表达上调,过表达的miRNA可负性调控靶基因,增强食管癌细胞的放射敏感性,促进食管癌细胞凋亡[8,24]。miR-519在食管癌细胞中低表达,而过表达的miR-519使线粒体凋亡通路磷脂酰肌醇-3-激酶/蛋白激酶B/哺乳动物雷帕霉素靶蛋白信号途径失活,使磷酸化的蛋白激酶B和哺乳动物雷帕霉素靶蛋白表达减少[41]。各种miRNA对食管癌细胞凋亡作用的影响机制各不相同,但目前已知的对食管癌细胞凋亡有影响的miRNA十分有限,还需要更多研究进一步阐明miRNA对食管癌细胞凋亡作用的调控机制。
2.4miRNA的表达影响食管癌细胞的侵袭和迁移 食管癌是一种侵袭能力很强的肿瘤,其侵袭和迁移的能力与食管癌发生转移的可能性相关。研究发现,食管癌组织中miRNA的特异性表达与食管癌的侵袭迁移密切相关,可在不同程度上调控食管癌细胞的侵袭迁移能力[42]。一方面,原发性肿瘤细胞发生上皮-间充质转化(epithelial-mesenchymal transition,EMT),获得侵袭和转移的特性,其特征主要为增强细胞间黏附上皮钙黏素减少,间充质细胞的分子标记波形蛋白和神经钙黏素增加,导致细胞间黏附减少或丢失,促进肿瘤细胞向周围组织和器官的侵袭和远处转移[43]。Zeng等[16]研究发现,表皮生长因子(epidermal growth factor receptor,EGFR)作为多种转移性肿瘤的治疗靶点在食管癌组织和细胞中高表达,miR-133b在食管癌组织和细胞中低表达,过表达的miR-133b可直接靶向抑制EGFR的表达,进而使上皮相关蛋白CK-18和上皮钙黏素的表达增加、间叶相关蛋白(波形蛋白和神经钙黏素)的表达减少,抑制食管癌细胞EMT过程和食管癌细胞的侵袭和迁移。有报道称,蜗牛家族转录抑制因子2通过结合其基因启动子上的E框抑制上皮钙黏素基因的转录和表达,激活肿瘤的EMT过程[43]。在食管癌组织和细胞中,蜗牛家族转录抑制因子2表达上调,miR-429低表达,而过表达的miR-429可抑制靶基因蜗牛家族转录抑制因子2的表达,引起上皮相关蛋白上皮钙黏素、β联蛋白增加,间叶相关蛋白神经钙黏素、Snail减少,抑制食管癌的EMT过程和迁移[10]。同样,在食管癌细胞中,过表达的miR-196、miR-4234也可负向调控靶基因的表达,增加上皮相关蛋白表达,减少间叶相关蛋白表达,抑制食管癌的EMT进展和迁移[31,44]。另外,Xie等[45]研究发现,在食管癌细胞中miR-1275通过靶向Wnt家族成员1,使Wnt/β联蛋白信号通路失活,抑制食管癌细胞的EMT过程和迁移。另一方面,基质金属蛋白酶家族的蛋白水解酶对细胞外基质的重塑至关重要,其降解是恶性肿瘤侵袭和转移的先决条件。Zhou等[19]研究发现,miR-34a在食管癌中低表达,而miR-34a过表达可反向抑制靶基因叉头框蛋白M1的表达,降低基质金属蛋白酶2和基质金属蛋白酶9的表达水平,抑制食管癌细胞的迁移和侵袭。可见,多种miRNA参与了食管癌细胞的EMT过程和侵袭迁移的调控,对miRNA的研究有助于了解食管癌的发展机制,并为临床食管癌的复发和转移的相关研究提供新方向。
3 miRNA在食管癌临床诊疗中的潜在价值
3.1miRNA在食管癌辅助诊断中的潜在作用 早期诊断食管癌可有效提高患者的生存率,但食管癌缺乏典型的临床表现,而目前食管癌诊断的“金标准”——食管镜下活组织病理检查具有一定的侵入性,患者确诊时大多为中晚期,严重影响了患者的临床治疗和生活质量。近年来,随着miRNA的研究不断深入,发现部分miRNA可作为诊断食管癌的特异性血清学检测指标。Li等[18]比较114例食管癌患者和50名健康者的血清miR-29C水平发现,食管癌患者miR-29C的表达水平明显低于健康人群,与miR-29C低表达者相比,miR-29C高表达者的生存时间更长。此外,与健康人群相比,食管癌患者血清miR-338-5p、miR-27a的表达水平明显降低,且miR-338-5p的表达水平与较差的生存率以及5-氟尿嘧啶/顺铂新辅助化疗的不良反应相关[23-24]。由此可见,miRNA有望成为辅助食管癌诊断的实验室指标。
3.2miRNA在食管癌辅助治疗中的作用 目前,食管癌的主要临床治疗方式仍为手术治疗,同时化疗和放疗也是临床治疗食管癌的重要方式,临床的化疗药物主要有5-氟尿嘧啶和顺铂等,但耐药性限制了这些药物的临床应用。近年来,随着对食管癌治疗的耐药机制研究,发现miRNA的异常表达与临床化疗耐药相关[46]。研究发现,miR-145、miR-29C、miR-338-5p在食管癌组织和细胞中低表达,可分别反向调控相应靶mRNA表达,而过表达miRNA将增强5-氟尿嘧啶对食管癌治疗的敏感性,提高患者的总体生存率,抑制食管癌细胞的增殖、迁移和侵袭,促进凋亡[15,18,23]。Sun等[17]发现,miR-544在食管癌组织和细胞中低表达,E2F转录因子5作为其靶点在食管癌组织和细胞中高表达。miR-544可反向调控靶基因E2F转录因子5,抑制其表达,增强食管癌细胞对顺铂的敏感性,抑制食管癌细胞的增殖,有望成为食管癌治疗的潜在靶点。同样,Zheng等[40]研究发现,miR-145通过直接抑制磷脂酰肌醇-3-激酶/蛋白激酶B信号通路,诱导食管癌细胞凋亡,从而增强顺铂对食管癌治疗的敏感性。
放疗也是临床常用治疗方式之一,但肿瘤常存在内在抗辐射性,miRNA可参与调控靶基因,以增强其抗肿瘤辐射的敏感性。Wang等[24]发现,miR-27a在食管癌组织中低表达,过表达miR-27a将抑制热激蛋白90表达,抑制食管癌细胞增殖,辐射诱导细胞凋亡增加,增强辐射治疗食管癌细胞的敏感性。同样,Zhang等[41]研究发现,miR-519在食管癌细胞中低表达,并与患者总体预后生存不良相关,过表达miR-519导致磷脂酰肌醇-3-激酶/蛋白激酶B/哺乳动物雷帕霉素靶蛋白信号通路失活,增强食管癌细胞对放疗的敏感性。可见,多种miRNA可增强抗肿瘤药物的敏感性以及放疗的敏感性,有望辅助肿瘤的临床治疗,提高患者的生存和生活质量。
3.3miRNA在食管癌预后判断中的作用 在食管癌的治疗过程中,预测食管癌患者的生存时间、疾病进展速度以及治疗效果对判断患者预后十分重要。miRNA在组织和循环系统中的表达水平稳定可靠,有望成为食管癌患者的有效预后因子。miR-33a-5p、miR-124-3p作为抑癌基因,在食管癌组织和细胞中低表达,其低表达与患者总体预后不良相关,并且与晚期TNM分期以及淋巴结转移相关[9,22]。Zabihula等[20]研究显示,miR-490-3p的表达值与食管癌患者的肿瘤分期和肿瘤大小相关,Ⅲ期和Ⅳ期患者的miR-490-3p表达值明显低于Ⅰ期和Ⅱ期患者,肿瘤直径>3 cm患者的miR-490-3p表达量明显低于肿瘤直径<3 cm患者。miR-21亦为致癌基因,Li等[37]发现,食管癌组织中miR-21的表达明显增加,其表达与临床晚期呈正相关。另有多项研究显示,miR-30c、miR-516、miR-375、miR-519等也与患者预后总体生存率相关[27,29,36,41]。因此,miRNA有助于确定食管癌患者预后,有望成为判断食管癌患者预后的生物标志物。
4 展 望
在食管癌的众多研究中,对miRNA表达模式改变的研究可为食管癌的发病机制提供实质性帮助,通过研究miRNA下游相关靶点,可进一步明确参与食管癌发生发展的机制。功能实验表明,miRNA与癌基因或抑癌基因mRNA相互作用,控制癌细胞周期、凋亡以及癌细胞的侵袭和迁移能力。食管癌中miRNA的异常表达可通过调控细胞周期蛋白、凋亡相关蛋白Bcl-2、Bcl-2相关X蛋白等影响食管癌细胞的增殖和凋亡,同时miRNA也可调控细胞钙黏蛋白表达影响细胞侵袭和迁移,许多miRNA可参与增强食管癌细胞对临床放疗和化疗药物的敏感性,降低耐药性,有望成为辅助临床诊断食管癌的潜在生物标志物和治疗分子靶标,具有重要的临床价值和应用前景。
miRNA作为一种新的基因治疗方式,具有较好的治疗前景,但仍存在一些临床问题有待进一步研究证明,如单个miRNA调控多个靶基因,一个靶基因被多个miRNA共同调控。因此,其临床治疗的特异性仍需进一步研究,如开发收集分析患者样品的合理方案用于食管癌的临床诊断;合理过表达或敲低相关miRNA以增强食管癌患者对放疗和化疗药物的敏感性等用于食管癌的临床治疗。因此,食管癌中miRNA作用的分子机制及临床应用仍需进一步研究,以为临床诊断和治疗提供新思路。

