GREB1在女性生殖系统雌激素相关性疾病中的研究进展
许佳文,严艺云,程萌
(1.四川大学华西第二医院妇产科,成都 610041; 2.四川大学华西临床医学院,成都 610041;3.出生缺陷与相关妇儿疾病教育部重点实验室(四川大学),成都 610041)
女性生殖系统包括外阴、阴道、子宫、卵巢、输卵管等,受下丘脑-垂体-卵巢轴的调控。女性生殖系统随女性年龄的增长,逐步经历发育、成熟和衰退的过程,在这一过程中雌激素发挥重要作用。雌激素是主要由卵巢合成和分泌的类固醇激素。生理水平的雌激素对于维持女性生殖生理功能十分重要,而雌激素水平异常会导致许多生殖系统疾病。由雌激素导致的疾病称之为雌激素相关性疾病。雌激素通过与其受体结合发挥作用。雌激素受体(estrogen receptor,ER)在多种组织表达,以乳腺和女性生殖系统表达水平最高,故雌激素相关性疾病也最常见于乳腺和女性生殖系统,如乳腺癌、子宫内膜异位症、子宫内膜癌、卵巢癌等。
乳腺癌雌激素调控因子1 (growth regulation by estrogen in breast cancer 1,GREB1)与乳腺的关系已有较多文献报道。在乳腺癌患者中,GREB1的表达与雌激素以及ER水平相关[1],且GREB1水平会随着女性月经周期的改变而变化[2]。GREB1可促进乳腺癌细胞中ER靶基因的转录[3],其表达水平与乳腺癌的复发和耐药密切相关[4]。随着对GREB1认识的深入,GREB1与雌激素的关系在女性生殖系统疾病中也得到证实。现就GREB1在女性生殖系统雌激素相关性疾病中的作用予以综述。
1 GREB1的结构和功能
GREB1首先在脑组织中发现[5],后来在乳腺癌中被鉴定为早期雌激素反应性基因[6]。GREB1基因序列跨物种高度保守,在许多器官组织中均有表达,包括脑[7]、乳腺[8]、卵巢[9]、前列腺[10]和子宫内膜[11],提示GREB1可能参与了这些组织的调控。GREB1基因位于人类染色体2p25.1,长度为108.68 kb,包含38个外显子和40个内含子[6]。GREB1基因转录为信使RNA至少有3种亚型:GREB1a、GREB1b和GREB1c[6](图1)。其中,GREB1a编码含1 949个氨基酸的蛋白GREB1a。GREB1b和GREB1c分别包含2 347和2 334个碱基,在信使RNA翻译过程中,GREB1b和GREB1c分别在外显子10和9之后终止翻译,形成分别含457和409个氨基酸的蛋白GREB1b和GREB1c[12](图1)。目前,这3种GREB1亚型的大部分结构和功能仍然未知,对GREB1功能的大部分认知来源于对部分蛋白结构域的分析。GREB1蛋白的C端含有一个由TET/JBP(ten-eleven translocation/J binding protein)、糖基转移酶以及循环排列的超家族Ⅱ解旋酶融合形成的结构域[13](图1)。其中,超家族Ⅱ解旋酶主要与核酸结合,无催化作用[13]。而TET/JBP和糖基转移酶形成的结构域可以对5-羟甲基胞嘧啶进行糖基化修饰[13]。糖基化是在包括乳腺癌、卵巢癌和内膜癌在内的不同类型癌症中观察到的一种关键修饰,其促进了乳腺癌细胞的黏附、增殖和转移[14]。糖类抗原125是典型的糖基化蛋白,其位于染色体19p13.2,是一种含有5 797个碱基对的跨膜糖蛋白,糖类抗原125在正常卵巢组织中不存在,但在80%以上的卵巢癌患者中高表达,其能促进肿瘤细胞的生长、增殖、凋亡和自我吞噬[15];此外,糖基化还可导致氧化应激、脂质过氧化损伤、炎症反应等,诱发内膜细胞癌变[16]。然而,GREB1介导的DNA糖基化修饰是否也在上述激素相关性肿瘤中发挥作用仍有待进一步研究。
在GREB1的N端包含两个LXXLL结构,其中L代表亮氨酸,X代表任何一种氨基酸(图1),该结构通常存在于辅助活化因子中,并参与调节激素同型二聚体与核受体的相互作用[3](图1)。雌激素通过与其受体结合发挥作用。ER包括经典核受体和膜受体。目前研究较清楚的为经典核受体,其又分为ERα和ERβ两种亚型。经典的雌激素信号通路始于雌激素与其受体的结合并形成同型二聚体[17],紧接着同型二聚体的结构发生改变,暴露雌激素反应元件结合位点[18]。该雌激素同型二聚体在辅活化因子——核受体共激活因子(nuclear receptor coactivator,NCOA)的作用下与雌激素反应元件结合,然后发挥调节目标基因转录的作用[19](图1)。在GREB1基因上游目前已知有3个雌激素反应元件,分别位于-21.2、-9.5和-1.6 kb[18]。从GREB1的结构进行分析,无论是GREB1基因上游的雌激素反应元件,还是GREB1蛋白的LXXLL结构,均提示GREB1在雌激素调控通路中发挥重要作用。
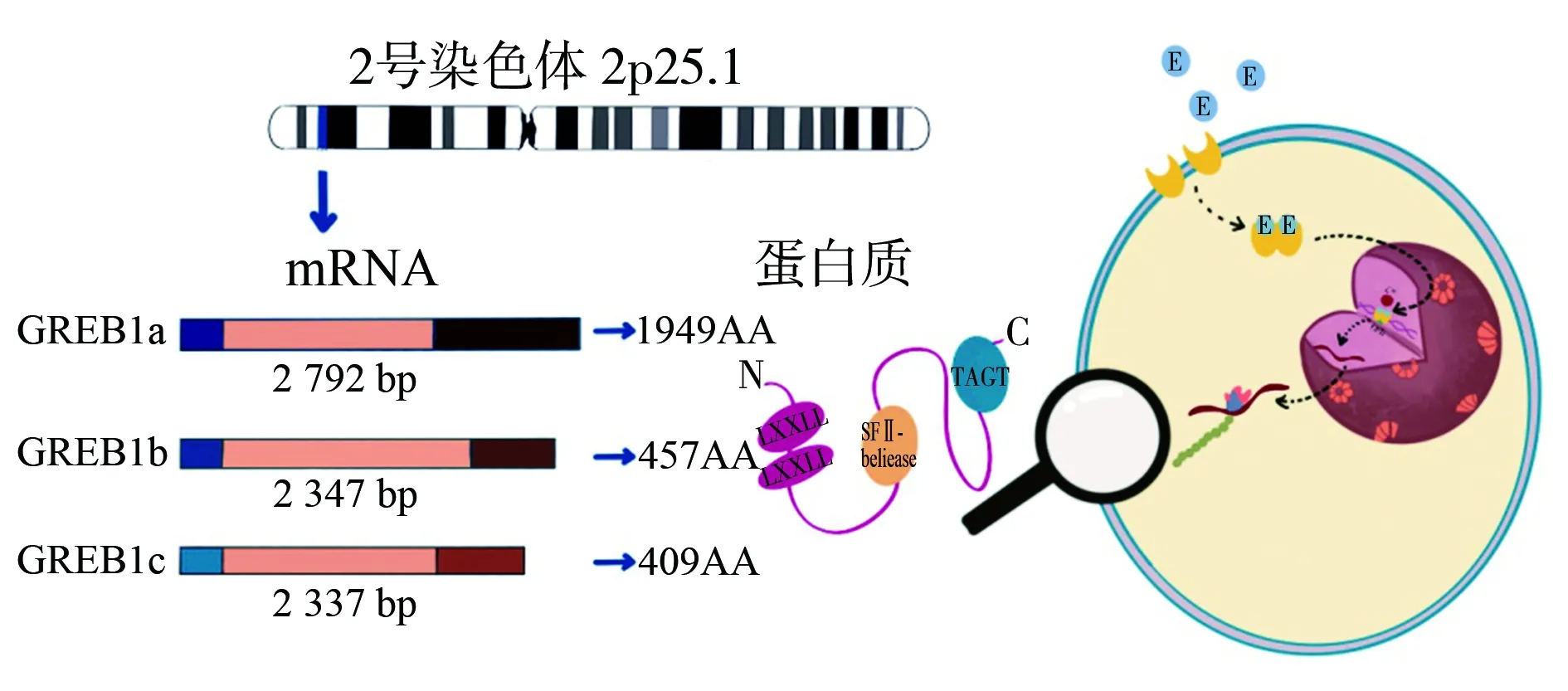
GREB1:乳腺癌雌激素调控因子1;mRNA:信使RNA;SFⅡ:超家族Ⅱ;TAGT:TET/JBP和糖基转移酶形成的结构域
研究表明,GREB1可通过调节细胞内信号通路中磷脂酰肌醇-3-激酶活性和磷脂酰肌醇-3,4,5-三磷酸转换影响蛋白激酶B的激活,进而影响乳腺肿瘤细胞增殖[19]。该调节依赖于细胞内机制,而不是通过自分泌或旁分泌因子诱导实现。相关自分泌/旁分泌因子可通过受体酪氨酸激酶正常激活磷脂酰肌醇-3-激酶。研究发现,蛋白激酶B的激活可以解除GREB1基因敲除所致的雌激素依赖性乳腺癌细胞的生长抑制,提示GREB1介导的蛋白激酶B激活对于依赖雌激素的增殖至关重要[20]。
2 GREB1与子宫内膜疾病
在育龄妇女中,下丘脑-垂体-卵巢轴的周期性调控使卵巢周期性分泌雌激素和孕激素,进而促使子宫内膜增殖、转化和脱落,形成月经。而GREB1在子宫内膜中高表达。在女性月经周期中,GREB1水平与育龄期女性体内雌激素水平波动一致[2]。在卵泡成熟期以及黄体中期,雌激素水平较高时,子宫内膜中的GREB1水平明显高于早卵泡期低雌激素状态下的GREB1水平。在体外培养的人和大鼠的子宫内膜细胞中,给予外源性雌激素后GREB1的水平上升[21];当卵巢切除后雌激素水平下降,GREB1水平也随之下降[2]。
2.1子宫内膜癌 当下丘脑-垂体-卵巢轴出现异常,子宫内膜长期暴露于雌激素作用下,无孕激素转化则易导致子宫内膜增生,甚至子宫内膜癌变。在子宫内膜癌细胞中,GREB1的表达与ERα活化呈正相关,敲除ERα后GREB1的表达受到抑制,内膜癌细胞的增殖也受到抑制[22]。NCOA6是雌激素与ER结合的辅助活化因子。在子宫内膜癌Ishikawa细胞中,NCOA6参与了雌激素对GREB1的转录调控,在这一调控通路中,NCOA6可通过调控GREB1增强子和启动子的编码发挥作用[23]。GREB1低水平表达可能与子宫内膜癌细胞的化疗耐药有关[23]。此外,跨疾病全基因组关联分析显示,子宫内膜癌中有13个位点可能与子宫内膜异位症在基因上发生重叠(P≤10-5),其中一个单核苷酸多态性位点rs2475335位于受体型蛋白酪氨酸磷酸酶D基因内含子中,该位点与子宫内膜癌和子宫内膜异位症均显著相关[24]。受体型蛋白酪氨酸磷酸酶D是蛋白酪氨酸磷酸酶家族成员,能下调蛋白酪氨酸磷酸化水平。其突变与子宫内膜癌的发病相关[24]。突变的蛋白酪氨酸磷酸酶D可增强信号转导及转录激活因子3途径[24],而信号转导及转录激活因子3途径是同时参与子宫内膜异位症和子宫内膜癌的一条重要通路[25-26]。故推测,子宫内膜癌可能与子宫内膜异位症在基因以及调控通路上存在重叠。
2.2子宫内膜异位症 子宫内膜异位症是子宫内膜腺体或间质在子宫以外的部位生长的一类疾病,异位内膜病灶形成异位结节,导致痛经、慢性盆腔痛、月经异常和不孕等,是育龄期妇女的常见疾病之一。子宫内膜异位病灶的生长与雌激素密切相关。子宫内膜中同时表达了ERα和ERβ两种受体,且以ERα为主。正常人群中,ERα和ERβ的表达水平低于子宫内膜异位症人群;子宫内膜异位症人群中,在位子宫内膜的ERα和ERβ的表达水平低于异位子宫内膜[27]。GREB1在正常人群、在位子宫内膜以及异位子宫内膜中的表达也符合上述规律[28]。GREB1在子宫内膜异位组织中的高表达提示其可能参与了子宫内膜异位症的发生与进展。子宫内膜异位症的发生除与雌激素关系密切外,基因遗传因素也占有重要地位[29]。针对不同种族子宫内膜异位症患者GREB1单核苷酸多态性的研究显示,GREB1基因多态性与子宫内膜异位症的发生密切相关[30-35]。目前发现的与子宫内膜异位症关系密切的GREB1单核苷酸多态性位点包括rs10929757[30]、rs13391619[31]、rs13394619[32]、rs142882892[33]、rs1250248[34]、rs12700667[35]以及rs4141819[35],研究涉及的人群来自比利时、澳大利亚、美国、丹麦、日本、希腊等国家的不同种族,说明GREB1基因多态性与子宫内膜异位症的关系具有普遍性。
3 GREB1与卵巢癌
卵巢癌是女性生殖系统肿瘤中恶性程度较高的一类肿瘤。卵巢位于盆腔深处,由于早期症状不明显且缺乏有效的筛查方法,卵巢癌的早期诊断十分困难,因此约75%的卵巢癌在晚期才被确诊[36]。根据组织学特性,卵巢肿瘤可分为上皮源性肿瘤、间叶性肿瘤和上皮间叶性肿瘤、性索-间质肿瘤、生殖细胞肿瘤、转移性肿瘤和其他,其中上皮性卵巢癌约占卵巢恶性肿瘤的90%[37]。有研究显示,86%的浆液性上皮性卵巢肿瘤为ER阳性肿瘤[38]。晚绝经导致的长期雌激素暴露可增加卵巢癌的发生风险[39]。体外实验也证实,雌激素可促进ER阳性卵巢癌细胞系的增殖[40]。有研究对卵巢癌组织芯片进行分析发现,GREB1在75%~85%的上皮性卵巢癌细胞中表达,其表达与ER的表达一致;在小鼠腹水卵巢癌细胞中,GREB1的过表达有促进细胞增殖和迁移的作用[41]。有学者将GREB1表达水平升高的小鼠腹水卵巢癌细胞进行肿瘤异种移植发现,肿瘤生长加快,中位生存时间缩短;当敲除腹水卵巢癌细胞中的GREB1,细胞增殖减少,形态学趋向良性改变[10,41]。以上研究证明,GREB1参与了雌激素对上皮性卵巢癌的调控。
关于卵巢癌的耐药与预后,Veskimäe等[42]对53例对铂类耐药的卵巢癌患者进行了分析,结果发现GREB1与铂类耐药有关:在铂类敏感的卵巢癌患者中,GREB1表达增加甚至过表达;但在铂类耐药的卵巢癌患者中,GREB1的表达下调,且GREB1的表达与卵巢癌患者无进展生存期呈正相关。另有文献报道,GREB1的低甲基化与卵巢癌患者无进展生存期呈正相关[43]。
4 GREB1与其他子宫肿瘤
4.1子宫肉瘤 子宫肉瘤是一种来源于子宫平滑肌、子宫内膜间质和结缔组织的女性生殖系统恶性肿瘤。目前关于GREB1与子宫肉瘤的研究较少,以个案报道为主。关于GREB1与子宫肉瘤的报道集中于类似卵巢性索肿瘤的子宫肿瘤(uterine tumor resembling ovarian sex cord tumor,UTROSCT)。UTROSCT是非常罕见的子宫间质细胞恶性肿瘤。在这类子宫肉瘤组织中可见上皮、平滑肌和性索等成分的标志物,梭形细胞增殖伴广泛的性索间质样分化,但缺乏子宫内膜间质成分[44-45]。2018年Brunetti等[46]首先报道了1例UTROSCT患者发生染色体易位(2;8)(p25;q13),基因组测序分析显示,(2;8)(p25;q13)易位导致了GREB1-NCOA2融合基因,其中GREB1的前3个外显子(NM 014668.3)融合到NCOA2的第15个外显子(NM 001321703.1)。2019年Lee等[47]报道了2例UTROSCT,并在患者中观察到GREB1-核受体亚家族4A第3成员以及GREB1-NCOA1的异位和融合。2020年,Bennett等[48]又在3例复发型UTROSCT患者中观察到ESR1-NCOA2融合的现象。这一系列报道均涉及GREB1、ER与核受体家族基因的融合。在经典的雌激素信号通路中,核受体家族成员是雌激素与受体结合的辅助活化因子,可通过影响雌激素与受体的结合和活化,进而调控GREB1的转录与表达。但上述融合与异位的意义目前尚不清楚。GREB1基因的融合可能与UTROSCT肿瘤恶性程度相关,其在子宫肉瘤发病和进展中的作用尚待深入研究。
4.2子宫肌瘤 子宫肌瘤是威胁女性生殖健康的常见良性子宫肿瘤,也是最常见的子宫切除的原因。子宫肌瘤主要由子宫平滑肌细胞增生构成,是一种激素依赖性肿瘤,其发生与进展与体内雌激素水平相关。此外,子宫肌瘤也与基因和遗传有关。Rafnar等[49]对欧洲16 595例子宫肌瘤患者以及523 330例非子宫肌瘤人群进行全基因组关联分析发现,子宫肌瘤的基因特征与激素相关风险位点一致,其中包括位于2p25.1的GREB1。GREB1的两个单核苷酸多态性[rs10929757(Asn77Thr)和 rs148143917(上游变体)]变异与平滑肌瘤相关[49]。在另一项对15 453例子宫肌瘤病例和392 628例非子宫肌瘤人群的研究中,全基因组关联分析同样也证实了GREB1的单核苷酸多态性rs10929757(Asn77Thr)变异与子宫肌瘤相关[50]。同时,GREB1的单核苷酸多态性rs10929757(Asn77Thr)变异也与子宫内膜异位症相关[30]。这一发现再一次从两种不同的疾病角度论证了GREB是雌激素相关疾病中的一个重要调控因子。
5 结 语
GREB1是雌激素反应性基因,受到经典雌激素核受体调控通路的调节,并参与多种雌激素相关生殖系统疾病的病理生理过程。现有研究虽然已从GREB1的结构、基因多态性及其在各种雌激素相关疾病中的表达等方面论证了其作用,但是关于GREB1的结构和功能仍有很多方面未知。GREB1与其他激素依赖性生殖系统疾病的关系也需要进行更深入的研究。可见,作为雌激素调控基因,未来研发抑制GREB1的相关靶向药物有可能会对现阶段难以攻克的雌激素依赖性生殖系统疾病的治疗提供新思路。

