婴幼儿龋病口腔微生物群失调与唾液免疫生物标志物的关系研究
纪 莹, 吴婷婷, 王 欣, 唐 丽, 杜小沛
(辽宁省大连市口腔医院, 1. 口腔预防科, 2. 牙体牙髓科, 辽宁 大连, 116021)
婴幼儿龋病(ECC)是以细菌为主的多种因素导致的牙体组织发生不可逆的慢性免疫炎症反应的一类疾病[1]。目前,采用传统抗菌药物治疗龋病未得到理想效果。口腔微生物在ECC的发生及发展中可能起到了重要作用,正常的口腔生物膜系统中,微生物群落保持着动态平衡,一旦口腔外界环境发生变化或失衡,则会使微生物间的拮抗作用被打破,造成致病菌大量生长,影响口腔健康[2]。随着龋病的发生、发展,牙体硬组织脱矿,胶原蛋白暴露,而与龋病相关的胶原蛋白酶主要包括基质金属蛋白酶(MMP)和组织蛋白酶,其中MMP是一类牙组织基质中的肽酶,参与牙周杂层和龋病细胞外基质成分的降解[3]。此外, MMP还可通过蛋白水解激活或降解细胞因子和趋化因子对免疫和炎症起到调节作用[4]。龋病的进展常伴随免疫机制的改变,免疫反应在对抑制龋病的发生中具有重要作用,可保护牙齿硬组织免受感染[5]。本研究探讨ECC口腔微生物群失调及其与唾液免疫生物标志物的关系,明确免疫功能低下与ECC发生、发展的关系,现报告如下。
1 资料与方法
1.1 一般资料
选取2019年6月—2020年6月本院收治的龋病患儿600例为研究对象,依据世界卫生组织(WHO)龋齿诊断标准,将患儿分为低龋组(n=267)和高龋组(n=333)。纳入标准: ① 无慢性、系统性疾病者; ② 近3个月内未接受过药物治疗者; ③ 半年内未使用过含氟制剂者。排除标准: ① 合并全身系统性疾病者; ② 合并精神疾病者; ③ 合并炎症、免疫感染类疾病者; ④ 严重电解质紊乱者; ⑤ 合并恶性肿瘤者; ⑥ 具有不良饮食习惯者,如甜食摄入较多,吮吸手指等。另选取同期在本院体检的健康婴幼儿100例为对照组。3组性别、年龄、体质量等一般资料比较,差异无统计学意义(P>0.05), 具有可比性,见表1。

表1 3组一般资料比较
1.2 方法
治疗前,所有入组对象于清晨使用清水漱口,然后采用无菌平板培养皿收集唾液样本,并迅速分装到EP管中,置于液氮罐中保存待用。唾液冻存前,取1 mL进行微生物检测,记录各组链球菌、乳酸杆菌、放线杆菌以及双歧杆菌的菌落数。取唾液样本, 3 000转/min 离心10 min, 取上清液50 μL, 采用酶联免疫吸附法(ELISA)检测各组唾液中MMP-2、MMP-3、MMP-9水平,所用试剂盒购自美国BIOTANG公司。采用Model550全自动多功能酶标仪(美国BIO-RAD公司)及ELISA法检测唾液中炎症因子水平如白细胞介素(IL)-6、IL-8、肿瘤坏死因子-α(TNF-α)。所用试剂盒购自美国BIOTANG公司。采用Im-mage 800全自动特定蛋白仪(美国Beckman公司)检测唾液免疫指标,包括免疫球蛋白(Ig)(IgA、IgG)及补体C3、补体C4。
1.3 统计学分析
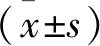
2 结 果
2.1 各组口腔微生物群菌落数比较
高龋组链球菌、乳酸杆菌、放线杆菌菌落数多于低龋组和对照组,双歧杆菌菌落数少于低龋组和对照组,差异有统计学意义(P<0.05); 低龋组链球菌、乳酸杆菌、放线杆菌菌落数多于对照组,双歧杆菌菌落数少于对照组,差异有统计学意义(P<0.05), 见表2。

表2 各组口腔微生物群菌落数比较 CFU/mL
2.2 各组基质金属蛋白酶水平比较
高龋组MMP-2、MMP-3和MMP-9水平均高于低龋组和对照组,差异有统计学意义(P<0.05); 低龋组MMP-2、MMP-3和MMP-9水平均高于对照组(P<0.05), 差异有统计学意义,见表3。

表3 各组MMP水平比较 μg/L
2.3 各组炎症因子水平比较
高龋组IL-8、IL-6和TNF-α水平均高于低龋组和对照组,差异有统计学意义(P<0.05); 低龋组IL-8、IL-6和TNF-α水平均高于对照组,差异有统计学意义(P<0.05), 见表4。

表4 各组炎症因子水平比较 pg/mL
2.4 各组免疫功能指标比较
高龋组IgA、IgG、补体C3和补体C4水平均低于低龋组和对照组,且低龋组IgA、IgG、补体C3和补体C4水平均低于对照组,差异有统计学意义(P<0.05), 见表5。

表5 各组免疫功能指标比较 g/L
2.5 口腔菌群与MMP、炎症因子和免疫功能的相关性分析
Pearson相关性分析表明,链球菌、乳酸杆菌、放线杆菌与MMP-2、MMP-3、MMP-9、IL-8、IL-6和TNF-α水平呈显著正相关(P<0.05), 与IgA、IgG、补体C3和补体C4水平呈显著负相关(P<0.05); 双歧杆菌与MMP-2、MMP-3、MMP-9、IL-8、IL-6和TNF-α水平呈显著负相关(P<0.05), 与IgA、IgG、补体C3和补体C4水平呈显著正相关(P<0.05), 见表6。

表6 口腔菌群与MMP、炎症因子和免疫功能的相关性分析
3 讨 论
ECC是儿童最常见的口腔疾病,具有发生率高、进展迅速、累及广、治疗难度大等特点[6]。既往研究认为,以变异链球菌为代表的一系列细菌是龋病的单一致病菌,然而基于传统致病菌的治疗未能有效降低龋病的发生率,可见到单一致病菌理论无法完全反映疾病与微生物之间的关系。口腔中的微生物对ECC的发生和发展具有重要作用[7]。口腔微生物组分复杂,对口腔健康至关重要,人类口腔中有700多种微生物,主要以细菌为主。口腔微生物群有助于阻止病原微生物的生长,维持口腔微生态的稳定与平衡。微生物与宿主关系失衡会导致口腔微生态失调,诱发龋齿和牙周病等口腔疾病,导致潜在致病微生物增殖[8]。唾液中混杂了广泛的口腔微生物,因其物理条件独特、理化性质以及容易获取,为口腔微生物群的研究提供了理想的条件。MA C等[9]采用变性梯度凝胶电泳对龋病唾液微生物进行研究,结果发现,患龋组唾液微生物多样性低于无龋组唾液微生物的多样性。对2例刚出生的婴儿唾液微生物研究[10]发现,随着牙齿从健康到龋病,口腔微生物多样性逐渐减少,原因可能是随着龋病的发展和口腔pH值的逐渐下降,耐酸菌逐渐增多,影响正常口腔菌群的定植,菌群的结构呈现单一性,多样性减少。FREGNANI E R等[11]通过比较无龋病和严重ECC儿童唾液及菌斑微生物菌群情况认为,变异链球菌、放线菌属等与严重ECC有显著相关性。JIANG W等[12]基于测序技术对患有不同龋病的儿童口腔微生物分析发现,链球菌属、放线菌属的丰度在严重ECC患儿中相对增加。本研究发现,高龋组链球菌、乳酸杆菌、放线杆菌菌落数明显多于低龋组和对照组,双歧杆菌菌落数少于低龋组和对照组,低龋组链球菌、乳酸杆菌、放线杆菌菌落数多于对照组,双歧杆菌菌落数少于对照组。当龋病发生时,链球菌、乳酸杆菌、放线杆菌致龋微生物增加,而双歧杆菌等益生菌减少,表明口腔微生态失调可能参与了婴幼儿龋病的发生与发展。当然,部分患儿食欲、消化能力、胃肠道功能(便秘、腹泻)等也可能与口腔微生态存在一定联系。
龋病形成的机制较为复杂,主要包括以下步骤: 生物膜中致龋细菌代谢增加了酸性物质的分泌; 代谢产生的酸性物质导致pH值下降,造成牙齿脱矿; 未有效干预牙齿进一步脱矿,形成龋齿[13]; 细菌产酸进一步激活MMP降解细胞外基质,促进细菌侵袭牙龈,进一步促进龋病的发展[14]。ANTUNES L A等[15]发现,儿童早期龋病中MMP-9基因型出现率较高,且与釉质白斑的形成有关,而MMP-2、MMP-3基因型与龋病易感性相关[16]。此外, MMP可作用于促炎细胞因子、趋化因子和其他蛋白质,以调节炎症和免疫的各个阶段,其中MMP-3作为信号分子可诱导促炎性因子或诱导型一氧化氮合酶(iNOS)的表达[17]。
在炎症条件下,由免疫反应介导的内源性降解途径的激活会导致破坏性细胞分子从正常细胞中释放出来。MMP及其调节剂可以相互激活,并通过降解细胞外基质成分以及调节细胞因子和趋化因子在免疫反应中发挥重要作用[18]。免疫反应在龋齿形成过程中扮演者重要角色, IgA是人类唾液中最丰富的抗体,分泌型免疫球蛋白A(SIgA)被认为是抵御黏膜表面病原体的第一道防线[19]。研究[20]表明,选择性IgA缺乏症患儿比健康儿童患龋病的风险更高。补体系统是先天性免疫应答的重要组成部分,在帮助宿主抵抗感染方面发挥核心作用,可通过过敏性休克毒素的产生、调理、病原体的溶解等多种机制增强适应性免疫应答[21]。本研究发现,高龋组MMP-2、MMP-3、MMP-9、IL-8、IL-6和TNF-α水平均高于低龋组和对照组,低龋组以上指标均高于对照组; 高龋组IgA、IgG、补体C3和补体C4水平均低于低龋组和对照组,低龋组IgA、IgG、补体C3和补体C4水平均低于对照组,差异均有统计学意义(P<0.05)。Pearson相关性分析表明,链球菌、乳酸杆菌、放线杆菌与MMP-2、MMP-3、MMP-9、IL-8、IL-6和TNF-α水平呈显著正相关,与IgA、IgG、补体C3和补体C4水平呈显著负相关; 双歧杆菌与MMP-2、MMP-3、MMP-9、IL-8、IL-6和TNF-α水平呈显著负相关,与IgA、IgG、补体C3和补体C4水平呈显著正相关。由此可见,当宿主免疫系统不平衡时,口腔微生物群发生改变,这些微生物可能会侵入口腔组织,诱发口腔疾病,或激活降解细胞外基质途径,加重炎症反应,抑制免疫功能,进一步促进疾病的发展。

