伴睡眠周期性肢体运动的帕金森病患者睡眠结构分析
陈海泓
帕金森病(Parkinson's disease,PD)是世界范围内主要神经退行性疾病之一[1,2]。除了运动性症状外,PD患者多发精神障碍、认知障碍、自主神经功能障碍和睡眠障碍等症状[3~5]。流行病学研究发现,PD伴睡眠障碍主要包括日间嗜睡(EDS)、睡眠片段化、失眠、快动眼睡眠行为障碍(RBD)和睡眠周期性肢体运动(PLMS)[6]。横断面研究表明,PD患者睡眠障碍症状与认知和运动功能障碍之间存在复杂的相互关系[7,8]。PD是一种进展性疾病,这些症状随着时间的推移而改变,最终会对疾病结果产生重大影响[9]。通过对PD伴和不伴频发PLMS患者的相关睡眠数据比较分析,研究 PD伴PLMS睡眠结构特征,以期为 PD 合并PLMS患者的睡眠障碍诊治提供依据。
1 对象和方法
1.1 研究对象 系2018年1月至2020年12月在我院门诊及住院诊断PD,并且在睡眠中心进行多导睡眠图(polysomnography,PSG) 监测27例患者,PD的临床诊断参考 1992 年英国帕金森病协会(UKPD) 脑库制订的原发性 PD 诊断标准[10]。对PD患者,PLMS的诊断参考2006年由世界睡眠医学会(WASM)与国际不安腿综合征研究组(IRLSSG)修订的判读规则[11]:睡眠中单次肢体运动事件持续时间为0.5~10 s,肌电活动振幅较静息状态增加8 μV,连续发生≥ 4次肢体运动,相邻两个肢体运动事件起点的间隔时间为5~90 s,其严重程度根据PLMSI来衡量,即指睡眠期间每小时的PLMS次数。排除中枢神经系统肿瘤、脑血管病、心肌病、癫痫、药物或酒依赖、重度抑郁的患者。
1.2 方 法
1.2.1 资料采集 本研究得我院医学伦理委员会批准,在患者知情情况下由专门从事睡眠医学的医师收集所有样本的资料(年龄、性别、身高、体质量)和PSG监测数据。并根据 PLMSI 15次/h为界将样本分两组。
1.2.2 PSG检测方法 PD患者药物治疗方案保持不变。患者在未服用镇静催眠药物的情况下,于舒适、安静的室内采用Phillip Alice 6 LDxN/LDxS PSG监测系统进行睡眠监测。监测时间为 21:00 至次日 7:00,计算机自动记录脑电图、眼动图、颏肌电图、下肢肌电图和呼吸气流等。计算机辅助生成试验所需参数,由经过PSG技术培训的医师根据美国睡眠医学会睡眠及其相关事件判读手册2.3版进行修正分析。
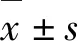
2 结 果
2.1 人口统计学、临床资料 PLMS+组和PLMS-组在人口统计学、临床资料方面的比较结果见表1,两组患者的年龄、性别、BMI指数比较差异无统计学意义(均P>0.05),具有可比性。

表1 人口统计学、临床资料
2.2 PSG测量 PLMS+组与PLMS-组睡眠结果及相关参数的比较见表2,与PLMS-组相比,PLMS+组患者的觉醒指数明显升高,NREM-Ⅲ期睡眠百分比显著下降。PLMS+组RBD患病比例更高。两组之间的其他睡眠参数没有显著差异。

表2 PLMS+组与PLMS-组睡眠结果及相关参数的比较
3 讨 论
研究目的是探讨伴PLMS的PD患者睡眠行为特征,以及PLMS对PD患者睡眠结构的影响。与PLMS-患者相比,PLMS+患者慢波睡眠(SWS)比例减少,觉醒指数升高,患RBD的比例增加。早期研究发现PLMS的患病率随着年龄的增长而增加[12],以前的研究观察到帕金森病患者中PLMS的比例高于健康老年人[13,14],支持PLMS和PD之间的关联超过年龄[15,16]。然而,PLMS与睡眠质量之间的关系存在争议,因为一些研究表明,PLMS对睡眠结构和PSG参数以及对睡眠的主观感知有很大影响[17,18],而其他研究则没有相关报道[19~22]。考虑由于PLMS似乎不是PD患者睡眠主诉的单一因素,其他因素,如神经退行性病变的程度、年龄、药物治疗的副作用或其他睡眠障碍也可能起作用,本研究将RBD、AHI指数同时纳入统计量。
PLMS的病理生理学方面,过去的研究表明脑内铁缺乏、中枢神经系统多巴胺调控和基因在PLMS和不宁腿综合征(RLS)中起着关键作用[23,24]。与健康对照组相比,不宁腿综合征患者黑质和壳核区的铁浓度降低。此外,在RLS患者中,铁浓度的变化与RLS的严重程度成比例[25,26]。铁是酪氨酸羟化酶的辅酶,该酶是多巴胺合成过程中的限速酶,多巴胺能系统的功能异常可能是PD、RBD、PLMS/RLS共同的神经病理基础。一项单光子发射计算机断层扫描(SPECT)研究[27]发现,与未患PLMS的PD患者相比,患PLMS的PD患者纹状体多巴胺转运体结合减少;此外,腿部运动次数与黑质纹状体多巴胺能细胞丢失相关。Wasserman D等研究可见iRBD患者睡眠期间出现周期性肢体运动的次数增多,iRBD患者进行纹状体多巴胺摄取示踪剂SPECT评估,相关分析表明睡眠片段化与左侧尾状核多巴胺缺乏呈明显正相关,同时整个纹状体的摄取增加和睡眠效率密切相关[28]。PD经典的 Braak病理分期三期黑质受累和四期纹状体受累[29],表明PLMS和PD、RBD之间存在共同的致病途径,涉及黑质纹状体变性。
Bugallho P等[30]队列研究显示慢波睡眠SWS的降低可以预测认知功能的恶化。本研究PLMS+组3期睡眠比例较对照组明显下降,微觉醒指数升高,PLMS除了影响睡眠质量,还可能对PD患者的认知功能减退具有预测价值,但由于收集资料过程中发现部分门诊PD患者缺乏认知功能评估,所以并未进行PLMSI与认知功能减退相关性分析。Covassin N等[31]对伴PLMS的PD患者Pearson相关分析显示,PLMSI与UPDRSⅢ呈正相关,提示随着PLMS的恶化,运动症状的损害增加。同样Happe及其同事先前通过问卷调查评估观察到PLMS与运动症状严重程度相关联[32]。而阻塞性睡眠呼吸暂停低通气综合征(OSAHS)在PD患者中较常出现,特别在PD患者疾病中晚期。PD疾病的本身病理过程可能参与了OSAHS发生。PD患者出现锥体外系症状时,全身肌肉包括咽喉肌在内肌强直引起气道张力高、肌肉协调能力差及气道肌肉不自主运动,导致上气道高阻力、气流受损。Al-Alawi 等[33]采用多导睡眠图(PSG) 对OSAS患者的研究发现,25%~50%的OSAS患者伴PLM,故可能不仅是PLM本身,PD合并睡眠呼吸事件也是造成睡眠结构紊乱的原因,但本研究显示两组间AHI指数差异无统计学意义,可能是由于样本量较少导致的误差。
在目前的研究中必须强调一些局限性。当进行单次PSG记录时,PLMS的实际发生率可能被掩盖,因为这种睡眠障碍的特征是夜间高变异性。此外,第一晚睡眠监测有可能影响受试者的睡眠模式。另外由于某些药物对睡眠-觉醒的影响,例如左旋多巴和多巴胺激动剂以及其他药物的副作用可能会影响夜间睡眠结构。因此,由于药物对帕金森病患者睡眠障碍中的影响尚不清楚,为了避免药物治疗可能产生的影响,未来的研究应增加健康受试者组成的对照组。此外,还需要进一步研究不同药物对PD伴PLMS患者的睡眠结构影响,以确定治疗两种疾病的最佳药物组合。

