α7-nAChR/PI3K/AKT/GSK-3β通路在慢性睡眠剥夺后的保护作用及其机制研究
万亚会,吕梦頔,李 征,张 轩,周凯丽,吴 伟,薛 蓉
睡眠剥夺可以诱导一系列免疫炎症反应,可使外周血中促炎因子释放增多,而睡眠恢复后血中促炎因子仍持续存在[1]。越来越多的研究表明,在中枢神经系统内,睡眠剥夺能激活星形胶质细胞和小胶质细胞,导致促炎症因子水平升高,造成神经损伤[2,3]。此外,睡眠剥夺后大脑也产生氧化应激损伤。虽然神经炎症和氧化应激都是造成睡眠剥夺不良反应的关键因素,但目前对减轻这些因素的调节机制知之甚少。
在中枢神经系统和外周系统,α7-烟碱乙酰胆碱受体(α7-nAChR)是一个重要的调节免疫反应和氧化应激的调节因子[4]。α7-nAChR不仅是传统的配体门控性离子通道,还能参与学习的过程,如记忆的巩固、运动和注意力[5,6]。刺激α7-nAChR可引起多个胞内信号通路的激活[7~9],在α7-nAChR下游,激活的PI3K / AKT信号通路抑制糖原合酶-3β(GSK-3β)[10,11],进而导致转录因子 Nrf-2 和抗氧化剂酶HO-1的表达、抑制促炎细胞因子的释放[12~14]。然而,α7-nAChR及其下游PI3K / AKT/GSK-3β信号通路在睡眠剥夺中的作用机制仍尚不明确。因此,本研究旨在探讨睡眠剥夺7 d对α7-nAChR的表达和下游神经胶质细胞的PI3K / AKT/GSK-3β信号通路活性的影响,并探讨选择性α7-nAChR受体激动剂PHA - 543613对睡眠剥夺诱发的炎症和氧化应激反应的影响。
1 材料与方法
1.1 实验动物 雄性C57BL/6J小鼠,7~8周龄,体重在20~23 g之间,由北京华阜康生物科技股份有限公司提供。每笼6只群居饲养,至于室温(22±2)℃,12:12 h昼夜循环光照,自由进食、饮水。动物于实验前适应实验环境1 w。
1.2 主要仪器及试剂 (1)高速低温离心机(日立 HITACHI 型号),超声(Thermo Forma公司,美国),微量分光光度计(Thermo NANODROP2000),PCR热循环仪K640(杭州晶格科学仪器有限公司),电泳仪(Bio-Rad公司,美国),冰冻切片机(Leica公司,德国),免疫荧光显微镜(Nikon公司,日本)。(2)大鼠抗小鼠α7-nAChR抗体(Santa Cruz Biotechnology公司),兔抗小鼠 p-AKT(CST公司,美国),兔抗小鼠p-GSK3β(CST公司,美国),兔Nrf2(Abcam公司,英国),兔抗HO-1(Abcam公司,英国),HRP标记的山羊抗大鼠IgG抗体(北京中杉金桥生物技术有限公司),山羊抗小鼠IBA-1抗体(Abcam公司,英国),兔抗小鼠GFAP抗体(Abcam公司,英国),Alexa Fluor 488 羊抗兔IgG(Abcam公司,英国),Alexa Fluor 488 AffiniPure 驴抗山羊IgG(Jackson公司,美国),Alexa Fluor 546 AffiniPure 驴抗大鼠IgG(Jackson公司,美国),PHA-543613(sigma公司,美国)。
1.3 实验方法 动物分组:C57BL/6J小鼠随机分为3组,每组24只,对照(CC)组:适宜环境下饲养1 w;慢性睡眠剥夺(SD)组:适宜环境下饲养1 w,利用改良多平台水环境法进行慢性睡眠剥夺7 d;慢性睡眠剥夺后腹腔注射α7-nAChR激动剂-PHA-543613(SD+PHA-543613)组:适宜环境下饲养1 w,利用改良多平台水环境法进行睡眠剥夺7 d,睡眠剥夺结束后6 h腹腔注射α7-nAChR受体激动剂PHA-543613(6mg/kg),连续腹腔注射3 d后处死,CC组于处死前3 d连续腹腔注射等量的生理盐水,CC组与SD组均于睡眠剥夺结束后同时处死。
1.4 慢性睡眠剥夺模型的建立 使用改良多平台水环境法(modified multiple platform method,MMPM)对小鼠进行慢性睡眠剥夺[15,16],睡眠剥夺箱长50cm、宽30cm、高30 cm,剥夺箱内均匀放有8个圆形平台,直径3 cm,高8 cm,平台间隔7 cm;造模前向剥夺箱内加水至平台下方约1 cm处,水温保持在(22±2)℃,剥夺箱顶部放置水和食物,小鼠可在平台间自由活动、摄食及饮水,每天定时更换水以保持清洁。睡眠剥夺过程保证12 h光照(9:00~21:00)、12 h黑暗(21:00~9:00)的昼夜节律,控制睡眠剥夺箱内温度20~24 ℃,相对湿度60%,保持环境无明显噪音。造模开始前3 d每天定时把SD组的小鼠放在睡眠剥夺水箱内适应环境,每天适应2 h。睡眠剥夺过程从9:00开始,每天17:00~21:00把小鼠从剥夺箱中拿出,放至原来的鼠笼中休息4 h,连续睡眠剥夺7 d。
1.5 免疫荧光染色检测星形胶质细胞和小胶质细胞表面α7-nAChR的表达 三组小鼠腹腔注射10%的水合氯醛进行麻醉,麻醉成功后使用冰PBS灌注,直至肝脏变白、自右心耳流出为澄清液体,断头取脑,沿冠状缝和矢状缝取出颅骨,暴露脑组织,先于4%多聚甲醛浸泡过夜,进行固定,再先后置于15%和30%的蔗糖溶液中梯度脱水,脱水成功后切除额极和脑干,包埋脑组织,冰冻切片机下连续切片,取各组海马组织切片,每只小鼠各取5片,切片厚度为8 μm。海马组织切片经固定、破膜,与大鼠抗小鼠α7-nAChR抗体(1∶100)、山羊抗小鼠IBA-1抗体(1∶500),兔抗小鼠GFAP抗体(1∶1000)4 ℃孵育过夜,次日与山羊抗兔IgG(FITC)(1∶1000),驴抗大鼠IgG(Alexa Fluor 596)(1∶500),驴抗山羊IgG(Alexa Fluor 488)(1∶500)室温避光孵育1 h,DAPI封片,免疫荧光显微镜观察,计数α7-nAChR与星形胶质细胞和小胶质细胞的共表达的阳性细胞数。
1.6 Western 印迹法检测蛋白表达 分离三组小鼠海马组织,加入裂解液,使用超声粉碎,于4 ℃离心机14000 r/min,离心30 min,吸取上清,BCA蛋白试剂盒测定蛋白浓度。等量蛋白经电泳转到聚亚乙烯双氧化物膜(PVDF)上,蛋白条带加入大鼠抗小鼠α7-nAChR抗体(1∶200)兔抗小鼠- p-AKT(1∶1000),兔抗小鼠-AKT(1∶1000),兔抗小鼠-p-GSK3β(1∶1000),兔抗小鼠-GSK(1∶1000),兔抗小鼠-Nrf2(1∶2000),兔抗小鼠-HO-1(1∶1000),4 ℃慢摇孵育过夜,次日与HRP标记的山羊抗大鼠IgG抗体(1∶5000)室温慢摇孵育1 h,ECL超敏发光混合液进行凝胶成像拍照。
1.7 实时荧光定量PCR(Rt-PCR)检mRNA表达 分离三组小鼠海马组织,使用Trizol试剂提取RNA,紫外分光光度计检测RNA浓度。加入逆转录反应体系,将RNA逆转录合成cDNA第一条链,再向cDNA模板中加入PCR预混液进行PCR扩增,Bio-Rad检测目的基因的相对表达水平,通过比较CT值获得目的基因的相对表达水平(见表1)。

表1 (加标题)
1.8 行为学评估 Morris 水迷宫通过检测实验动物的空间定位来评估其学习记忆能力。水迷宫高0.5 m,直径1.5 m,里面装满水,用白色染料将水染白,温度保持在(24±1)℃,水下1 cm 有一个可以移动的平台,应用计算机系统将水面等分为4 个象限,可移动平台置于第一象限中央,用摄像头采集小鼠在水迷宫里运动的参数。本实验依据小鼠定位航行实验中逃避潜伏期和空间探索实验中的穿越平台次数和处于目标象限时间、平均游泳速度来评价小鼠的学习记忆能力。
定位航行实验:小鼠每天进行4 次不同象限实验学习,每次实验时,实验平台位于相同的位置。每次实验在小鼠爬上平台2 s或游泳60 s后结束。如果动物在60 s后没有找到平台,将它放到平台上学习20 s,然后进行下只小鼠试验。小鼠于睡眠剥夺开始后每天进行定位航行训练,早晨8:30 开始进行。第4次试验结束后,这些动物被保温1 h,然后放回到睡眠剥夺箱里。利用计算机软件计算动物到达平台的逃逸潜伏期和运行轨迹。空间探索实验:在小鼠慢性睡眠剥夺7 d后早晨8:30,所有小鼠进行空间探索实验,将水迷宫中的平台撤去,将小鼠面朝桶壁扔进水里(除第一象限外),用计算机记录小鼠在90 s 内处于目标象限时间、穿越平台次数、游泳时间及运行轨迹等。
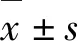
2 结 果
2.1 慢性睡眠剥夺后抑制α7-nAChR的表达和PI3K/AKT/ GSK-3β通路 慢性睡眠剥夺7 d后,SD组小鼠海马组织的α7-nAChR蛋白表达量、mRNA表达较CC组明显下降,差异具有统计学差异(P=0.001,P=0.038)(见图1)。慢性睡眠剥夺7 d后,SD组小鼠海马组织p-AKT蛋白表达量较CC组降低,差异具有统计学差异(P=0.019),p-GSK-3β蛋白表达量较CC组升高,差异具有统计学差异(P=0.011)(见图2)。

A:蛋白印迹法检测小鼠海马α7-nAChR蛋白表达;B:α7-nAChR/β-action灰度值的比较,β-action为内参;C:α7-nAChR的mRNA表达的量化比较

A、C:蛋白印迹法检测小鼠海马p-AKT、p-GSK-3β、AKT、GSK-3β蛋白表达;B、D:p-AKT、p-GSK-3β、AKT、GSK-3β/GAPDH灰度值的比较,GAPDH为内参;*P<0.05,**P<0.01
2.2 激活α7-nAChR诱导PI3K/AKT/GSK-3β通路的激活 慢性睡眠剥夺后腹腔注射PHA-543613后,SD组与SD+PHA-543613组比较,星形胶质细胞表面α7-nAChR的表达较SD组升高(P=0.027),SD+PHA-543613组小胶质细胞表面α7-nAChR的表达较SD组也增多,但差异无统计学意义(见图3A,B)。慢性睡眠剥夺后腹腔注射PHA-543613后,SD+PHA-543613组海马组织的p-AKT蛋白表达量较SD组增多,差异具有统计学意义(P=0.047),SD+PHA-543613组海马组织的p-GSK-3β蛋白表达量较SD组增多,差异具有统计学意义(P=0.017)(见图 3C,D)。
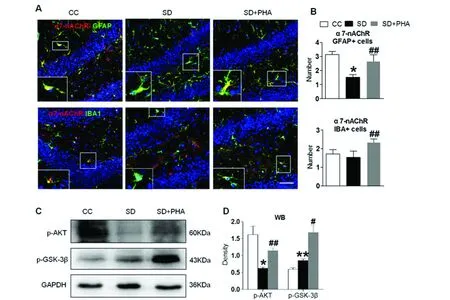
A:免疫荧光检测三组小鼠海马组织α7-nAChR与GFAP、IBA1的共表达;B:三组小鼠海马组织α7-nAChR与GFAP共表达、α7-nAChR与IBA1共表达的阳性细胞定量分析,红色荧光标记α7-nAChR,绿色荧光分别标记GFAP+星形胶质细胞和IBA1+小胶质细胞。C:蛋白印迹法检测小鼠海马p-AKT、p-GSK蛋白表达;D:p-AKT、p-GSK /GAPDH灰度值的比较,GAPDH为内参;*为CC组与SD组比较,#为SD组与SD+PHA组比较,* P<0.05,**P<0.01;#P<0.05,##P<0.01
2.3 激活α7-nAChR减轻慢性睡眠剥夺后炎症反应和氧化应激 慢性睡眠剥夺7 d后,SD组海马组织的Nrf-2、HO-1蛋白表达较CC组明显下降,差异具有统计学意义(P=0.020,P=0.016)(见图4),同时炎性因子TNF-α、MCP-1mRNA表达较CC组明显增多、抑炎因子CD206、TGF-βmRNA表达较CC组减少,差异均具有统计学意义(均P<0.01)(见图5A)。腹腔注射PHA-543613后,SD+PHA-543613组海马组织的Nrf-2和HO-1蛋白表达、CD206、TGF-βmRNA表达较SD组增多,差异具有统计学意义(P<0.05)(见图4、图5B),而TNF-α、MCP-1 mRNA表达较SD组明显下降,差异具有统计学意义(均P<0.01)(见图7A)。

A:蛋白印迹法检测小鼠海马Nrf-2、HO-1蛋白表达;B:Nrf-2、HO-1/β-action灰度值的比较,β-action为内参

注:*为CC组与SD组比较,#为SD组与SD+PHA组比较* P<0.05,**P<0.01;#P<0.05,##P<0.01;A:炎性因子mRNA表达的量化比较;B:抑炎因子 mRNA表达的量化比较

注:*为CC组与SD组比较,#为SD组与SD+PHA组比较*P<0.05,**P<0.01;#P<0.05,##P<0.01;A,B:三组小鼠逃避潜伏期的比较;C:三组小鼠游泳速度的比较;D:三组小鼠处于目标象限时间的比较;E:三组小鼠穿越平台次数的比较
2.4 激活α7-nAChR改善慢性睡眠剥夺后的认知功能下降 慢性睡眠剥夺后,SD组较CC 组逃避潜伏期延长、穿越平台次数减少、处于目标象限时间缩短,差异有统计学意义(P=0.000,P=0.000,P=0.000);腹腔注射PHA-543613后,SD+PHA-543613组组较SD组逃避潜伏期缩短、穿越平台次数增多、处于目标象限时间延长,差异有统计学意义(P=0.000,P=0.000,P=0.001)。各组小鼠游泳速度无统计学差异。
3 讨 论
本研究首次证实刺激α7-nAChR能减轻慢性睡眠剥夺后炎症和氧化应激反应。慢性睡眠剥夺后引起海马α7-nAChR表达下调、PI3K / AKT / GSK-3β信号通路处于抑制状态。PHA-543613处理后诱导α7-nAChR表达上调和PI3K/AKT/GSK-3β信号通路的激活,同时海马的神经炎症和氧化应激均减轻,改善小鼠认知功能。这些结果表明α7-nAChR可以作为慢性睡眠剥夺后海马神经炎症和氧化应激的触发点之一,刺激α7-nAChR可能对睡眠剥夺产生保护作用。
在中枢神经系统,α7-nAChR主要分布在神经元[17,18]。越来越多的研究发现星形胶质细胞[19]和小胶质细胞[20,21]、T细胞[22]、B细胞[23]和单核细胞[24]表面上也有α7-nAChR的表达。小胶质细胞和星形胶质细胞是脑内主要的免疫炎性细胞,具有抗原呈递和产生促炎或抗炎因子等多种功能[25~27]。慢性睡眠剥夺会激活小胶质细胞和星形胶质细胞[3,28],因此小胶质细胞和星形胶质细胞可能成为限制睡眠剥夺后大脑炎症和氧化应激的潜在靶点。
我们的实验证实α7-nAChR在小胶质细胞和星形胶质细胞表面均有表达,与既往文献报道一致。慢性睡眠剥夺后,α7-nAChR在小胶质细胞和星形胶质细胞的表达减少,促炎因子释放增加,而抗炎因子和抗氧化酶表达减少。腹腔注射α7-nAChR受体激动剂PHA-543613干预改变小胶质细胞和星形胶质细胞的反应,使抗氧化酶和抑炎因子的表达和释放增多,促炎因子表达减少,削弱炎症和氧化应激反应。通过水迷宫对小鼠行为学进行评估,发现慢性睡眠剥夺后小鼠认知功能下降,而在PHA-543613处理后认知功能改善。这些实验结果提示α7-nAChR可能通过调节炎症反应和氧化应激为睡眠剥夺引起的损伤提供保护作用。
PI3K/AKT/GSK-3β作为α7-nAChR下游的一条重要信号通路,因此本实验进一步探索了慢性睡眠剥夺后α7-nAChR下游PI3K / AKT / GSK-3β的状态,实验结果表明,慢性睡眠剥夺后p-AKT表达减少、p-GSK-3β表达增多,PI3K / AKT / GSK-3β信号通路处于抑制状态,经PHA-543613处理后p- AKT、p-GSK-3β表达均增多,该信号通路被激活。这些结果均提示α7-nAChR可能通过调节小胶质细胞和星形胶质细胞PI3K / AKT / GSK-3β抑制神经炎症反应和氧化应激为睡眠剥夺引起的损伤提供保护作用。但值得注意的是巨噬细胞[7]和单核细胞[24]表面也表达α7-nAChR,而PHA-543613也可能作用于这些细胞以减少睡眠剥夺后的炎症反应和氧化应激,睡眠剥夺后α7-nAChR调节炎症反应和氧化应激的机制仍需进深入研究。
既往研究结果表明,α7-nAChR可以通过PI3K / AKT / GSK-3β减轻炎症损伤[29~35]。在脑出血大鼠模型中,α7-nAChR受体激动剂通过PI3K / AKT / GSK-3β通过改善大鼠脑出血后24 h和72 h的神经功能和减轻脑水肿,发挥神经保护作用[30],并且还可以保护血脑屏障的完整性[10,30]。在心肌缺血再灌注模型中,α7-nAChR受体激动剂可以激活p38MAPK和JNK信号通路,减少ROS生产、增加细胞的ATP,进而减少心肌组织损伤和改善心脏收缩功能[31]。Eran Nizri等也发现实验性自身免疫性脑脊髓炎模型中,α7-nAChR通过抑制炎症因子的释放缓解大鼠的症状[32]。我们研究结果同样证实PHA-543613治疗显著降低了慢性睡眠剥夺后促炎因子的释放,增加抗炎因子和抗氧化酶的表达。这些结果与先前的报告证明α7-nAChR提供类似的神经保护作用。我们仍发现,PHA -543613显著增加了慢性睡眠剥夺后的抗氧化酶Nrf-2和HO-1的表达。Nrf-2和HO-1是抑制氧化应激的主要抗氧化酶,动物实验证明,Nrf-2和HO-1具有抗炎作用,抑制炎症因子的释放,如TNF-α,IL-1β和MIP-1,在抗氧化应激中起着重要的作用[36~38]。然而Nrf-2和HO-1表达的增加是否进参与慢性睡眠剥夺后抑制炎性因子的释放、促进抗炎因子的释放,有待进一步研究。
综上所述,慢性睡眠剥夺抑制α7-nAChR的表达,而刺激α7-nAChR通过激活PI3K / AKT / GSK-3β能减轻慢性睡眠剥夺后的神经炎症和氧化应激,对睡眠剥夺起保护作用,但仍有待进一步研究证实。

