经皮胃底曲张静脉栓塞术治疗肝硬化门静脉高压合并食管胃底静脉曲张破裂出血患者的临床价值
王卫锋
(安阳市第六人民医院消化内科,河南 安阳 455000)
肝硬化是一种常见的慢性肝病,可由一种或多种原因引起肝脏损伤,肝脏呈进行性、弥漫性、纤维性病变[1]。该病早期无明显临床症状,晚期出现不同程度的门静脉高压和肝功能障碍,导致上消化道出血、肝性脑病等并发症,甚至死亡。门静脉高压可引起侧支循环开放、腹水等一系列临床表现的疾病[2]。侧枝循环开放主要造成食管胃底静脉曲张、痔静脉曲张。其中肝硬化门静脉高压合并食管胃底静脉曲张破裂出血是肝硬化门静脉高压患者常见的一种并发症,患者会发生呕血、便血,出血量常常较大,临床表现无特异性,常采用手术治疗[3],是门静脉高压常见的致死原因,故及时止血治疗尤其重要。
经颈静脉肝内门体分流术(Transjugular intrahepatic portosystemic shunt,TIPS)和经皮胃底曲张静脉栓塞术(Percutaneous Transhepatic Varices Embolization,PTVE)是临床上治疗肝硬化门静脉高压合并食管胃底静脉曲张破裂出血常用的方法。TIPS采用特殊的介入治疗器械,在X线透视的诱导下,在门静脉和肝静脉之间扩张肝实质,放置支架,建立新通路,利用金属支架开通一条新的人工血管,分流门静脉的血液,使门静脉高压降低,并且有效得到控制,且具有预防食管胃底静脉曲张破裂出血,促进腹水吸收的作用[4,5]。但是该方法术后并发症较多,且大部分患者不耐受。PTVE是在胃管状静脉及其分支注入血管栓塞剂,阻断胃壁外返流的血管,有效阻止患者胃底出血。该方法仅小部分患者不耐受,使其在临床上被广泛使用[6,7]。本组研究分析了TIPS与PTVE治疗肝硬化门静脉高压合并食管胃底静脉曲张破裂出血患者的临床价值。
1 资料与方法
1.1 一般资料
选取本院2016年2月至2019年3月收治的120例肝硬化门静脉高压合并食管胃底静脉曲张破裂出血患者作为研究对象。纳入标准:患者于术前接受MSCT检查、心电图、胸片等相关检查,并在本院进行手术;既往无手术史;有便血、下腹部疼痛等症状。排除标准:资料不全者;有精神疾病史者;合并肝肾功能异常者。本研究经医院伦理委员会批准。
所有患者根据手术方法为PTVE或TIPS分为对照组(n=62)和观察组(n=58)。其中对照组男性32例,女性30例;年龄28~80岁,平均年龄56.27±4.46岁。观察组男性30例,女性28例;年龄27~80岁,平均年龄55.57±5.96岁。两组患者一般资料无统计学差异(P>0.05),具有可比性。
1.2 方法
术前2 d低蛋白饮食,术前1 d做好碘过敏试验,术前6 h禁食水。进入手术室后密切观察患者生命体征。术后对患者进行6 m的随访,分别于术前、术后1 m、3 m、6 m以不抗凝的真空采血管采集患者空腹静脉血5 mL用于凝血酶原的检测;以抗凝的真空采血管采集两组患者空腹静脉血5 mL,3000 rpm离心15 min,分离血清用于肝功能进行检测。
对照组采用PTVE手术方案:门静脉穿刺,穿刺成功之后,进行X线定位,在胃管状静脉及其分支注入无水乙醇,随后利用明胶海绵进行退鞘,将穿刺孔道封闭,防止出血。
观察组采用TIPS手术方案:颈静脉穿刺,穿刺针从肝右静脉插入门静脉,导管插入门脉系统,在门静脉和肝静脉之间扩张肝实质,放置支架,建立新通路,利用长穿刺针创造一个旁路,以便使血流改道,再以金属支架开通一条新的人工血管,分流门静脉的血液,降低曲张静脉压力;进行分流通道的扩张及内支架置入,扩张满意之后进行门静脉测压造影剂调整内支架。
1.3 观察指标
1.3.1 手术疗效和并发症
以门静脉压评估手术效果,并发症包括:再出血、肝性脑病的发生情况。
1.3.2 肝功能
肝功能检测指标包括:血清总胆红素(TBIL)、直接胆红素(DBIL)及 Child-Pugh评分。Child-Pugh评分:将患者一般状况、腹水、血清胆红素、血清白蛋白浓度及凝血酶原时间5个指标的不同状态分为三个层次,并将5个指标计分进行相加,总和最低分为5分,最高分为15分,分数越高,肝脏储备功能越差。
1.4 统计学方法
本研究数据均采用SPSS22.0软件进行统计学分析,计量资料以均数±标准差(±SD)表示,组间比较采用t检验;计数资料以例数(%)表示,组间比较采用χ2检验。P<0.05表示差异具有统计学意义。
2 结果
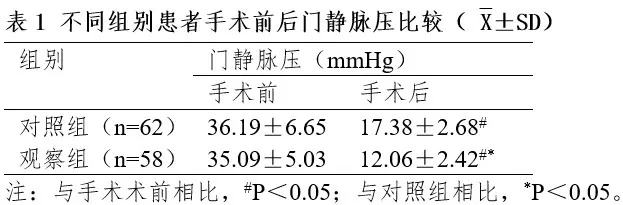
2.1 两组患者手术前后门静脉压比较
术后两组门静脉压均较术前明显降低,观察组明显低于对照组(P<0.05)。见表1。
?
2.2 两组患者术前及术后6个月内的肝功能比较
术前和术后6个月两个时间段,两组患者TBIL、DBIL及Child-Pugh评分均无明显差异(P>0.05);观察组术后1个月和3个月TBIL、DBIL浓度及Child-Pugh评分均显著高于对照组(P<0.05)。见表2。
表2 两组患者术前及术后不同时点TBIL、DBIL及Child-Pugh评分比较(±SD)
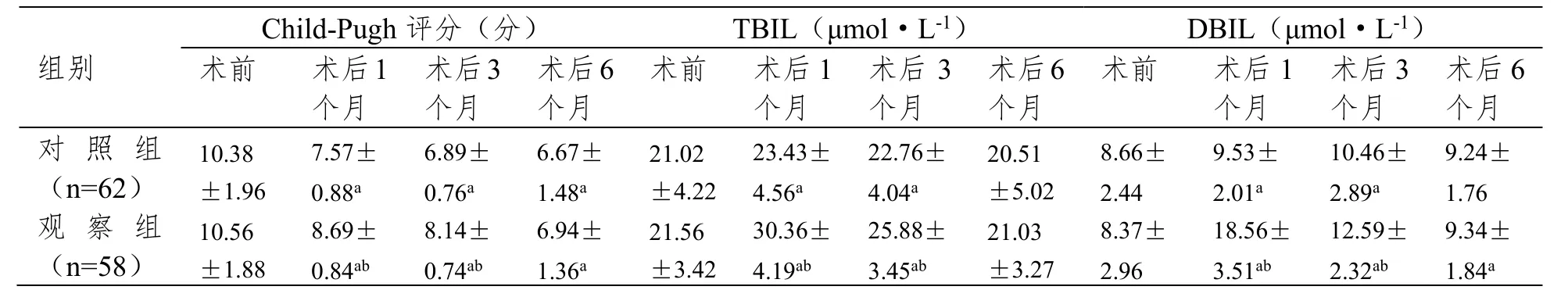
表2 两组患者术前及术后不同时点TBIL、DBIL及Child-Pugh评分比较(±SD)
注:与术前相比,aP<0.05;与对照组相比,bP<0.05。
组别 Child-Pugh评分(分) TBIL(μmol·L-1) DBIL(μmol·L-1) 术前 术后1个月 术后6个月 对照组(n=62) 术后3个月 术后6个月 术前 术后1个月 术后3个月 术后6个月 术前 术后1个月 术后3个月 9.24± 1.76 观察组(n=58) 10.38±1.96 7.57±0.88a 6.89±0.76a 6.67±1.48a 21.02±4.22 23.43±4.56a 22.76±4.04a 20.51±5.02 8.66±2.44 9.53± 2.01a 10.46±2.89a 9.34± 1.84a 10.56±1.88 8.69±0.84ab 8.14±0.74ab 6.94±1.36a 21.56±3.42 30.36±4.19ab 25.88±3.45ab 21.03±3.27 8.37±2.96 18.56±3.51ab 12.59±2.32ab
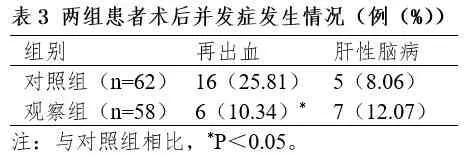
2.3 并发症发生率
两组患者术后肝性脑病发生率无明显差异(P>0.05);观察组术后再出血发生率显明显于对照组(P<0.05)。见表3。
?
3 讨论
本研究比较了TIPS与PTVE手术方案治疗的肝硬化门静脉高压合并食管胃底静脉曲张破裂出血结果。本研究发现治疗后两组患者门静脉压均较术前降低,以观察组降低更为显著,说明患者门静脉压经TIPS治疗后明显降低,分析其原因可能是因为采用PTVE治疗可有效止血,改善肝功能血流情况中效果不突出,肝脏分流于胃部的血液被阻滞,而采用TIPS治疗其根本就是降低患者门静脉压,效果显著[8]。这与姚运海等人的报道一致[9]。
周林峰等人研究发现,采用TIPS治疗患者会导致其肝功能受到一定程度的损害,而且肝脏的储备功能也会逐渐变差,从而加重患者肝脏受损[10]。本研究结果显示,观察组在术后1个月和3个月TBIL、DBIL浓度及Child-Pugh评分均显著高于对照组,而术后6各月各指标与对照组比较无明显差异,提示TIPS治疗后患者后肝功能可能出现损伤,这种损伤克随着时间延长而恢复。其原因可能是因为采用TIPS治疗需建立肝静脉及门静脉主要分支之间的人工分流通道,血流分流到下腔静脉,降低了肝脏血流,导致肝脏供血供氧不足[11]。而随着时间延长肝脏代偿作用加强,自身对肝脏机械损伤的修改和适应,以及通过肝动脉缓冲效应,使肝组织内血流灌注代偿性增加,逐渐恢复肝脏正常血流灌注,因此术后中远期肝功能出现明显好转。本研究结果还显示TIPS术后肝性脑病发生率较PTVE高,但组间比较差异无统计学意义,可能与近年来TIPS操作技术成熟及新型支架材料应用有关[12]。术后再出血亦是术后常见并发症之一,也是影响治疗效果的关键[13]。本研究结果表明,观察组术后再出血率显著低于对照组,表明TIPS治疗对控制再出血风险显著优于PTVE治疗。
综上所述,利用TIPS治疗肝硬化门静脉高压合并食管胃底静脉曲张破裂出血患者可有效降低患者门静脉压,并降低再出血的发生率,对肝功能的影响可逆,安全性更高,值得推广。
PROGRESS
Structural and functional ramifications of antigenic drift in recent SARS-CoV-2 variants
Meng Yuan, et al.
Neutralizing antibodies (nAbs) elicited against the receptor-binding site (RBS) of the spike pr otein of wild-type SARS-CoV-2 are generally less effective against recent variants of concern. RBS residues E484, K417 and N501 are mutated in variants first described in South Africa (B.1.351) and Brazil (P.1). We analyzed their effects on ACE2 binding and K417N and E484K mutations on nAbs isolated from COVID-19 patients. Binding and neutralization of the two most frequently elicited antibody families (IGHV3-53/3-66 and IGHV1-2), which can both bind the RBS in alternate binding modes, are abrogated by K417N, E484K, or both. These effects can be structurally explained by their extensive interactions with RBS nAbs. However, nAbs to the more conserved, cross-neutralizing CR3022 and S309 sites were largely unaffected. The results have implications for next-generation vaccines and antibody therapies.
Science. 2021 May 20;eabh1139. doi: 10.1126/science.abh1139.

