卵巢癌患者癌组织中nm23-H1蛋白和N-cad的表达及意义#
戎凤敏 秦海霞 张景航 张娇
(新乡医学院第一附属医院妇科,河南 新乡 453100)
卵巢癌是临床常见恶性肿瘤之一,发病率位居女性生殖系统恶性肿瘤第3位,死亡率位居妇科恶性肿瘤第1位[1]。由于卵巢癌发病隐匿,目前缺乏有效的普查和早期诊断方法,约有70%以上的患者就诊时发现肿瘤已处于晚期,预后极差[2]。恶性肿瘤的转移和侵袭与患者的预后密切相关,是患者死亡的直接原因,而nm23-H1基因重要的肿瘤转移抑制基因[3],通过橡黄素上调肝癌细胞的nm23-H1可明显抑制肝癌侵袭转移能力[4]。研究发现,神经型钙粘附蛋白(N-cadherin,Ncad)可通过上皮细胞-间质转化(Epithelial- mesenchymal transition,EMT)途径参与肿瘤的发生与转移,对妊娠滋养细胞肿瘤的发生、发展具有一定影响[5]。基于此,本文对118例卵巢癌患者癌组织中nm23-H1蛋白及N-cad表达及其临床意义进行探究,现报道如下。
1 资料与方法
1.1 一般资料
选取2011年1月至2013年12月间我院收治的118例卵巢癌患者的临床资料以及保存的癌组织和癌旁组织标本进行研究。所有患者年龄35~65岁、平均年龄51.61±10.65岁,≤60岁者44例、>60岁者74例,绝经前者43例、绝经后者75例,病理类型:浆液型腺癌71例、黏液型腺癌39例、其他8例,病理分级:Ⅰ级49例、Ⅱ级40例、Ⅲ级29例,FIGO分期:Ⅰ~Ⅱ期47例、Ⅲ~Ⅳ71例。
纳入标准:所有患者均经病理检查确诊为卵巢癌;年龄>18岁;经我院伦理委员会审核通过。
排除标准:合并其他恶性肿瘤者;其他卵巢疾病者。所有患者术前均未接受放化疗、激素治疗等新辅助抗肿瘤治疗,早期患者采用手术治疗为主,晚期患者均接受新辅助化疗及姑息性减瘤术。
1.2 方法
所有卵巢癌组织、癌旁组织标本均采用免疫组化SP法[6]:所有病例标本均经石蜡包埋,切片机5 μm连续切片,温箱烤干,切片经常规二甲苯脱蜡,梯度酒精脱水干燥,3%过氧化氢去内源性过氧化物酶,pH 6.0枸橼酸缓冲液抗原修复,血清工作液封闭10 min后加兔抗人nm23-H1单克隆抗体(北京博奥森生物技术有限公司生产),4℃冰箱孵育过夜后加入生物素标记二抗,二氨基联苯(DAB)显色,苏木精复染,梯度乙醇脱水、二甲苯透明、干燥后封片;利用光学显微镜 观察肿瘤细胞的染色情况。若细胞质或者是细胞核内部出现棕黄色的颗粒,则将nm23-H1和Ncad标记为阳性,用符号“+”代表,若没有观察到棕黄色颗粒,则将其标记为阴性,用符号“-”代表[7]。
阳性染色为胞浆(少数为胞浆和胞核)有细小棕色颗粒沉着,阴性切片中午棕色物质出现;阳性程度[8]按阳性细胞所占比例分为4级:0(-)、1%~30%(+)、31%~60%(++)、>60%(+++);无病生存期指首次化疗日期开始至出现局部复发和(或)远处转移的时间[9]。
1.3 观察指标
根据卵巢癌病理分为Ⅰ级(n=49)、Ⅱ级(n=40)、Ⅲ级(n=29),全部随访者98例根据淋巴结转移分为转移组(n=35)和无转移组(n=63),分析nm23-H1蛋白、N-cad表达阳性率与卵巢癌病理分级、淋巴结转移间的关系;以阳性++级及以上为高表达(nm23-H1高表达组,n=69;Ncad高表达组,n=34)、以阳性++级为低表达(nm23-H1低表达组,n=49;N-cad低表达组,n=84),比较临床病理特征之间的nm23-H1、N-cad表达差异和两组间的生存率。
1.4 统计学方法
采用SPSS19.0统计软件进行数据分析,计量资料以均数±标准差(±SD)表示,行t检验或单因素方差分析;计数资料以例或率(n(%))表示,行χ2检验或Fisher精确概率检验,P<0.05表示差异有统计学意义。
2 结果
2.1 卵巢癌组织及癌旁组织中nm23-H1、N-cad蛋白表达情况
118例卵巢癌组织中nm23-H1蛋白(见图1-①)阳性表达率为78.81%(93/118),其中-级25例、+级24例、++级37例、+++级32例;癌旁组织nm23-H1蛋白阳性表达率为91.53%(108/118),癌组织nm23-H1蛋白阳性表达率明显低于癌旁组织(χ2=7.548,P=0.006)。
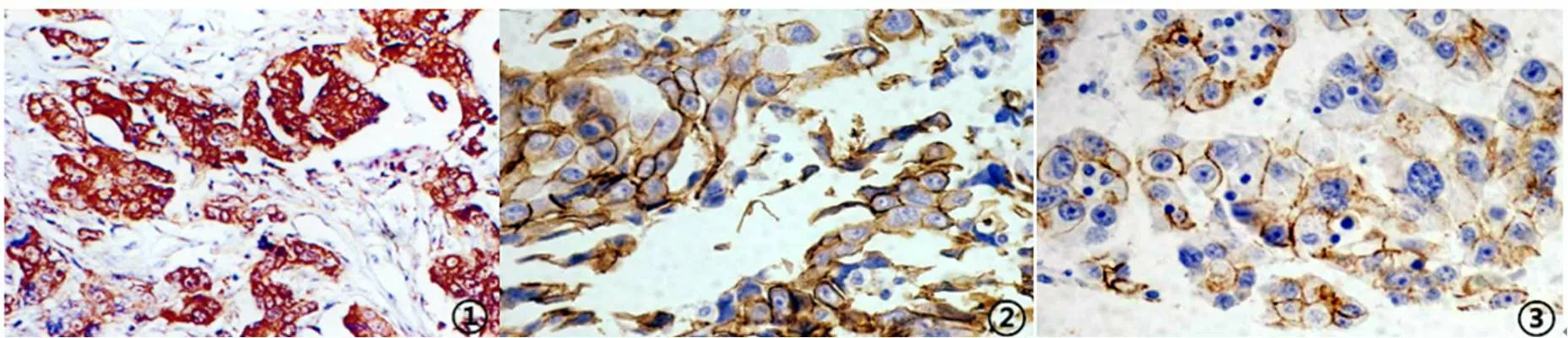
图1 代表性免疫组化图
N-cad蛋白(见图1-②)阳性表达率为38.98%(46/118),其中-级72例、+级11例、++级19例、+++级16例;癌旁组织N-cad阳性表达率16.10%(19/118),癌组织N-cad蛋白阳性表达率明显高于癌旁组织(χ2=15.479,P<0.0001)。
2.2 不同病理分级癌组织中nm23-H1和N-cad表达水平
Ⅰ级卵巢癌组织nm23-H1表达总阳性率最高,N-cad总阳性率最低(P<0.05),见表1和表2。

表1 不同病理分级癌组织中nm23-H1(n(%))

表2 不同病理分级癌组织中N-cad表达水平(n(%))
2.3 nm23-H1蛋白和N-cad表达与肿瘤转移的关系
随访40个月,获得全部随访资料者98例,失访率16.95%(20/118),其中转移者35例,无转移者63例;转移者nm23-H1表达阳性率低于无转移组(P<0.05),转移者N-cad表达阳性率(见图1)高于无转移组(P<0.05),见表3。
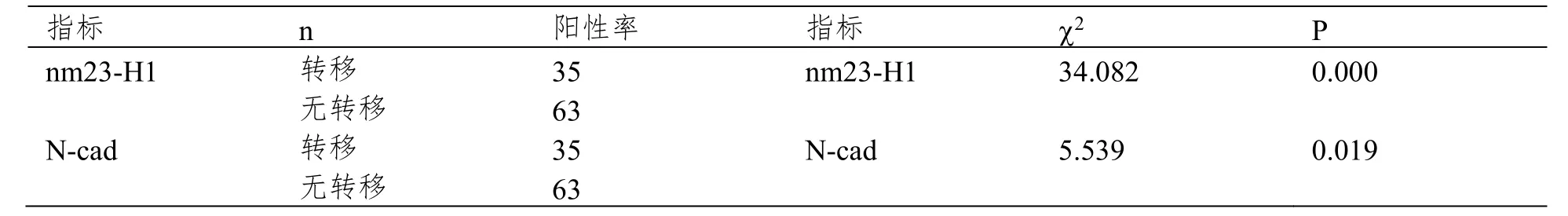
表3 nm23-H1和N-cad表达与肿瘤转移的关系
2.4 nm23-H1蛋白表达与卵巢癌临床病例特征关系
nm23-H1低表达组浆液型腺癌比例更高(P<0.05),nm23-H1低表达组和N-cad高表达组病理分级中Ⅲ级比例高、FIGO分期中Ⅲ~Ⅳ比例高(P<0.05),见表4和表5。
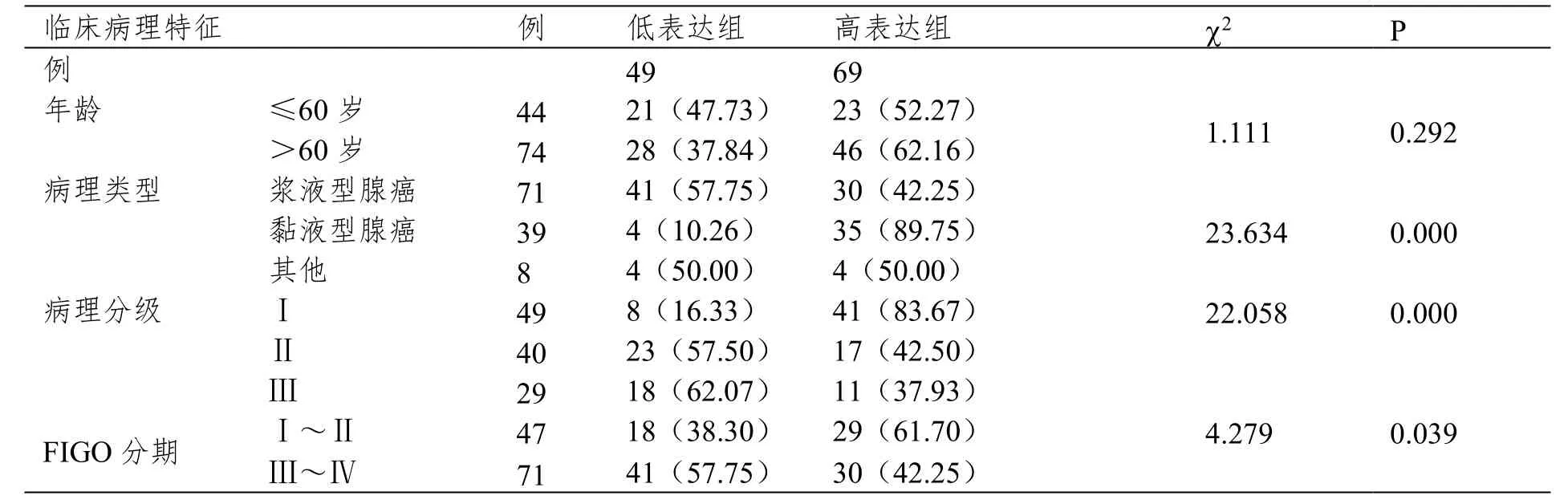
表4 nm23-H1蛋白表达与卵巢癌临床病理特征关系
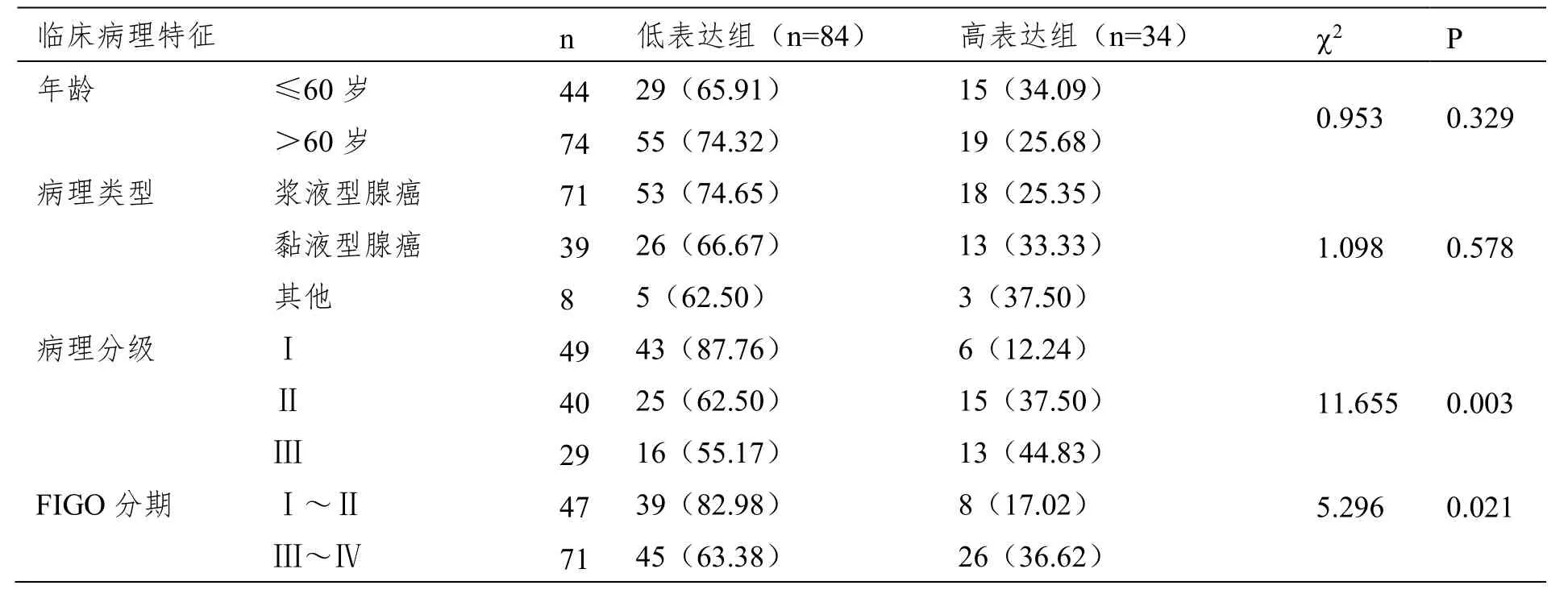
表5 N-cad蛋白表达与卵巢癌临床病理特征关系
2.5 生存分析
本文研究随访时间自首次化疗日期开始,末次随访日期为2018年4月,随访40个月。获得全部随访资料者98例,nm23-H1低表达组和N-cad高表达组3年生存率更低(P<0.05),见表4。
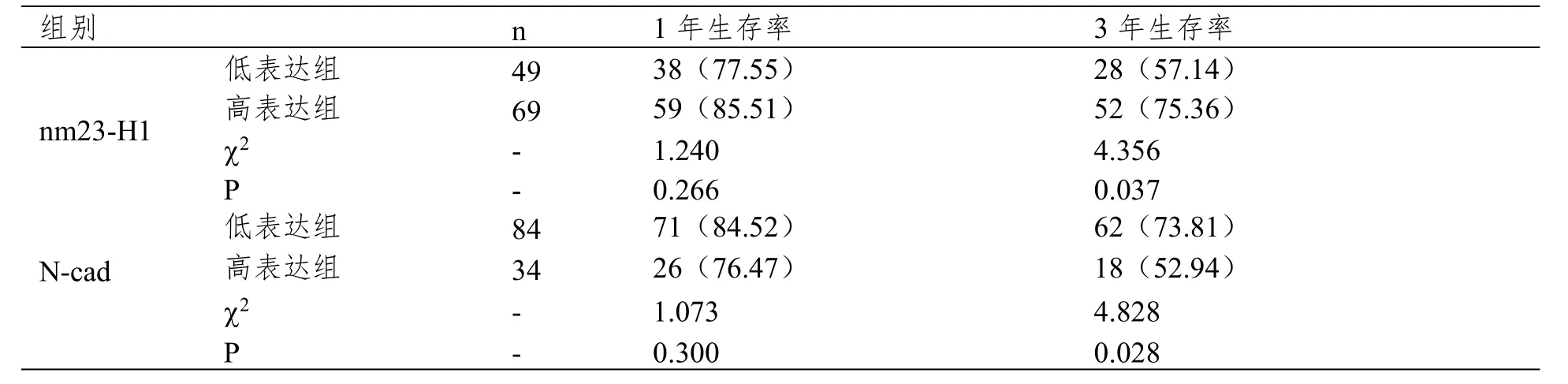
表5 nm23-H1和N-cad表达与生存率的关系
3 讨论
人类nm23基因位于17号染色体长臂,该基因编码具有二磷酸核苷激酶活性的蛋白质,对肿瘤的增殖、分化、侵袭及转移起重要作用[10]。研究表明,nm23基因编码的蛋白几乎存在于所有正常细胞中,而在高分化肿瘤细胞中的表达较高,在低分化及具有高度转移潜能的肿瘤细胞中不表达或仅有微弱表达[11]。
既往nm23基因家族研究较多,目前已知nm23基因家族包括H1~H10等10个基因,其中nm23-H1与肿瘤转移关系密切[12]。E-cad是一种钙依赖性跨膜糖蛋白,在细胞极化、细胞间黏附以及组织结构当中起到重要作用,E-cad的表达和分布异常与肿瘤细胞的去分化、侵袭、淋巴结转移等有关[13]。近年来研究发现N-cad在肿瘤发生进展中的相关作用[14]。但在卵巢癌组织中nm23-H1蛋白及N-cad表达水平的研究较少。
本研究结果显示,nm23-H1蛋白表达与卵巢肿瘤分化程度,卵巢癌病情进展相关。故nm23-H1的表达有利于维持细胞的正常分化,其高表达水平能够下调卵巢肿瘤细胞的生长速率。nm23抑制基因的两个重要作用分别是参与二磷酸鸟苷转化,排斥肿瘤细胞微管蛋白的聚合,影响细胞骨架状态以抑制肿瘤细胞移动;参与G蛋白调控的跨膜信息传递,阻断生长信号传导[15]。
基质金属蛋白酶是卵巢癌敏感性标志物,可通过调节细胞外基质和基底膜来影响肿瘤细胞的侵袭和扩散[16-17]。nm23-H1基因可正向调控基质金属蛋白酶抑制剂-1mRNA与蛋白表达,负向调控基质金属蛋白酶-9 mRNA与蛋白表达,从而改变细胞的黏附能力,最终抑制肿瘤生长、转移[18]。而N-cad在卵巢癌患者中的表达水平与肿瘤发生、病理分期明显相关,这说明N-cad高表达能促进细胞的去分化,增强肿瘤病情进展。由于高表达N-cad可促进肿瘤发生EMT,使相对静止的肿瘤细胞变为有运动能力的细胞[19],因此在肿瘤转移中也发挥重要作用。
本次结果显示,N-cad高表达确能使卵巢癌患者预后不良风险提高。
综上所述,卵巢癌组织中的nm23-H1蛋白及N-cad高表达均能影响肿瘤细胞分化、干扰临床病情进展,从而影响卵巢癌患者的生存期。

