外周血炎症指标水平对HER-2阳性乳腺癌患者预后的影响*
党少华 徐 敏 胡金月 孙永强
河南省郑州市第三人民医院 1 乳腺甲状腺外科 2 内分泌科 450000
人表皮生长因子受体2(Human epidermal growth factor receptor 2,HER-2)是一种存在于乳腺癌细胞表面的蛋白质,主要介导细胞的生长与分化,可导致乳腺癌细胞的增殖及恶性转化,是乳腺癌发生发展过程中重要的信号传导通道[1]。原发性乳腺癌中有15%~20%存在HER-2基因的扩增或过表达,HER-2阳性乳腺癌定义为激素受体(Hormone receptor, HR)阴性和HER-2阳性,HER-2阳性表达的乳腺癌患者较HER-2阴性表达的乳腺癌患者表现出更差的预后。目前,抗HER-2靶向的新辅助治疗(Neoadjuvant chemotherapy, NAC)被广泛用于治疗HER-2阳性的乳腺癌[2],可明显改善预后,提高病理完全缓解(pathological complete response,pCR)率。近年来研究发现外周血炎症免疫因子在多种恶性肿瘤的发生及发展过程中发挥了重要的作用,炎症反应通过改变肿瘤微环境,使其产生多种细胞因子及趋化因子加重肿瘤炎症反应,进而促进肿瘤的发生发展与转移[3]。中性粒细胞能促进肿瘤细胞增殖及血管生长,促使肿瘤发生转移,淋巴细胞则在抗肿瘤免疫发挥着重要的作用,是炎症反应中的关键免疫细胞[4],中性粒细胞/淋巴细胞比值(Neutrophilto lymphocyte ratio,NLR)代表炎症激活因子中性粒细胞与炎症调节因子淋巴细胞之间的平衡状态,NLR作为机体炎症反应最直观的生物标志物,可反映机体的炎症反应状态和免疫水平。多项研究证明[5-6]乳腺癌中系统性炎症反应被认为是预后不良的独立危险因素,且对乳腺癌复发及转移有预测价值。本研究收集HER-2阳性乳腺癌患者的临床资料,进行回顾性的分析,探讨外周血炎症指标对HER-2阳性乳腺癌NAC疗效预测及预后的关系,为评估HER-2阳性乳腺癌患者治疗的疗效和监测HER-2阳性乳腺癌患者预后提供临床证据。
1 对象与方法
1.1 对象 回顾性分析2012年1月—2018年1月于我院乳腺甲状腺外科接受新辅助化疗的85例HER-2阳性的乳腺癌患者的临床资料。所选对象均经空芯针穿刺活检及免疫组化学证实为HER-2阳性的乳腺癌,患者均为女性,年龄28~65岁,平均年龄(42.91±7.36)岁,病理类型均为浸润性癌。 纳入标准:(1)初诊,年龄≥18岁;(2)肿瘤分期为Ⅱ~Ⅲ;(3)免疫组化学检测为HER-2阳性;(4)行新辅助化疗。排除标准:(1)妊娠以及哺乳期者;(2)病理确诊结果为除浸润性乳腺癌之外的其他组织学分型者;(3)合并其他恶性肿瘤者;(4)术前影像学检查结果提示存在远处可疑转移;(5)存在严重肝、肾以及心脏功能不全者;(6)术前接受内分泌治疗或行局部放疗者。本研究经我院医学伦理委员会批准,所有患者均签署知情同意书,并自愿参加本研究。
1.2 检测方法 所有入组患者均于NAC前进行血液样本采集,通过血液分析仪Sysmex XS-800i (Sysmex公司,Japan)检测结果报告中提取外周血免疫炎症因子的指标信息,包括淋巴细胞计数、中性粒细胞计数及两者之间的比值。
1.3 治疗方案 根据患者个人意愿及经济条件选择是否接受曲妥珠单抗治疗。(1)TAC方案:多西他赛(江苏恒瑞医药股份有限公司,国药准字H20020543)75mg/m2;环磷酰胺(山西普德药业股份有限公司,国药准字H14023686)500mg/m2;吡柔比星(海正辉瑞制药有限公司,国药准字H20045983)50mg/m2,以上化疗药物均经静脉滴注,每21d为1个治疗周期,共4~6 个周期,每次入院第2天给予化疗药物。(2)TCH方案:曲妥珠单抗(上海罗氏制药有限公司,国药准字J20110020)首次8mg/kg,后续每次6mg/kg;多西他赛(江苏恒瑞医药股份有限公司,国药准字H20020543)75mg/m2,卡铂(齐鲁制药有限公司,国药准字H20020180)0.3g/m2,以上化疗药物均经静脉滴注,每21d为1个治疗周期,共6个周期,每次入院第2天给予化疗药物。NAC完成后接受手术,手术方式均为乳腺癌改良根治术。
1.4 病理诊断及病例随访 对本研究中的85例患者,采用电话、门诊复查、再次住院等方式进行随访调查,以首次确诊日为起点,失访和死亡发生日为终点,随访截至2019年12月。将手术日后初次发生远处转移或局部区域性复发定义为无病生存期(Disease-free survival,DFS)事件,若未发生复发转移,将以随访终点或死亡为截尾时间。将任何原因引起的死亡定义为总生存期(Overall survival, OS)事件,若未发生OS事件,以末次随访时间为截点。HER-2阳性评估标准:免疫组织化学结果显示:“+++”或“++”且荧光原位杂交(Fluorescent in situ hybridization,FISH)检测结果显示HER-2基因拷贝数扩增>2.0。腋窝淋巴结及乳腺原发病灶均无浸润性肿瘤细胞的残留定义为pCR。
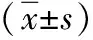
2 结果
2.1 外周血炎症指标的界值确定 85例HER-2阳性乳腺癌患者治疗前外周血中性粒细胞计数(NC)为(3.23±1.59)×109/L[范围(0.93~11.00)×109/L],根据ROC曲线结果显示,敏感度和特异度分别为0.676、0.874,最佳临界值为2.45×109/L(图1a),根据最佳临界值分为低中性粒细胞组(≤2.45×109/L)38例与高中性粒细胞组(>2.45×109/L)47例。85例HER-2阳性乳腺癌患者治疗前外周血淋巴细胞计数(LC)为(1.84±0.56)×109/L[范围(0.82~3.70)×109/L],根据ROC曲线结果显示,敏感度和特异度分别为0.627、0.748,最佳临界值为1.89×109/L(图1b),根据最佳临界值分为低淋巴细胞(≤1.89×109/L)57例与高淋巴细胞(>1.89×109/L)28例。85例HER-2阳性乳腺癌患者治疗前外周血中性粒细胞计数/淋巴细胞计数比值(NLR)为(2.32±1.25)(范围0.43~11.15),根据ROC曲线结果显示,敏感度为0.615、特异度为0.883,最佳临界值为2.06(图1c),根据最佳临界值分为低NLR(≤2.06)44例与高NLR(>2.06)41例。
2.2 85例HER-2阳性乳腺癌患者外周血炎症指标与pCR的相关性 治疗前NLR低的患者较NLR高的患者获得pCR率更高,差异具有统计学意义(P=0.038)。中性粒细胞计数、淋巴细胞计数则与病理完全缓解没有明显差异(P均>0.05)。见表1。

图1 外周血炎症指标ROC曲线图

表1 85例HER-2阳性乳腺癌患者外周血炎症指标与pCR的相关性[n(%)]
2.3 外周血中炎症指标对HER-2阳性乳腺癌预后的评估价值 85例HER-2阳性乳腺癌患者随访时间10~61个月,平均随访(39.75±4.31)个月。随访过程中14例患者出现局部复发或转移,由Kaplan-Meier生存分析显示,中性粒细胞(图2a)及淋巴细胞(图2b)与DFS无明显相关性(P=0.315、P=0.663),治疗前NLR低的患者较NLR高的患者获得更高的DFS(图2c),差异具有统计学意义(P=0.011)。但治疗前中性粒细胞(图3a)、淋巴细胞(图3b)及NLR(图3c)与OS均未见显著相关性(P均>0.05)。

图2 外周血炎症指标DFS Kaplan-Meier曲线图

图3 外周血炎症指标OS Kaplan-Meier曲线图
3 讨论
HER-2阳性是乳腺癌的一种亚型,约有20%的乳腺癌患者表现为HER-2基因的扩增或过表达,该亚型具有侵袭性强、预后差及易复发的特点[7]。近年来多项研究证明在乳腺癌的发生发展中炎症反应发挥着极其重要的作用,炎症反应通过改变肿瘤微环境,激活炎症反应通路,使其产生多种细胞因子与趋化因子加重肿瘤炎症反应,改变机体免疫细胞分化与发育,促进肿瘤的发生发展及转移[8]。目前多项研究表明,炎症微环境中的炎症标志物可以预测乳腺癌的进展与预后,炎症指标反应也可能是乳腺癌转归的一个重要标志,对临床病情评估及治疗策略制定有指导意义。
外周血中性粒细胞/淋巴细胞比值(NLR)作为机体炎症免疫反应的一项指标,可以反映出机体全身炎症反应及免疫状态,术前NLR已被证实与包括乳腺癌在内的多种肿瘤的预后相关。在乳腺癌中NLR升高刺激乳腺肿瘤血管生成,侵袭邻近组织和转移进展细胞因子分泌,进而抑制免疫细胞毒性发生抗肿瘤免疫反应,最终导致乳腺癌的发生与发展[9]。此外, NLR升高引起粒细胞集落刺激因子相关的中性粒细胞增多,淋巴细胞减少,导致肿瘤细胞发生免疫逃逸,为肿瘤细胞的增殖、侵袭、转移提供有利条件,增加了乳腺癌患者复发风险[10]。由此表明,免疫细胞在乳腺癌的发生与发展中发挥着重要的作用,全身炎症反应结果将反映在NCR比值增加中,NCR比值越高炎症反应越严重且机体的免疫抑制越强烈,因此通过观察乳腺癌患者NCR比值能间接地反映机体肿瘤相关的炎症免疫状态,能更好地预测乳腺癌患者的病情发展及预后情况。Krenn等[11]通过对762名乳腺癌患者的研究结果显示,治疗前评估的NLR最佳临界值>3时DFS存在明显相关性,表明最佳临界值NLR>3是乳腺癌患者DSF的一个独立危险因素,但与OS则无明显相关性。关于NLR最佳截点的选择,多项研究各不相同,本研究中通过ROC曲线选取NLR的最佳临界值2.06,兼顾敏感性(0.615)及特异性(0.883),结果发现治疗前外周血炎症指标与HER-2阳性乳腺癌不良预后因素密切相关,即治疗前NLR低的患者较NLR高的患者获得更高的DFS,差异具有统计学意义(P=0.011),该结果与既往的研究相似,表明NLR升高对HER-2阳性乳腺癌患者具有更强的预测性。
在乳腺癌抗HER-2治疗中无论是单靶治疗还是双靶治疗,患者均可在新辅助治疗后获得较好的pCR率, pCR提示了较好的临床结局[12]。然而,至今为止外周血炎症因子对乳腺癌患者NAC后pCR率的影响的报道较少,有研究表明[13],乳腺癌患者NAC前进行NLR检测,NLR水平较低者NAC后pCR率相对较高。本研究分析外周血炎症因子对HER-2阳性乳腺癌NAC后pCR率的影响,结果显示85例入组患者中,21例患者(24.7%)于NAC后获得pCR,进一步研究表明NLR低水平组的pCR率明显高于NLR高水平组(P<0.038),差异具有统计学意义,该结果与既往的研究结果相符,本研究中淋巴细胞计数与中性粒细胞计数与pCR率无明显相关性,NLR对pCR的影响可能与NLR对机体的高抗肿瘤免疫潜能有关,预示了机体对化疗药物的高应答,而NLR比值越高pCR率越低,预示着NAC疗效越差。
综上所述,HER-2阳性乳腺癌患者NAC前检测外周血炎症细胞计数可以预测患者的化疗敏感性及预后,该结果表明NAC前外周血NLR低的患者较NLR高的患者可明显获得更高的DFS与pCR率。本研究虽然提出NLR可以作为HER-2阳性乳腺癌患者NAC前的预测评价的指标,但笔者的样本量相对有限,且样本来源比较单一,因此具有一定的局限性,NLR最佳临界值目前还没有确定统一的标准,不同样本NLR最佳临界值也尽不相同,仍需结合临床应用以及与传统疗效评价方式进行进一步的验证。

