狗脊多糖通过miR-181c调控IL-1β介导的骨关节炎软骨细胞增殖和凋亡
孙群周 (河南省洛阳正骨医院 河南省骨科医院综合骨一科,河南 洛阳 471000)
骨关节炎(OA)是一种常见的关节退行性疾病,临床表现多为关节软骨退化、骨刺形成、关节间隙变窄等,同时伴随关节畸形、僵硬、肿胀、疼痛等症状,多发于中老年人〔1〕。普遍认为,衰老、遗传、肥胖、炎症和关节损伤是OA发病的主要原因,但其发病机制目前尚未明确〔2,3〕。随着人口老龄化的加剧,OA发病率呈上升趋势,严重影响患者生活质量,同时给患者及其家庭、社会造成了经济负担〔4〕。OA的临床治疗以非甾体类抗炎药、透明质酸注射等药物治疗及关节置换术、软骨修复术等手术治疗为主,用以抗炎和减轻疼痛,至今没有根治之法〔5〕。报道指出,中药能够减轻患者疼痛、抑制炎症反应、改善关节功能,从而延缓OA进程〔6〕。多糖是一类由超过10个单糖通过糖苷键聚合而成的高分子糖类物质,是多种中药材的主要活性成分之一,具有抗氧化、抗菌消炎、降血糖、促进免疫调节等药理作用,可用于神经退行性疾病、肿瘤等多种疾病的治疗〔7~9〕。研究表明,狗脊多糖(CBPS)能够通过促进细胞周期刺激软骨细胞增殖〔10〕。本研究通过检测CBPS对白细胞介素(IL)-1β诱导的软骨细胞增殖和凋亡及细胞中相关蛋白表达的影响,探讨其干预OA的潜在作用机制。
1 材料与方法
1.1材料 OA软骨组织来源于河南省洛阳正骨医院骨关节炎置换患者,手术经患者知情同意。胎牛血清(批号:10099-141)、DMEM培养基(批号:31053028)、胰蛋白酶(批号:20230)、pcDNA 3.1(批号:K480001)购自美国Thermo Fisher公司;Trizol试剂(批号:15596)、聚偏氟乙烯(PVDF)膜(批号:BSP0161)、电化学发光(ECL)液(批号:PE0030)、RIPA裂解液(批号:R0020)、二甲基亚砜(DMSO,批号:D8370)、Ⅱ型胶原蛋白酶(批号:C8150)购自北京Solarbio公司;噻唑蓝(MTT,批号:M2129)、PI(批号:D4543)购自美国Sigma公司;Annexin V-FITC凋亡检测试剂盒(批号:170207)购自美国Coulter公司;TaKaRa反转录试剂盒(批号:RR047A)、TaKaRa实时荧光定量试剂盒(批号:RR820A)购自宝生物工程(大连)有限公司;兔抗肿瘤坏死因子(TNF)-α(批号:ab6671)、金属蛋白酶组织抑制剂(TIMP)-1(批号:ab38978)、基质金属蛋白酶(MMP)-13(批号:ab39012)、β-actin(批号:ab8227)多克隆抗体和辣根过氧化物酶标记(HRP)标记的山羊抗兔IgG(批号:ab6721)购自美国Abcam公司;control mimics、miR-181c mimics、control inhibitors、miR-181c inhibitors购自美国Invitrogen公司;MCO-18AC型CO2培养箱购自日本SANYO公司;CFX96 Touch TM荧光定量聚合酶链式反应(PCR)检测系统、ChemiDoc TM MP凝胶成像系统购自美国Bio-Rad公司;Nanodrop ND-2000超微量核酸蛋白测定仪购自上海创萌生物科技有限公司;HBS-1096B型酶标仪购自南京德铁实验设备公司。
1.2OA软骨细胞的分离培养 将获得的OA软骨组织放入含100 U/ml青霉素和100 μg/ml链霉素的D-Hanks液中,无菌条件下刮除关节周围附着组织并清洗软骨组织,使用眼科剪剪碎组织;2.5 g/L胰蛋白酶消化30 min后弃去培养基,加入2 g/LⅡ型胶原蛋白酶(使用含100 ml/L胎牛血清的DMEM培养基稀释),置于37℃、CO2培养箱中孵育;待软骨组织基本完全消化,培养基变混浊收集培养基,轻轻吹打后4℃、800 r/min离心5 min,弃上清;洗涤后,使用含100 ml/L胎牛血清的DMEM培养基于37℃、CO2条件下培养。每隔2 d 更换新鲜培养基,细胞汇合度约85%时进行传代,取第2代软骨细胞用于后续实验。
1.3实验分组 将OA软骨细胞以1×104个/孔接种于96孔板,随机分为Control组、IL-1β组、miR-con组、miR-181c组、IL-1β+miR-con组、IL-1β+miR-181c组、IL-1β+PBS组、IL-1β+CBPS组、磷酸盐缓冲液(PBS)组、CBPS组、CBPS+anti-miR-con组、CBPS+anti-miR-181c组,每组6个复孔。处理方法:Control组:未做处理的细胞常规培养;IL-1β组:在细胞培养液中加入IL-1β并调整终浓度为10 ng/ml;miR-con组:转染control mimics的细胞;miR-181c组:转染miR-181c mimics的细胞;IL-1β+miR-con组:转染control mimics的细胞使用含10 ng/ml IL-1β的培养基培养;IL-1β+miR-181c组:转染miR-181c mimics的细胞使用含10 ng/ml IL-1β的培养基培养;IL-1β+CBPS组:使用含终浓度为10 ng/ml IL-1β和200 μg/ml CBPS的培养基培养;IL-1β+PBS组:在含终浓度为10 ng/ml IL-1β的培养基中加入与CBPS等量的PBS进行培养;CBPS组:使用含200 μg/ml CBPS的培养基培养;PBS组:在培养基中加入与CBPS等量的PBS进行培养;CBPS+anti-miR-con组:转染control inhibitors的细胞使用含终浓度为10 ng/ml IL-1β和200 μg/ml CBPS的培养基培养;CBPS+anti-miR-181c组:转染miR-181c inhibitors的细胞使用含终浓度为10 ng/ml IL-1β和200 μg/ml CBPS的培养基培养;CBPS浓度参考文献〔11〕。
转染方法:接种至96孔板的软骨细胞生长至融合度约45%时,使用LipofectamineTM2000转染试剂说明书,将稀释好的control mimics、miR-181c mimics、control inhibitors、miR-181c inhibitors分别与Lipofectamine 2000混合并加入到96孔板中,孵育6 h后更换为含10%胎牛血清的DMEM培养基。
1.4qRT-PCR 收集Control组、IL-1β组、IL-1β+PBS组、IL-1β+CBPS组细胞,Trizol法提取总RNA。检测RNA浓度和纯度,使用TaKaRa反转录试剂盒将RNA反转录为cDNA,TaKaRa荧光定量试剂盒配制反应体系,以β-actin为内参,置于实时荧光定量仪上进行PCR扩增。每个RNA样品重复3次,mRNA相对表达量的计算采用2-△△Ct法。β-actin引物:上游:5′-AGTGTGACGTGGACATCCGCAA AG-3′,下游:5′-ATCCACATCTGCTGGAAGGTGGAC-3′;miR-181c引物:上游:5′-AACATTCAACCTGTCGGTGAGT-3′,下游:5′-GCAACATTCAACCTGTCGG-TG-3′。
1.5MTT 分别在Control组、IL-1β组、IL-1β+miR-con组、IL-1β+miR-181c组、IL-1β+PBS组、IL-1β+CBPS组、PBS组、CBPS组、CBPS+anti-miR-con组、CBPS+anti-miR-181c组培养24 h、48 h、72 h时,每孔加入20 μl浓度为5 mg/ml的MTT继续孵育4 h;弃去多余培养基并加入150 μl DMSO振荡反应10 min,酶标仪检测490 nm处吸光度(OD)值。
1.6细胞凋亡检测 取生长状态良好的IL-1β+miR-con组、IL-1β+miR-181c组、IL-1β+PBS组、IL-1β+CBPS组、PBS组、CBPS组、CBPS+anti-miR-con组、CBPS+anti-miR-181c组细胞,胰酶消化后4℃、300 g离心收集。按照Annexin V-FITC/PI细胞凋亡检测试剂盒说明书,分别加入5 μl Annexin V-FITC和10 μl PI,轻轻混匀后室温避光孵育15 min,流式细胞仪检测细胞凋亡。
1.7Western印迹 收集PBS组、CBPS组、CBPS+anti-miR-con组、CBPS+anti-miR-181c组细胞,中加入RIPA裂解液裂解后,4℃,12 000 r/min离心20 min,收集上清液。将蛋白样品进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)后转至PVDF
膜上,5%脱脂奶粉封闭液室温封闭1 h。分别加入兔抗TNF-α(1∶500)、TIMP-1(1∶1 000)、MMP-13(1∶5 000)和β-actin(1∶1 000)多克隆抗体4℃孵育过夜,TBST洗膜3次,每次10 min;加入HRP标记的山羊抗兔IgG(1∶5 000)室温孵育2 h,TBST洗涤;ECL发光显影,每个蛋白样品重复3次。
1.8统计学方法 采用SPSS22.0软件进行t检验、单因素方差分析。
2 结 果
2.1IL-1β抑制软骨细胞中miR-181c表达 经IL-1β组miR-181c表达水平(0.41±0.06)明显低于Control组(1.00±0.14,t=6.709,P=0.000)。
2.2过表达miR-181c抑制IL-1β对软骨细胞增殖的抑制和凋亡的促进作用 IL-1β组48 h及72 h细胞活力均明显低于Control组,而细胞凋亡率明显高于Control组(均P<0.05);miR-181c组miR-181c表达水平(4.72±0.35)明显高于miR-con组(1.06±0.12,P<0.05)。见图1、表1。
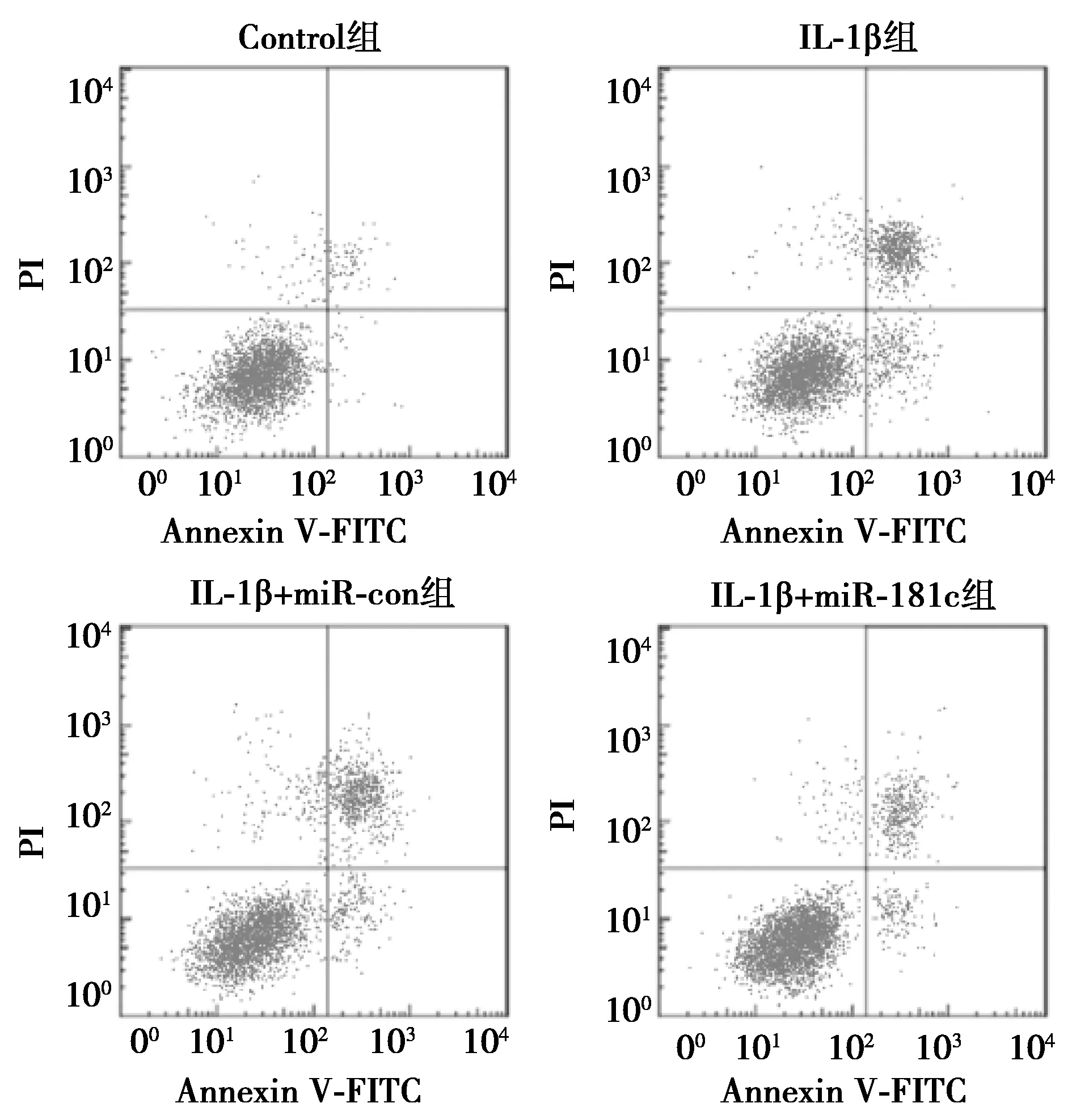
图1 流式细胞术检测软骨细胞凋亡

组别细胞活力(OD490)24 h48 h72 h细胞凋亡率(%)Control组0.28±0.030.58±0.050.86±0.084.44±0.38IL-1β组0.25±0.040.32±0.031)0.52±0.051)32.06±1.861)IL-1β+miR-con组0.26±0.030.33±0.030.51±0.0634.26±2.06IL-1β+miR-181c组0.27±0.040.49±0.062)0.70±0.062)15.35±1.052)F/P值0.400/0.75724.405/0.00020.640/0.000269.581/0.000
2.3CBPS可逆转IL-1β对软骨细胞中miR-181c表达的抑制作用 与Control组(1.00±0.08)相比,IL-1β组miR-181c表达水平(0.35±0.05)显著降低(P<0.05),IL-1β+miR-181c组miR-181c表达水平(0.81±0.11)明显高于IL-1β+miR-con(0.38±0.07,P<0.05),基本恢复至正常水平。
2.4CBPS联合IL-1β对软骨细胞增殖和凋亡的影响 IL-1β组48 h及72 h细胞活力均明显低于Control组,而细胞凋亡率均明显高于Control组(均P<0.05);IL-1β+CBPS组48 h及72 h细胞活力均明显高于IL-1β+PBS组,而细胞凋亡率均明显低于IL-1β+PBS组(均P<0.05)。见表2。

表2 miR-181c和IL-1β对软骨细胞活力和诱导细胞凋亡
2.5下调miR-181c表达抑制CBPS和IL-1β诱导的软骨细胞增殖和凋亡 IL-1β+CBPS组48 h、72 h细胞活力显著高于IL-1β+PBS组,细胞凋亡率显著低于IL-1β+PBS组(P<0.05);IL-1β+CBPS+anti-miR-181c组48 h、72 h细胞活力显著低于IL-1β+CBPS+anti-miR-con组,细胞凋亡率显著高于IL-1β+CBPS+anti-miR-con组(P<0.05)。见表3。

组别细胞活力(OD490)24 h48 h72 h凋亡率(%)TNF-αTIMP-1MMP-13IL-1β+PBS组0.26±0.030.31±0.030.51±0.0532.16±2.880.57±0.050.62±0.040.72±0.06IL-1β+CBPS组0.28±0.030.53±0.041)0.72±0.061)13.25±1.451)0.21±0.031)1.31±0.081)0.32±0.041)IL-1β+CBPS+anti-miR-con组0.27±0.040.56±0.050.74±0.0511.87±1.810.18±0.041.34±0.070.30±0.04IL-1β+CBPS+anti-miR-181c组0.25±0.030.40±0.042)0.62±0.042)20.58±2.652)0.48±0.072)0.71±0.052)0.44±0.062)F值0.46524.60620.28852.55245.818114.31243.192P值0.7150.0000.0000.0000.0000.0000.000
2.6miR-181c和CBPS对IL-1β介导的软骨细胞TNF-α、TIMP-1和MMP-13水平的影响 IL-1β+CBPS组TNF-α及MMP-13水平明显低于IL-1β+PBS组,而TIMP-1水平明显高于IL-1β+PBS组(均P<0.05);IL-1β+CBPS+anti-miR-181c组TNF-α及MMP-13水平均明显高于IL-1β+CBPS+anti-miR-con组,而TIMP-1水平明显低于IL-1β+CBPS+anti-miR-con组(均P<0.05)。见表3、图2。
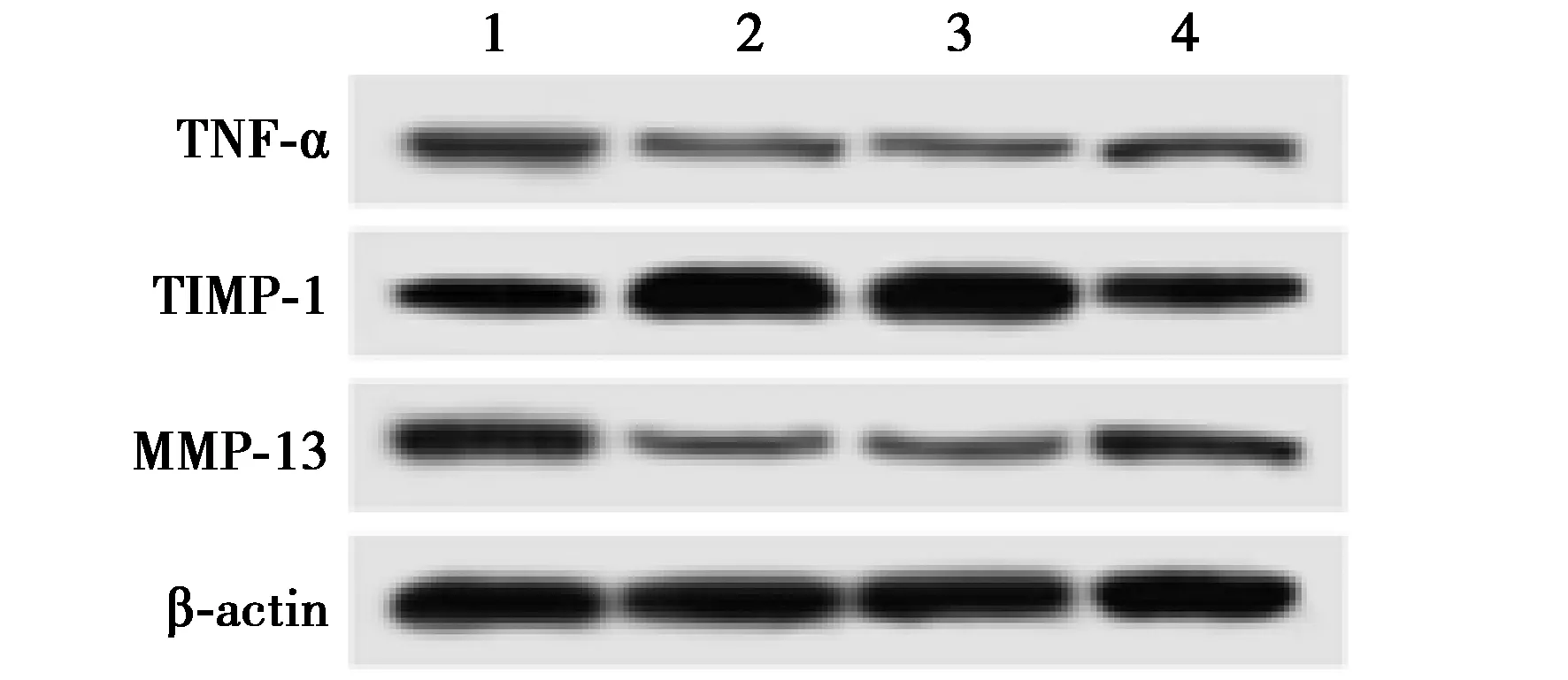
1~4:IL-1β+PBS组、:IL-1β+CBPS组、:IL-1β+CBPS+anti-miR-con组、:IL-1β+CBPS+anti-miR-181c组图2 Western印迹检测软骨细胞TNF-α、TIMP-1和MMP-13水平的影响
3 讨 论
中药狗脊是蚌壳蕨科金毛狗属植物金毛狗脊的干燥根茎,其性温,味苦,包含皂苷类、黄酮类、酚酸类、糖及糖苷类、挥发油类等多种化学成分,广泛应用于手足麻木、腰腿酸痛、偏瘫等症的临床治疗〔12〕。据报道,CBPS能够通过改善血液循环降低骨内压;提高超氧化物歧化酶(SOD)活性并降低氧自由基含量,从而发挥抗氧化作用;促进G1/S周期转化而加快软骨细胞增殖,已广泛应用于OA的预防及治疗〔13〕。而CBPS已被证实能够通过上调细胞周期依赖性蛋白激酶和细胞周期蛋白D水平,加速细胞从G1向S期转变,从而促进软骨细胞增殖〔10〕。此外,付长龙等〔11〕研究发现,CBPS可有效降低软骨细胞液中丙二醛(MDA)和一氧化氮(NO)含量,同时上调SOD表达,具有抗氧化作用。
miRNA是一类长度19~22 nt的内源性非编码RNA分子,能够通过与靶mRNA 3′UTR区互补序列特异性结合使其降解或抑制其翻译过程,从而调节多种基因表达,参与调控细胞的生长分化、凋亡和机体炎症反应、免疫应答等过程〔14〕。多项研究表明,miRNA能够调节IL-1β、TNF-α、MMP-13等的分泌,促进或抑制OA发展〔15~17〕。TNF-α是由单核细胞和巨噬细胞分泌的细胞因子,可刺激IL-33分泌,从而增加IL-6水平,促进炎症反应〔18〕。MMP-13是MMP家族中的重要成员,能够通过调节细胞外基质参与胶原的形成,而软骨的细胞外基质主要由胶原、蛋白聚糖和水组成,MMP-13则通过降解Ⅱ型胶原破坏软骨组织,加速OA进程〔19,20〕。
人miR-181由miR-181a、miR-181b、miR-181c、miR-181d 4个高度保守的成员组成,在巨噬细胞、单核细胞中具有介导抗炎的功能,并且能够调节T细胞发育和B细胞分化,参与炎症和免疫反应〔21,22〕。其中,miR-181c在OA组织中表达下调,miR-181c异位表达能够显著降低MMP-13、IL-6和IL-8水平和滑膜细胞的过度增殖,发挥抗炎作用〔23〕;并且能够通过降低IL-1β和TNF-α水平,减轻烧伤诱导的炎症反应〔24〕。TIMP-1是一种具有MMP活性抑制作用的多功能因子,对除MMP-14、MMP-16、MMP-19和MMP-24外的MMP具有明显的抑制作用〔25〕。本研究结果提示miR-181c与OA炎症反应有关。在IL-1β干预条件下,下调软骨细胞中miR-181c表达能够逆转200 μg/ml CBPs对细胞增殖的促进和凋亡的抑制作用,并恢复细胞中TNF-α、TIMP-1和MMP-13蛋白表达水平。

