Ⅰ号液在MEMS晶圆级封装中的应用研究
李胜利, 黄 立, 马占锋, 高健飞, 王春水
(武汉高芯科技有限公司,湖北 武汉 430000)
0 引 言
微机电系统(micro-electro-mechanical system,MEMS)[1]的核心功能是将温度、湿度、压力等物理信号转换为电信号[2]以实现特定的功能。因此,MEMS器件一般由微悬臂、微孔、微通道、微腔等一系列感知外界环境变量的结构组成。由于这些结构极其精细,需要封装在真空环境中以免受外界环境的干扰。目前MEMS器件主要有金属封装、陶瓷封装和晶圆级封装三种封装形式[3]。与金属封装和陶瓷封装不同,晶圆级封装不需要将晶圆分割为数百个独立芯片,而是同时对晶圆上的所有芯片进行操作,因此晶圆级封装具有效率高、成本低的特点。
晶圆级封装常采用硅/硅直接键合、硅/玻璃静电键合、金属焊料键合和金属热压键合四种方式键合[4,5]。不论是金属焊料键合,还是金属热压键合,键合前都需要制备出金属化的键合环。键合环金属化的过程通常是先溅射一层Ti作为粘附层,然后通过光刻和电镀在Ti粘附层上生长焊料层,最后再采用湿法腐蚀去除Ti粘附层。Ti的湿法腐蚀通常需要用到氢氟酸,而氢氟酸对人体和环境都有较大伤害作用。有研究表明[6~8],碱性H2O2溶液可以腐蚀Ti,其机理在于碱性条件下H2O2电离出的OOH-离子可以直接与Ti反应,生成具有较强溶解性的Ti(OH)2O2。碱性H2O2体系中,Ⅰ号液(H2O2,NH3·H2O和H2O的混合物)具有独特的理化性能,广泛应用于半导体清洗领域。
本文主要研究了MEMS晶圆级封装Ti粘附层在Ⅰ号液中的腐蚀特性。
1 实验设计
1.1 药液配制
碱性条件下H2O2易分解,其室温下半衰期仅为11 h。为了保证Ⅰ号液的腐蚀能力,实验所使用的工艺温度为常温且需现配现用。实验所用NH3·H2O和H2O2的厂家均为江阴化学试剂厂有限公司,纯度均为CMOSⅢ级,其中NH3·H2O含量为29.0±1.0 %,H2O2含量为31.0±1.0 %。实验所用设备为美国SSEC公司,型号为M3300,其配液原理示意图如图1所示,NH3·H2O,H2O2和H2O的管路中各有一个流量计,设备自动按设定的比例配制溶液。
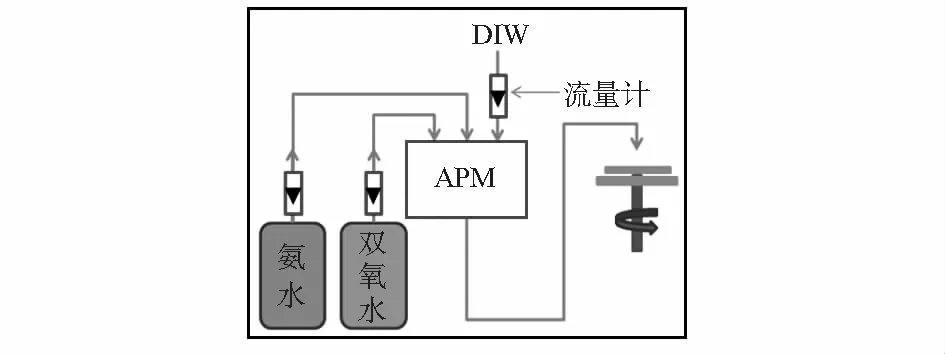
图1 Ⅰ号液配液原理示意
1.2 样片制备
1)衬底片制备:通过化学气相沉积(chemical vapor deposition,CVD)在8in(1in=2.54 cm)晶圆上淀积8 000×0.1 nm的SiO2。
2)Ti样片制备:通过物理气相沉积(physical vapor deposition,PVD)在上述衬底片上溅射450 nm的Ti薄膜。
1.3 实验过程
首先按不同的比例配制好Ⅰ号液;然后设备通过摆臂将配好的溶液以常压的形式喷洒到旋转的晶圆上进行Ti腐蚀(其中摆臂扫描幅度为整个晶圆,晶圆转速为300 r/min);腐蚀完成后用DI水冲洗干净并高速旋转甩干;最后用Therma wave公司的OPTI PROBE OP5240测量Ti腐蚀前、后的厚度,取49点平均值。
2 结果与分析
2.1 H2O2含量对Ti腐蚀速率的影响
在溶液总体积一定的条件下,研究了H2O2含量对Ti腐蚀速率的影响。这里规定H2O2和NH3·H2O体积比为X︰1,其中X=0.5,1,2,3,依次对应H2O2的体积分数为3.36 %,6.72 %,13.44 %和20.16 %。图2给出了不同H2O2含量X下Ti的腐蚀速率曲线。如图2所示,Ti的腐蚀速率随H2O2含量的增加而增大。这一现象可以从Ti在碱性H2O2体系中的反应机理得到解释[6]:1)H2O2电离过程:H2O2+OH-H2O+OOH-;2)Ti溶解过程:Ti+OOH-+3OH-Ti(OH)2O2+H2O+4e-。H2O2浓度增加有利于其电离过程向右移动,电离出更多的OOH-离子,而OOH-离子是腐蚀Ti的有效成分[7~9]。因此,Ti的腐蚀速率与H2O2的含量成正比关系。
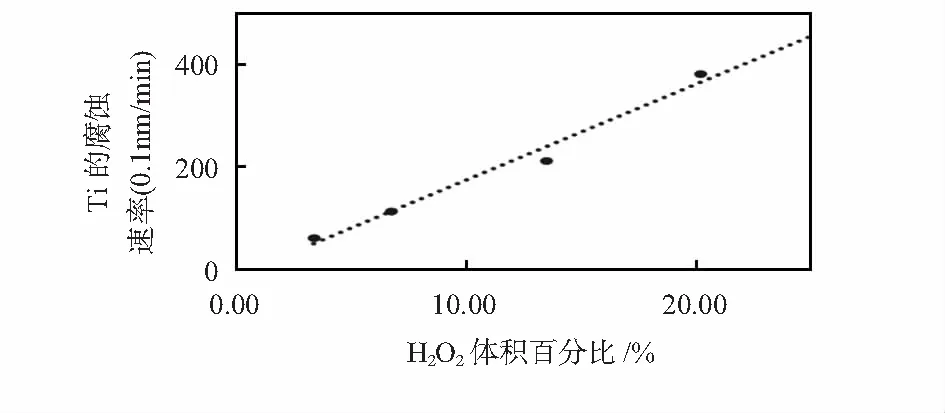
图2 H2O2含量对Ti腐蚀速率的影响
2.2 NH3·H2O含量对Ti腐蚀速率的影响
类似地,在溶液总体积一定的条件下,研究了NH3·H2O的含量对Ti腐蚀速率的影响。规定NH3·H2O和H2O2体积比为Y︰1,其中Y=0.5,1,2,3,依次对应NH3·H2O体积分数为:3.36 %,6.72 %,13.44 %和20.16 %。Ti的腐蚀速率随NH3·H2O含量Y变化的关系曲线如图3所示。从图3可以看出,Ti的腐蚀速率随NH3·H2O含量的增加而缓慢减小。这是因为NH3·H2O的浓度增加会促进H2O2的电离与分解,降低H2O2的浓度;而H2O2浓度的减小又会导致Ti(OH)2O2+ 2H2OTi(OH)4+ H2O2向右移动,促使亚稳态、溶解性较强的Ti(OH)2O2生成难溶的Ti(OH)4或氧化物沉淀[9],这些难溶物附着在Ti表面阻碍了反应的进行。

图3 NH3·H2O含量对Ti腐蚀速率的影响
2.3 Ⅰ号液放置时间对Ti腐蚀速率的影响
在NH3·H2O和H2O2体积比为3︰1,对应NH3·H2O的体积分数为20.16 %的条件下研究了溶液放置时间对Ti腐蚀速率的影响,结果如图4所示。由图4可知,溶液的放置时间越长,Ti的腐蚀速率越小。这是因为碱性条件下H2O2极易分解[10],致使H2O2浓度下降,最终导致Ti腐蚀速率减小。
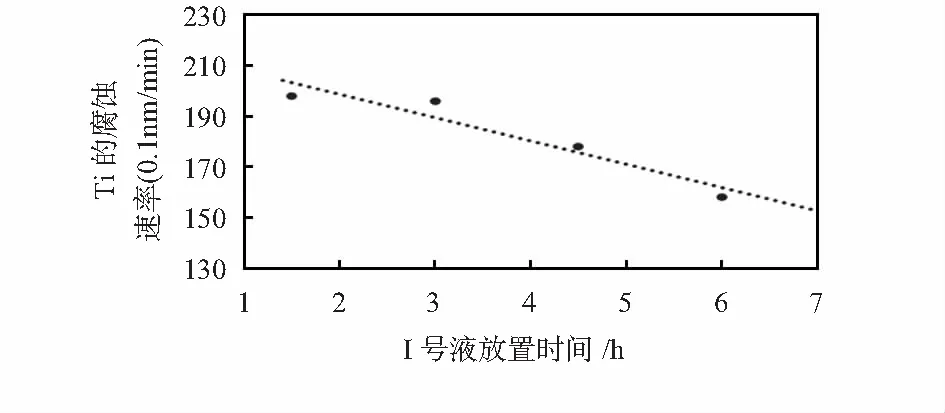
图4 Ⅰ号液放置时间对Ti腐蚀速率的影响
2.4 Ti的腐蚀过程研究
在NH3·H2O和H2O2体积比为3︰1,对应NH3·H2O的体积分数为20.16 %的条件下研究了Ti的腐蚀过程。先将同一批次的Ti样片分别用Ⅰ号液处理5,15,30,45,60 s,然后测量处理前、后Ti厚度的变化值,其结果如图5所示。
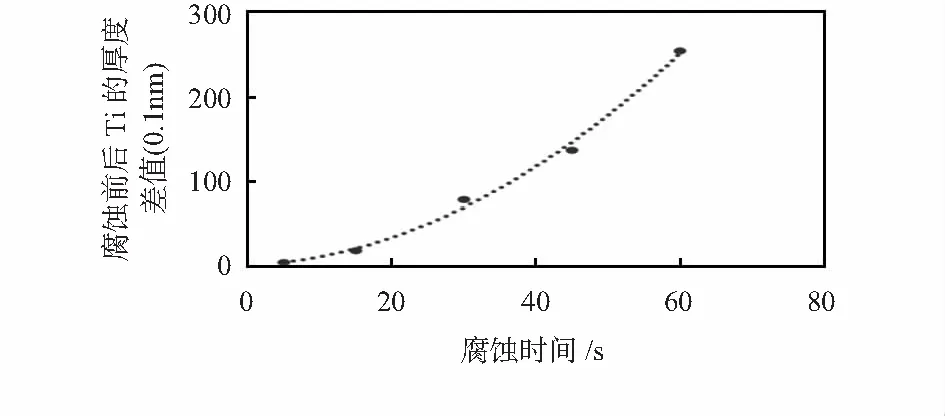
图5 Ti在Ⅰ号液中的腐蚀过程
3 结 论
本文研究了Ti在Ⅰ号液中的腐蚀特性,研究表明:
1)Ti的腐蚀速率正比于H2O2含量,其机理在于溶液中OOH-离子的浓度随H2O2含量的增加而增大,而OOH-离子是腐蚀Ti的有效基团。因此,实际生产过程中可以适当提高H2O2的比例,使Ⅰ号液对Ti有足够的腐蚀效率。
2)Ti的腐蚀速率随NH3·H2O含量的增加而缓慢减小。这是由于NH3·H2O促进了H2O2的分解与电离,降低了H2O2浓度,促使亚稳态、溶解性较强的Ti(OH)2O2向难溶的Ti(OH)4或氧化物沉淀转变。这些难溶物附着在Ti表面阻碍了反应的进行。因此,需要合理控制Ⅰ号液中NH3·H2O的比例,以减少H2O2的分解和难溶副产物的生成。
3)Ⅰ号液中H2O2存在不断电离并逐步衰减的过程,表现为Ti的腐蚀速率随着Ⅰ号液放置时间的延长而降低。因此,Ⅰ号液最好现配现用。
4)Ti被腐蚀掉的厚度与处理时间并非成线性关系:Ti表面极易钝化形成一层致密的氧化膜,使Ti具有较强的耐腐蚀性,刚开始时腐蚀速率自然较慢;而Ti被 H2O2氧化所形成的氧化膜却比较疏松且存在大量缺陷,使得Ti的氧化和溶解同时进行[11],Ti的腐蚀速率明显加快。因此,实际生产过程中应充分考虑Ti自然氧化层的存在,合理控制工艺时间以避免Ti残留或过腐蚀问题。

