BRCA1多态性与晚期胃癌铂类化疗敏感性及预后关系*
余玲玲,奉林,张允,张怀,许丽华,赵万
215153江苏 苏州, 南京医科大学附属苏州科技城医院 肿瘤科
胃癌是全世界第4大常见肿瘤,病死率高,在全球肿瘤患者和我国肿瘤患者死亡人数中胃癌分别居第4位、第3位。尽管近年来我国胃癌发病率呈现下降趋势,但我国仍是胃癌高发国家,每年新发病例约占全球胃癌总数的一半[1]。我国胃癌在诊断时,多数患者已经处于中晚期。所有胃癌患者中约30%伴有远处转移[2],这部分患者的5年生存率不足10%[3]。对于晚期转移性胃癌,化疗是主要的治疗手段,但患者对化疗的反应性存在明显差异[4],总体客观缓解率仅有30%~40%,肿瘤耐药是导致化疗失败的主要原因。因此,寻找与胃癌化疗疗效相关的分子靶点是临床亟待解决的问题。
乳腺癌易感基因1(breast cancer susceptibility gene 1,BRCA1)为具有遗传倾向的乳腺癌和卵巢癌的易感基因。该基因编码BRCA1蛋白,在细胞周期监控、DNA损伤修复过程中具有重要作用[5]。近来有研究显示,BRCA1在非小细胞肺癌化疗耐药细胞中过度表达,且下调BRCA1表达水平能明显抑制肿瘤细胞的增殖,逆转耐药[6]。同样,Kim等[7]对胃癌细胞系进行研究,发现悬浮的胃癌细胞株中BRCA1蛋白水平与顺铂抵抗相关性强(r2=0.743,P=0.027),而与奥沙利铂抵抗无显著关联(r2=0.080,P=0.586);在贴壁的胃癌细胞株中BRCA1蛋白高表达预示对顺铂(r2=0.773,P=0.004)和奥沙利铂(r2=0.944,P<0.001)抵抗性增强,提示BRCA1可能是预测胃癌铂类治疗敏感性的标志物。
研究发现BRCA1基因单核苷酸多态性(single nucleotide polymorphism,SNP)能改变BRCA1蛋白的生物学功能[8-9],进而影响乳腺癌[10-11]、卵巢癌[12-13]、前列腺癌[14]、胶质母细胞瘤[15]、子宫内膜癌[16]的发病风险。然而,当前BRCA1多态性与肿瘤化疗疗效、预后之间的关系仍不清楚。因此,本研究旨在评估BRCA1基因rs8176318G/T、rs799917C/T和rs1799966T/C多态性对接受奥沙利铂(oxaliplatin,L-OHP)联合卡培他滨(capecitabine,CAPE)方案化疗的晚期胃癌患者的化疗反应及总生存期(overall survival,OS)的影响。
1 对象与方法
1.1 研究对象
收集2016年5月至2020年3月苏州科技城医院肿瘤科接受L-OHP联合CAPE化疗的153例初治晚期转移性胃癌患者,中位年龄58岁,均为汉族人。纳入标准:1)经病理学确诊的初治胃癌患者,且伴有远处转移;2)CT扫描具有可测量评价的肿瘤病灶;3)ECOG评分<2分;4)化疗前心电图、血常规、生化正常;5)预期寿命大于3个月。排除标准:1)既往曾接受过抗肿瘤治疗,如手术、放疗、化疗等;2)存在第二原发肿瘤;3)有肿瘤家族史。本研究遵循国家人类基因组研究伦理准则进行,所有受试者均自愿参加研究并签署知情同意书,本研究获得苏州科技城医院伦理委员会批准。
1.2 化疗方案及评价标准
以L-OHP联合CAPE的方案化疗,化疗剂量:L-OHP 130 mg/m2,静滴,第1天;CAPE 1 000 mg/m2,口服,一天两次,第1~14天,21天为1个化疗周期,2周期化疗后行CT评估疗效,根据RECIST1.1实体瘤疗效评定标准分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、稳定(stable disease,SD)、进展(progressive disease,PD)。CR及PR判为化疗敏感,SD或PD为化疗不敏感。所有患者最少接受2个周期的化疗,考虑到L-OHP的剂量限制毒性,最多给予6周期化疗。对于化疗过程中出现PD的患者,停止L-OHP联合CAPE化疗,给予更换方案治疗。OS定义:从随机化开始至患者因任何原因引起死亡的时间或最后一次随访截至时间(失访者为末次随访时间)。
1.3 DNA提取和基因型分析
第1次化疗前采集患者外周血5 mL,用苯酚-氯仿法提取基因组DNA,置于-20℃备用。采用Taq-Man探针法进行基因型分析,探针及引物由南京骥骜生物技术有限公司制备,PCR反应预混物(RT-PCR MasterMix TaqMan, LM-0021)由上海联迈生物工程有限公司制备。在Applied Biosystems7900HT型实时荧光定量PCR仪器上反应,PCR反应体系共5 μL,含DNA样本0.50 μL 、上下游引物各0.25 μL 、2.50 μL Mix、TaqMan探针各0.125 μL 、双蒸水1.25 μL。PCR循环参数如下:95℃预变性8 min,随后进入循环:95℃变性20 s,64℃退火30 s,72℃延伸30 s,共计55次循环。仪器自动收集荧光信号,经SDS软件分析得出SNP分型结果。随机抽取15%样本,双盲法重复检测,结果完全一致。各位点引物及探针如下,rs8176318上游引物:5′-TTCAACCTCTGCATTCATCT-3′,下游引物:5′-AGAGTCCAGCTGCTAGATC-3′,探针:FAM-CTAGT-CTCCTAGCGACCTAGC-MGB,HEX-CTCAGCAGCGGAGGCTCCTG-MGB;rs799917上游引物:5′-GGTATCACAGCGTCAGTCAT-3′,下游引物:5′-CACATGCATCATCTGCATATCCT-3′,探针:FAM-TGCTCCGTATCAGA-MGB,HEX-TTGCTCTGTACTCAGAT-MGB;rs1799966上游引物:5′-ATACCATCTTCAGCCTCTGCATTG-3′,下游引物:5′-CCCTGCTCACACTGTCGTACT-3′,探针:FAM-TCTGCCAGAGTCAGCTGCTG-MGB,HEX-CTGCTCAGCATCCAGCTGCT-MGB。
1.4 随访
对153例晚期胃癌患者通过电子邮件、电话、微信、查询电子病历系统、登门面访等方式进行随访,截至时间为2020年9月30日。
1.5 统计学方法
采用SPSS 23.0软件统计,用拟合优度χ2检验基因型分布是否符合Hardy-Weinberg平衡。计数资料的组间比较采用χ2检验;Logistic回归模型分析不同基因型对化疗反应的影响,计算OR及95%CI,并经年龄、性别、分化等因素校正;采用Kaplan-Meier法行生存分析,用log-rank检验比较不同基因型OS的差异;用Cox风险比例模型评估多因素对预后的影响。检验取双尾,P<0.05为差异有统计学意义。
2 结 果
本组患者随访3~37个月,使用Reverse K-M法计算中位随访时间为24.30个月(95%CI:17.59~31.25)。15例患者失访,失访者的生存时间按照截尾数据处理。
2.1 化疗效果
153例晚期胃癌患者化疗2周期后行疗效评价,2例(1.31%)CR,59例(38.56%)PR,49例(32.03%)SD,43例(28.10%)PD,化疗有效率(CR+PR)为39.87%。不同性别、年龄、饮酒史、吸烟史、肿瘤部位、分化程度与化疗有效率之间无统计学关联(P>0.05)。患者临床特征及其与化疗反应的关系详情见表1。
2.2 基因型分布
rs8176318G/T、rs799917C/T和rs1799966T/C三个多态性在所有患者中均能被明确基因分型,rs8176318GG、GT、TT基因型分别为45(29.41%)、70(45.75%)和38(24.84%)例;rs799917CC、CT、TT基因型分别为41(26.79%)、66(43.14%)和46(30.07%)例;rs1799966TT、TC、CC基因型分别为39(25.49%)、69(45.10%)和45(29.41%)例。以上多态性位点各基因型分布均符合群体遗传学Hardy-Weinberg平衡(P>0.05)。
2.3 基因多态性与化疗敏感性
rs8176318GG、GT、TT基因型患者化疗有效率分别为11/45(24.44%)、31/70(44.28%)及19/38(50.00%),差异有统计学意义(χ2=6.662,P=0.036)。GT基因型化疗有效率为GG基因型的2.46倍(95%CI:1.074~5.620,χ2=4.534,P=0.033);TT基因型化疗有效率为GG基因型的3.09倍(95%CI:1.218~7.841,χ2=5.645,P=0.018);GT+TT基因型化疗有效率为GG基因型的2.67倍 (95%CI:1.224~5.801,χ2=6.096,P=0.014)。
rs799917CC、CT、TT基因型患者化疗有效率分别为16/41(39.02%)、24/66(36.36%)和21/46(45.65%);rs1799966TT、TC、CC基因型化疗有效率分别为12/39(30.77%)、27/69(39.13%)和22/45(48.88%),未发现这2个多态性与化疗有效率之间存在统计学关联(P>0.05)。各位点基因型与化疗反应关系、OR值及95%CI见表2。
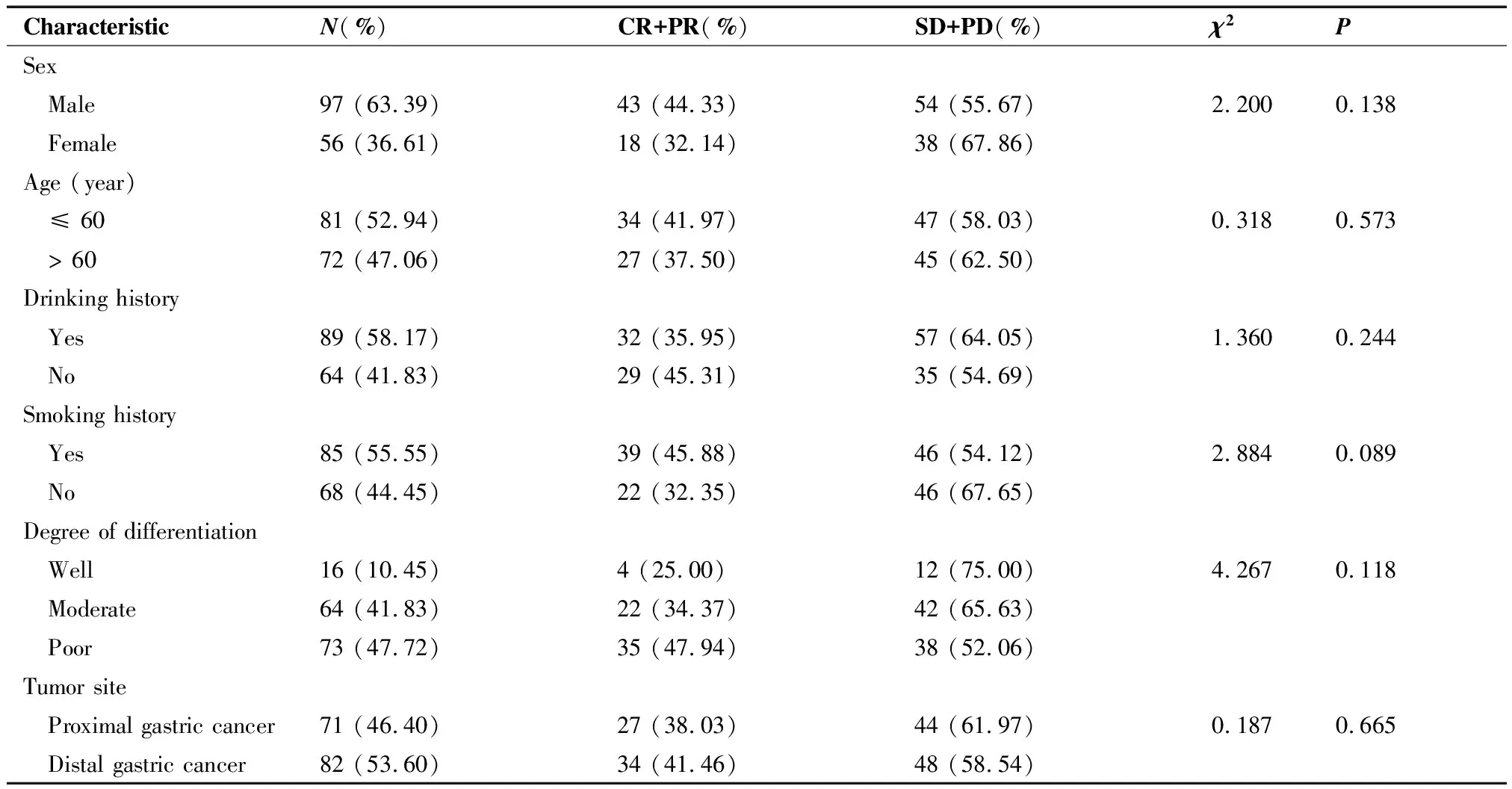
表1 临床特征分布及其与化疗反应的关系
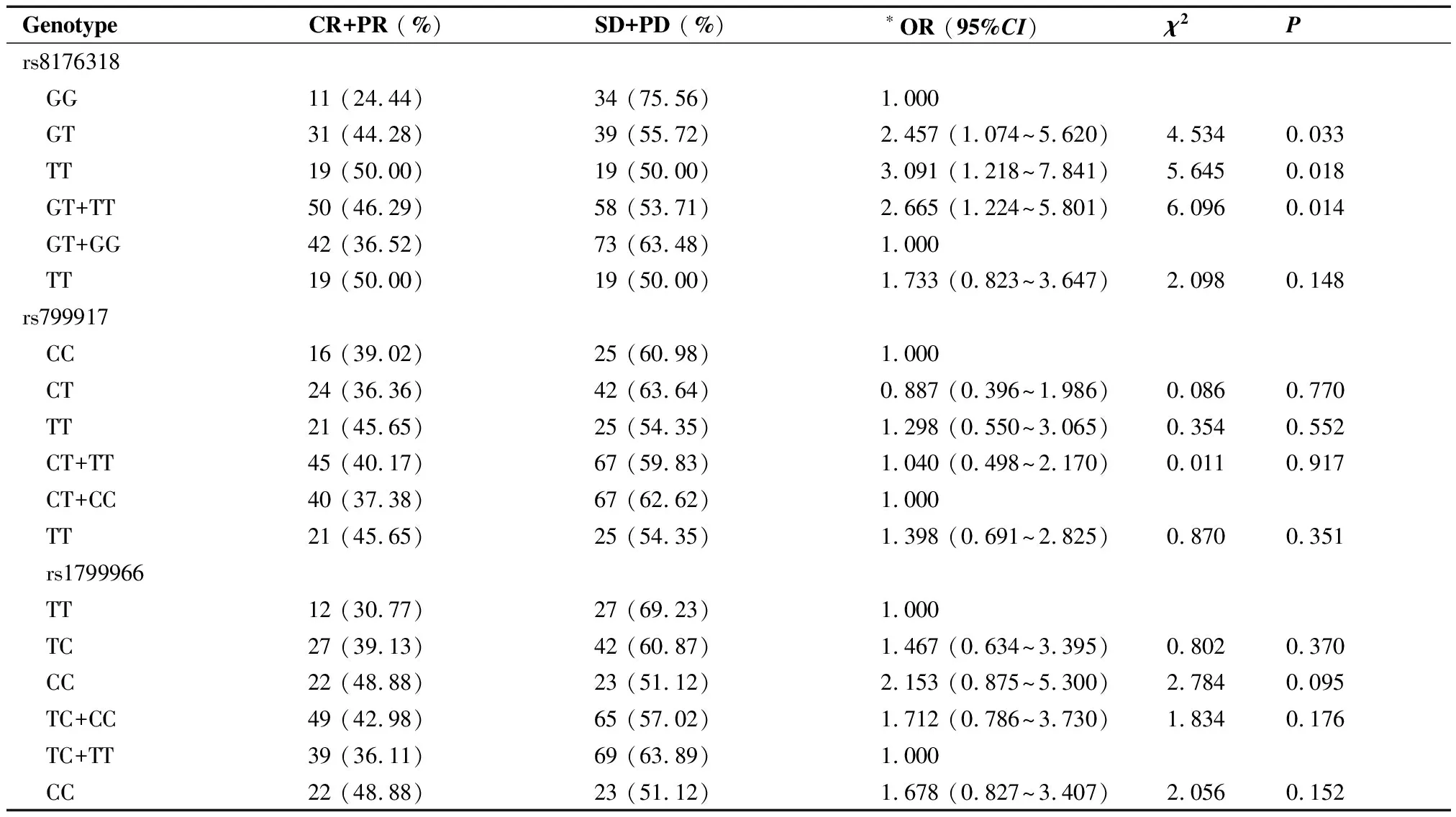
表2 153例患者各多态性位点基因型分布及与化疗反应的关联性分析
2.4 基因多态性与患者预后
153例晚期胃癌患者总体中位OS为12.80个月(95%CI:10.566~15.034)。rs8176318GG、GT、TT基因型患者中位OS分别为12.10、12.70、13.60个月(χ2=3.561,P=0.203);rs799917CC、CT、TT基因型患者中位OS分别为12.00、12.60、13.70个月(χ2=1.235,P=0.512)。rs8176318及rs799917多态性与OS之间均未见统计学关联。
rs1799966TT、TC和CC基因型患者中位OS分别为9.50、11.80、16.00个月(χ2=12.719,P=0.002)(图1A)。TC+CC基因型患者中位OS为13.90个月,与TT组比较差异有统计学意义(χ2=7.480,P=0.006)(图1B)。
将年龄、性别、饮酒史、吸烟状态、分化程度、肿瘤部位及各基因多态性纳入Cox风险比例模型进行综合分析,结果显示rs1799966多态性仍是影响患者OS的独立预后因素(χ2=6.684,P=0.01,OR:1.702,95%CI:1.156~2.506)。
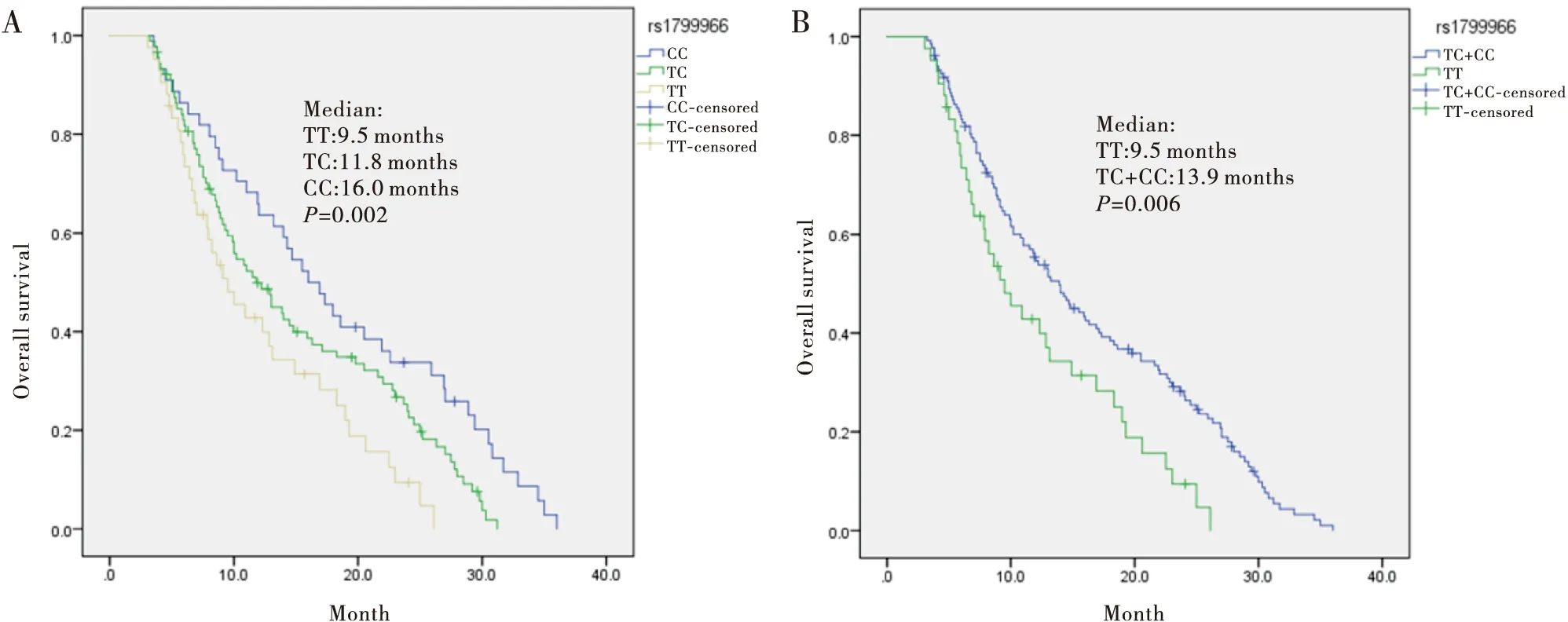
图1 BRCA1基因rs1799966位点不同基因型胃癌患者的总生存期曲线对比
3 讨 论
奥沙利铂是目前临床上治疗晚期胃癌最常用的铂类药物之一,常与氟尿嘧啶类药物组成两药联合化疗方案。然而晚期胃癌化疗有效率低,且短期内容易出现耐药并导致肿瘤进展。铂类药物进入细胞后主要通过破坏DNA的复制和转录,阻碍细胞周期进展,并诱导细胞凋亡,从而造成肿瘤细胞死亡。因此,这类药物的疗效与DNA的修复能力密切相关,已有研究认为DNA修复能力增强是铂类药物耐药的主要原因[17]。SNP是基因组水平上最常见的遗传变异,作为第3代遗传标记,SNP能改变基因的转录活性、调节蛋白表达,进而影响个体对疾病的易感性[15]及药物治疗的敏感性[18]。BRCA1基因定位于人类染色体17q21,基因全长约100kb, 22个外显子转录出7.80kb的mRNA,编码蛋白含1 863个氨基酸残基,分子量为220KD;BRCA1蛋白质N端为锌指结构域,富含半胱氨酸和组氨酸,能与另一环指蛋白作用,二者均具有泛素连接酶的作用;C末端为一酸性结构域,含有两个长约95个氨基酸残基的BRCA1羧基端(BRCT carboxyl terminus,BRCT)的串联重复序列,对细胞周期监控DNA损伤修复起重要作用[5]。更重要的是,体外研究已经证实BRCA1高表达的胃癌细胞对奥沙利铂、顺铂化疗抵抗,而低表达相对敏感[7]。因此,我们推测BRCA1多态性可能与晚期胃癌患者化疗反应及预后之间存在关联。
rs8176318G/T多态性位于BRCA1基因3′-非翻译区(3′-untranslated region,3′-UTR),该位点变异影响microRNA(miRNA)与BRCA1的结合,从而调控其表达[10]。BRCA1基因3′UTR区域基因变异将遗传性乳腺癌和卵巢癌的发病风险提升了3.70~15.40倍[19]。Dorairaj等[20]进行SNP功能学研究发现,与G等位基因相比,rs8176318T等位基因明显下调BRCA1的表达。在全世界不同人群的研究中,rs8176318G/T变异与乳腺癌风险增加相关[10, 21]。本研究首次发现rs8176318G/T多态性与胃癌化疗敏感性相关,随着T等位基因数目的增加,化疗有效率明显升高(GG:24.44%、GT:44.28%、TT:50.00%), GT+TT基因型化疗有效率为GG基因型的2.67倍 (95%CI:1.224~5.801,χ2=6.096,P=0.014)。我们推测rs8176318变异等位基因(T)可能影响BRCA1与miRNA的结合,抑制转录,下调BRCA1的表达,进而减弱胃癌细胞DNA修复能力,最终提升化疗的敏感性。当然,这些推论需要相关的功能学研究来证实。
rs799917C/T属于非同义SNP,碱基C变异为T后将导致871位脯氨酸转换为亮氨酸,可能影响BRCA1蛋白的结构、功能。研究发现rs799917C/T多态性与波兰人群乳腺癌发病风险增加密切相关(OR:1.45;95%CI:1.24~1.71,P<0.0001)[11]。此外,该多态性还被证实能影响多形性胶质母细胞瘤[15]、子宫内膜癌[16]的易感性。一项荟萃分析回顾了BRCA1基因多态性与癌症风险之间的关联强度,当进行亚组分析时,发现在亚洲人群中,rs799917多态性与食管鳞癌、胃癌、宫颈癌和非霍奇金淋巴瘤的风险降低有关[22]。Shi等[23]还发现rs799917TT基因型增加中国汉族人群放疗后三阴乳腺癌的复发风险。本研究未发现rs799917C/T多态性与晚期胃癌患者化疗反应及OS之间存在关联(P>0.05),且此前无该多态性与肿瘤化疗疗效之间的研究报道,该多态性与肿瘤化疗预后之间的关系仍不清晰,需进一步深入探讨。
rs1799966T/C是另一个常见的非同义SNP,位于BRCA1羧基端结构域编码区,该区也被称为BRCT,其在DNA双链断裂损伤的同源重组修复过程中发挥重要作用。该SNP位点核苷酸T→C转换引起编码的丝氨酸变成甘氨酸,可能改变BRCA1的结构,进而影响DNA损伤修复能力。已有研究发现rs1799966CC基因型能增加中-低分化前列腺癌的发病风险,并与前列腺癌、乳腺癌或卵巢癌家族史无关[14]。Du等[24]研究发现携带rs1799966等位基因C的晚期非小细胞肺癌患者对化疗的反应更好(TC+CCvsTT,OR=0.402,95%CI=0.204~0.794,P=0.008),且死亡风险显著下降(HR=0.617,95%CI=0.402~0.948,P=0.028)。同样,Su等[25]也发现rs1799966CC基因型与肺癌患者的生存时间延长密切相关。这与我们的研究结果一致,本研究发现rs1799966C等位基因与胃癌患者生存时间延长相关,TT、TC和CC基因型患者中位OS分别为9.50、11.80、16.00个月(χ2=12.719,P=0.002);TC+CC基因型患者中位OS为13.90个月,较TT组明显延长(χ2=7.480,P=0.006)。然而,在胰腺癌的研究中发现rs1799966多态性错义突变与患者生存时间缩短相关,导致预后不良[26];这与我们的结论相反,可能与种族、瘤种、治疗方案等差异导致不同的研究结果有关。
综上所述,本研究发现BRCA1多态性与晚期胃癌患者化疗敏感性及预后相关,rs8176318T等位基因预示更好的化疗反应性,而rs1799966C等位基因携带者的OS显著延长,本研究结果可能在预测晚期胃癌化疗效果、判断预后方面有一定的指导作用。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

