KIF4A在卵巢癌中的预后、生物学功能及富集分析*
冯嵩崴,罗山晖,王露玉,季晨晨,朱维培
215000 江苏 苏州,苏州大学附属第二医院 妇产科(冯嵩崴、罗山晖、王露玉、朱维培);215000 江苏 苏州,苏州大学 骨科研究所(季晨晨)
在女性生殖器恶性肿瘤当中,卵巢癌的总死亡率排在首位,并且5年生存率仅为25%~30%[1]。绝大多数患者在早期没有症状,在确诊时已经处于晚期并伴转移。因此,探索卵巢癌新的诊断和治疗方法,对卵巢癌的治疗具有重大意义。
KIF4A为驱动蛋白超家族成员之一,这些蛋白在细胞内微管转运和细胞分裂中起关键作用[2]。KIF4A位于细胞质和细胞核中,被认为是肿瘤发生发展的重要因素[3]。KIF4A基因在肿瘤中有着不同的作用,它在大多数肿瘤中作为原癌基因,如胶质母细胞瘤[4]、肝癌[5]和胰腺癌[6]。有趣的是,KIF4A在胃癌中起着抑癌基因的作用[7]。近来的生物信息学研究表明,KIF4A的表达在正常卵巢和肿瘤样本中存在显著差异,提示KIF4A可能与卵巢癌的发生发展有关[8]。然而,KIF4A在卵巢癌中的潜在分子机制及基因功能研究尚未见相关报道。
本研究通过生物信息学方法对KIF4A在卵巢癌中进行基因其富集分析,并进一步在高表达KIF4A的卵巢癌细胞系中沉默KIF4A基因,观察其对于肿瘤细胞的增殖、迁移、凋亡、周期分布等生物学功能的影响。
1 材料与方法
1.1 主要材料
细胞系A2780、HO-8910PM、COC1、SKOV3和IOSE80购自中国科学院上海细胞生物所细胞库;培养基RPMI 1640、胎牛血清、PBS、胰酶购自Hyclone公司;慢病毒干扰载体sh-NC、sh-KIF4A-1、sh-KIF4A-2、sh-KIF4A-3购自GenePharma公司;实时荧光定量PCR相关试剂盒购自TaKaRa公司;lipofectamineTM2000、TRIzol及相关引物购自Invitrogen公司;兔抗人KIF4 (ab122227)及鼠抗人GAPDH (ab8245)均购自Abcam公司;Transwell小室购自Corining公司;MTT试剂盒,BCA试剂盒,二甲基亚砜(dimethyl sulfoxide,DMSO)购自Sigma公司;凋亡试剂及细胞周期试剂盒购自杭州联科。
1.2 生物信息学分析
下载TCGA数据库(http://portal.gdc.cancer.gov)中327例卵巢癌患者的转录组数据,以中KIF4A表达量的中位值,将样本分为KIF4A高表达和低表达两个亚组,设置筛选条件为logFC>0.5,P<0.05,筛选出高低亚组中上调及下调最明显的前20个基因进行基因表达热图和基因相关性分析热图的绘制,然后将这些相关基因进行GO功能富集分析和KEGG通路富集分析。使用GEPIA数据库(http://gepia.cancer-pku.cn)检测卵巢癌及正常卵巢上皮组织中KIF4A的表达水平及FIGO分期情况。使用KM-plotter数据库(http://www.kmplot.com/)检测KIF4A表达量与卵巢癌患者总生存期(overall survival, OS)的关系,并显示P值,HR(95%CI)和生存曲线。以上数据库所有临床数据及转录组数据均基于TCGA数据库中的卵巢癌数据。使用人类蛋白质图谱数据库(HPA, http://www.proteinatlas.org)检测KIF4A基因在正常卵巢上皮及卵巢癌上皮组织的免疫组化染色情况。
1.3 细胞培养及转染
将细胞株接种于含有FBS(10%)和青霉素(100 U/mL)和链霉素(100 μg/mL)的RPMI-1640培养基中,均在37℃,5%CO2条件下培养,当汇合度达90%时进行传代培养。转染前,用磷酸盐缓冲盐水冲洗,采用携带sh-NC、sh-KIF4A-1、sh-KIF4A-2、sh-KIF4A-3的慢病毒对KIF4A相对表达量最多的细胞株进行转染。
1.4 RT-qPCR及Western Blot
在RT-qPCR实验中,应用Trizol试剂从细胞中提取总RNA,应用PrimeScript RT试剂盒进行逆转录,SYBR Prime Script RT-PCR试剂盒用于RT-qPCR,采用荧光定量PCR仪进行扩增,反应条件为95 ℃ 30 s;60 ℃ 30 s,72 ℃ 60 s反复40个循环。以GADP为内参基因,通过2-ΔΔCt方法计算结果并绘制直方图。使用的引物序列是:KIF4A-F: 5’-TGAACTCCCAGTCGTCC-3’;KIF4A-R: 5’-GCACTGATTACATTTCCC-3’;GAPDH-F: 5’-GGAGCGAG-ATCCCTCCAAAT-3’; GADPH-R: 5’-GGCTGTTGTCATACTTCTCATGG-3’。在Western Blot实验中,使用BCA试剂盒测定蛋白浓度,在SDS-PAGE胶的孔空中上样,电泳后转移至PVDF膜上,用5%脱脂奶粉封闭2小时。然后将兔抗人KIF4A抗体(稀释1∶1 000)和GAPDH鼠抗人抗体(1∶2 500)加入,并在4℃下孵育过夜。使用PBST缓冲液洗膜,随后将二抗加入并在室温下孵育1小时,用PBST缓冲液洗涤后曝光显影。
1.5 细胞增殖实验(MTT法)和克隆形成实验
在MTT实验中,细胞培养24 h、48 h、72 h后加入10 μL MTT(5 mg/mL)试剂,在37℃下孵育4小时,加入150 μL DMSO后震荡10 min,用酶标仪在490 nm的吸光度下进行测量,用于分析细胞增殖情况。在克隆形成实验中,胰蛋白酶消化细胞后接种于6孔板中培养3周,PBS 洗涤,4%多聚甲醛室温下固定细胞0.5 h。弃去固定液后结晶紫染色液染色10 min,最后得到集落数。
1.6 细胞迁移实验(Transwell及划痕实验)
在Transwell小室迁移实验中,下室加600 μL含10%FBS的培养基。取对数生长期得细胞,用无血清的培养基进行重悬后取3×105/mL的悬液加入上室。培养48 h,用棉签擦去上室中的细胞后,使用4%的多聚甲醛将小室底部细胞固定15 min,结晶紫避光染色15 min,最后在光学显微镜下观察计数,随机选取五个视野进行细胞计数。在划痕实验中,PBS冲洗悬浮细胞并将细胞以2×105个/孔接种于6孔板中,用200 μL无菌移液枪头笔直的产生划痕伤口。划痕后0小时和24小时使用显微镜拍摄汇合情况。
1.7 细胞凋亡及细胞周期检测
将转染后的卵巢癌细胞1×105个/孔接种于6孔板,37℃培养3天进行PBS洗涤,洗涤后用不含乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)的胰蛋白酶进行消化,重悬于PBS然后离心收集,重复3次。凋亡:每管细胞加入5 μL FITC annexin V和Propidium Iodide Staining Solution避光孵育30分钟,至流式细胞仪中检测。周期:酒精固定后,10 μL破膜剂及1 mL PI(50 μL/mL)加入每管细胞后混匀,避光孵育60分钟,至流式细胞仪中检测。
1.8 统计学分析
所有数据用均数±标准差表示。两组间数据比较采用t检验;多组间计量比较采用单因素方差分析。使用Graphpad Prism 5.0绘制所有直方图和线图。实验部分统计均在Graphpad Prism 5.0及SPSS 16.0软件中进行,转录组数据在R 3.6.1中进行统计分析及绘图。P<0.05为差异有统计学意义。
2 结 果
2.1 KIF4A在卵巢癌中的基因富集分析
为了解KIF4A在卵巢癌中的调控机制及相关基因,基于TCGA数据库中转录组数据,筛选出高低亚组中上调及下调最明显的前20个基因进行表达热图和相关性分析热图的绘制(图1A)。其中基因富集分析显示KIF4A与MYH11、ACTG2、HSPB6等基因成负相关,与BUB1、CCNA2、MELK等基因呈正相关(图1B)。接下来将这些共表达基因进行GO功能富集分析和KEGG通路富集分析。结果表明,KIF4A在卵巢癌中具有有丝细胞核分裂,有丝分裂姐妹染色单体分离,细胞器裂变的功能。KEGG通路富集结果显示,KIF4A可能影响细胞周期,细胞黏附分子,血管平滑肌收缩等通路(图1C、D)。
2.2 KIF4A在卵巢癌中的表达情况
在不同细胞系中分别检测KIF4A的表达。RT-qPCR的结果表明,与正常卵巢上皮细胞IOSE80相比,卵巢癌细胞株A2780(5.532±0.263),SKOV3(6.565±0.224),HO-8910PM(4.868±0.311),COC1(5.486±0.458)中KIF4A的表达量差异具有统计学意义(P<0.01)(图2A);western blot结果显示,卵巢癌细胞与正常卵巢上皮细胞相比,KIF4A的蛋白表达水平显著增加,其差异均具有统计学意义(P<0.01)(图2B);因此,本研究选取KIF4A表达相对最高的SKOV3细胞进行后续试验。与此同时,GEPIA数据库中分析KIF4A在卵巢癌患者中的表达情况,KIF4A基因在肿瘤组中同样高表达(P<0.01);HPA数据库中检索KIF4A基因在卵巢癌上皮细胞及正常卵巢上皮细胞的免疫组织化学法染色情况,结果显示卵巢癌上皮细胞中染色程度更强。
研究结果表明,KIF4A在卵巢癌细胞系及临床样本中较正常组织相比,mRNA及蛋白质表达水平均明显升高。
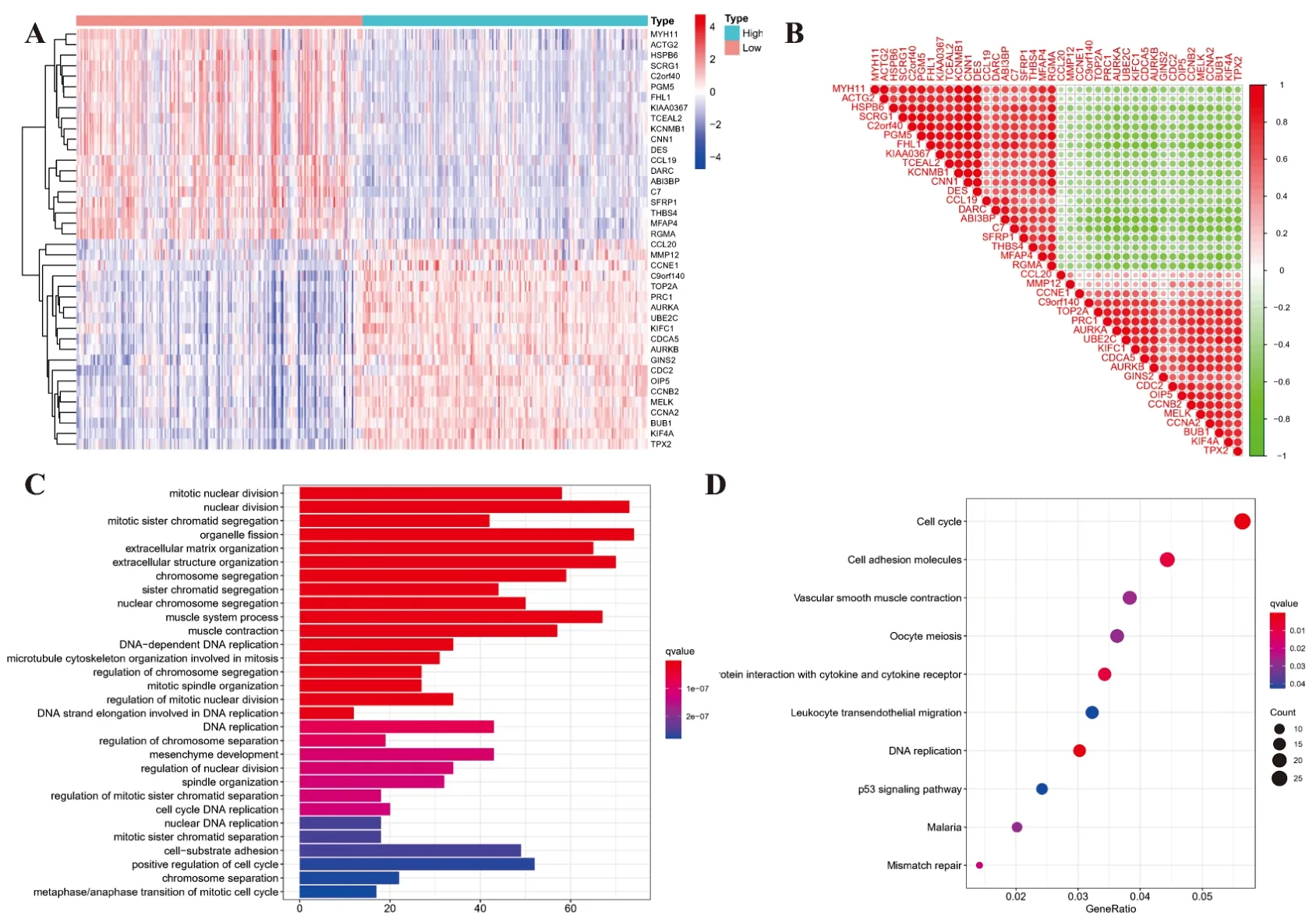
图1 KIF4A在卵巢癌中的基因富集分析
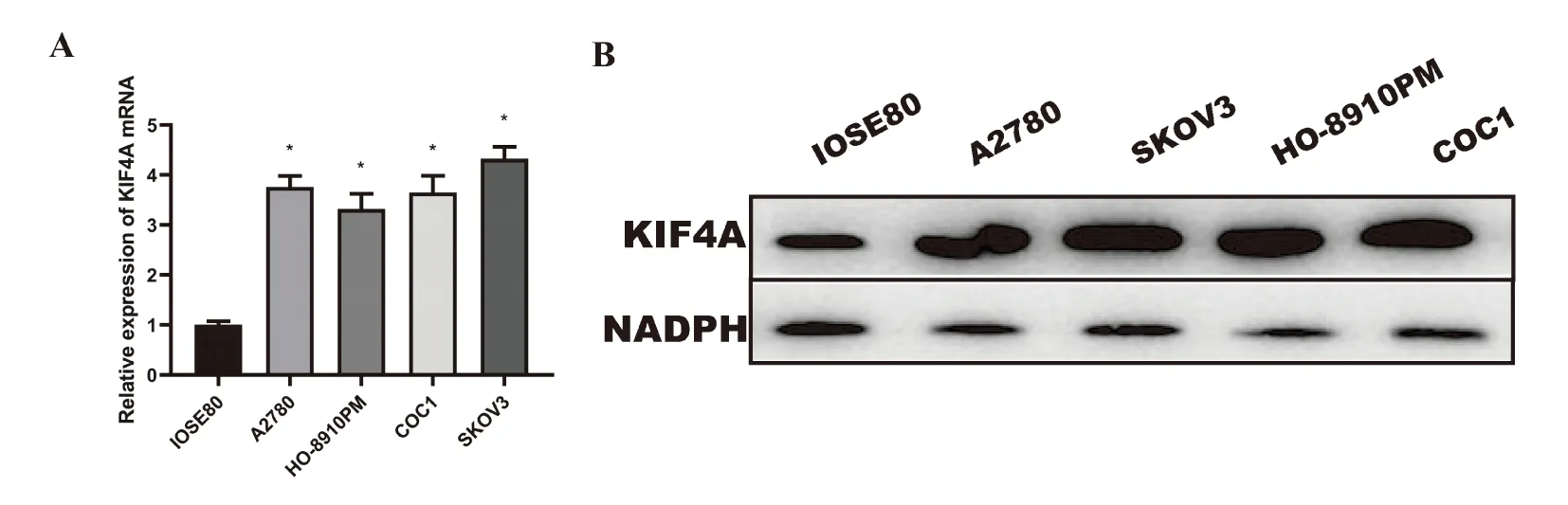
图2 KIF4A在卵巢癌中的表达情况
2.3 KIF4A与卵巢癌患者预后的关系
在Kaplan-Meier Plotter数据库中查询KIF4A基因表达情况与卵巢癌患者生存时间的关系,发现KIF4A高表达组具有较短的总生存期(HR=1.570,P<0.01),见图3A。在GEPIA数据库中查询KIF4A
基因表达量与FIGO分期的关系,结果显示KIF4A表达量在不同分期之间具有统计学差异(F=3.860,P<0.05),见图3B。
研究结果表明,卵巢癌KIF4A高表达患者中与低表达患者相比,具有更差的预后,但卵巢癌患者中KIF4A的表达量随着临床分期的增高而减少。
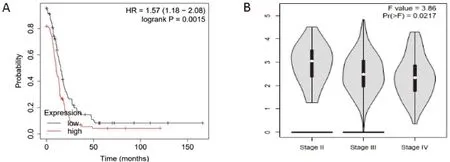
图3 KIF4A与卵巢癌患者预后的关系
2.4 KIF4A对卵巢癌细胞生长的影响
三组sh-KIF4A分别转染SKOV3细胞系,结果显示KIF4A的mRNA和蛋白均表达明显下降(P<0.05),选择其中沉默效率最佳的sh-KIF4A-3进行后续实验,见图4。MTT法测定结果显示,转染24 h、48 h和72 h后,sh-KIF4A组OD值(0.239±0.020、0.735±0.056、1.611±0.001)显著低于sh-NC组(0.602±0.023、1.632±0.025、2.718±0.048),差异具有统计学意义(P<0.05)(图5A)。克隆形成实验检测结果显示,sh-NC 组和 sh-KIF4A组细胞克隆形成数分别为(305±27)个和(142±12)个,差异有统计学意义(图5B)。
研究结果表明,sh-KIF4A-3的沉默效果最好,且沉默KIF4A可明显抑制卵巢癌细胞的生长。
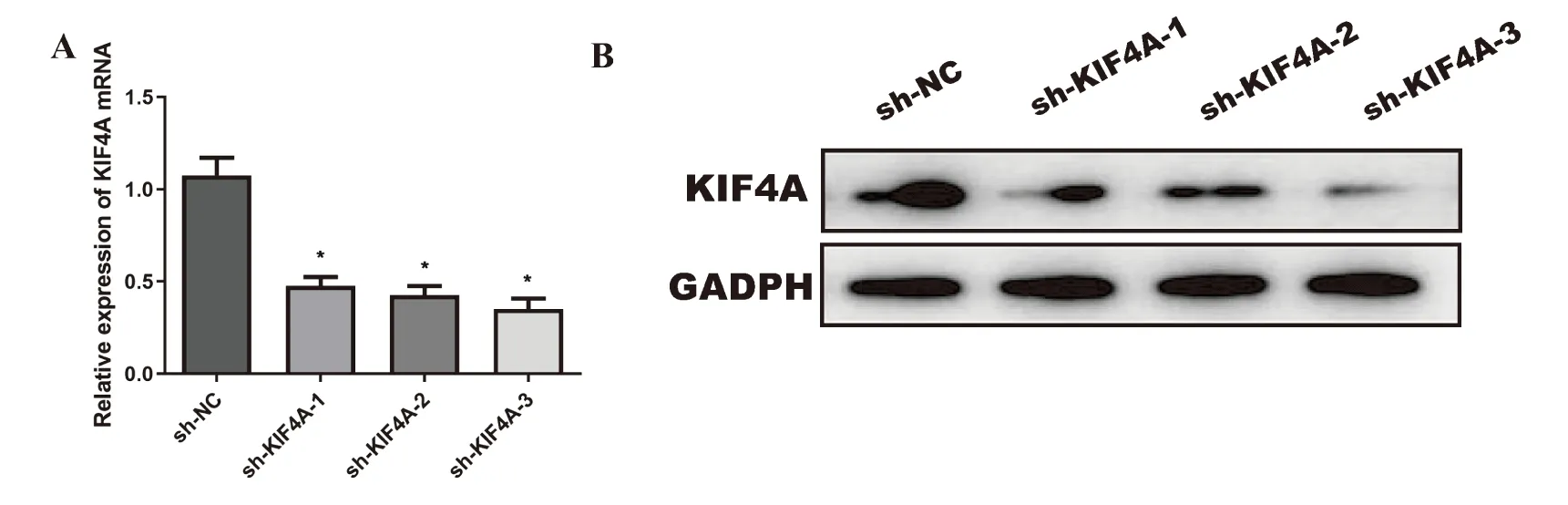
图4 不同sh-KIF4A的转染效果
2.5 KIF4A对卵巢癌细胞迁移的影响
Transwell小室迁移实验研究KIF4A对迁移的影响,结果显示沉默KIF4A的可以抑制卵巢癌细胞的迁移,sh-KIF4A(32.3±4.6)组中穿过小室滤过膜的细胞数明显少于sh-NC组(56.3±3.8),差别有统计学意义(P<0.01) (图6A)。同时划痕实验同样证实了这一结论(图6B)。
研究结果表明,Transwell及划痕试验均证明了沉默KIF4A可明显抑制卵巢癌细胞的迁移能力。
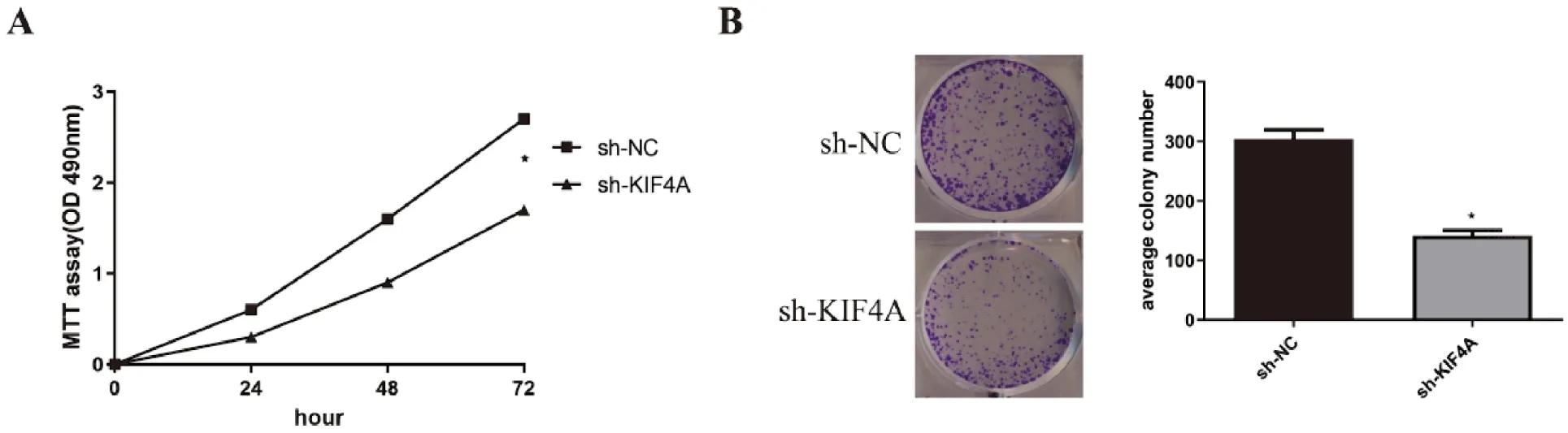
图5 沉默KIF4A对卵巢癌细胞增殖的影响
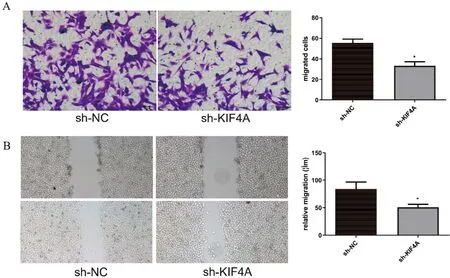
图6 沉默KIF4A对卵巢癌细胞迁移的影响
2.6 KIF4A对卵巢癌细胞凋亡的影响
流式细胞仪检测结果显示,sh-KIF4A组与sh-NC组的细胞凋亡率分别为5.832%±0.916%和0.247%±0.017%,sh-KIF4A组凋亡率显著大于sh-NC组,差异具有统计学意义(P<0.01)(图7)。
研究结果表明,沉默KIF4A可明显促进卵巢癌细胞的凋亡。
2.7 KIF4A对卵巢癌细胞周期的影响
流式细胞仪检测结果显示,sh-NC组与sh-KIF4A组的细胞周期分布比例 G0/G1期分别为68.124%±0.533%和50.567%±0.753%;S 期分别为30.110%±1.235%和38.443%±1.147%;G2/M 期为别为12.997%±0.012%和12.843%±0.008%。除G2/M 期外,其余周期分布比例差异有统计学意义(P<0.01)(图8)。说明沉默KIF4A可影响卵巢癌细胞各周期分布比例,主要影响 G0/G1 期。
研究结果表明,沉默KIF4A可将卵巢癌细胞生长阻滞于S期并主要影响 G0/G1 期的分布。
3 讨 论
卵巢恶性肿瘤在女性生殖器官肿瘤中预后最差,且相应生物学功能是影响卵巢癌死亡率的重要原因。而靶向治疗开创了卵巢癌治疗的新领域,寻找作用于新靶点的药物是近年来研究的热点。故本研究着重探讨KIF4A对肿瘤细胞生物学功能的影响及相关基因富集分析,这将为卵巢癌的诊断和治疗提供重要指导。
KIF4A是驱动蛋白家族的成员之一,该家族可利用ATP水解所释放的能量沿着微管进行包括囊泡、细胞器、染色体、蛋白质复合物和mRNA等的转运。目前该蛋白分子在多种肿瘤中被深入研究,Taniwaki等[9]研究发现干扰KIF4A在肺癌细胞中的表达后,肺癌细胞的生长及侵袭受会受到抑制,提示KIF4A与肺癌的发生、发展有关。Liu等[10]通过体内体外实验同样证实KIF4A可促进肾透明细胞癌的转移及增殖。Gao等[11]发现KIF4A可调节p21启动子促进胰腺癌细胞的增殖、迁移及侵袭,但是对其细胞凋亡没有影响。虽然上述研究提示KIF4A异常表达与癌症发生、发展密切相关,相关生物信息学研究也表明KIF4A与卵巢癌患者的预后显著相关,但目前仍缺乏KIF4A与卵巢癌的生物学功能试验研究。因此,本研究进一步分析KIF4A在卵巢癌中的预后、生物学功能及相关基因富集分析,以期对卵巢癌的靶向治疗提供新思路。
本研究首先通过生物信息学方法,在卵巢癌患者公共数据库中检索KIF4A基因与卵巢癌患者总生存期及FIGO分期的关系,结果显示高表达KIF4A生存时间明显降低,这与陈柱等[12]和胡国辉等[13]在乳腺癌及肝癌患者的预后分析中结果相一致,这提示KIF4A可能在泛癌中均与预后有着明显联系。但卵巢癌患者中KIF4A的表达量却不随着肿瘤临床分期的严重程度所增加,这与之前其他肿瘤中的研究[14]结果不一致,这需要将来进一步研究。接下来RT-qPCR检测了人卵巢癌正常上皮细胞株IOSE80和多种卵巢癌细胞株和中KIF4AmRNA 的相对表达水平,发现卵巢癌细胞A2780,HO-8910PM,COC1,SKOV3中KIF4AmRNA 的表达水平显著高于正常卵巢上皮细胞。选取其中KIF4A表达水平最高的细胞株SKOV3进行了后续功能试验。结果发现,沉默KIF4A的表达可抑制卵巢癌细胞的生长及迁移并促进其凋亡。此外,沉默KIF4A影响卵巢癌的周期分布,主要影响G0/G1期,并使细胞阻滞在S期,进而导致肿瘤的生长抑制。关于KIF4A在分子层面的深入机制已有相关报道。研究发现KIF4A调控肝癌细胞的生长可能是通过调节巨噬细胞血管生成相关因子[15],但具体机制仍需进一步阐明。武岩[16]研究发现NLP蛋白可与KIF4A蛋白一起参与调控中间小体的生成参与正常及肿瘤细胞的有丝分裂。在乳腺癌中,KIF4A可被多柔比星诱导低表达并影响PARP-1的上调[17],且miR-335可对其进行调控,并通过荧光素酶试验进行了验证[18]。但是KIF4A在卵巢癌中的深层机制的研究还未有报道,这将来值得进一步的深入探讨。
KIF4A作为驱动蛋白家族的成员之一,驱动蛋白抑制剂能够克服抗微管类药物的耐药,如有丝分裂驱动蛋白KIF20B[19]及Eg5[20]抑制剂具有抗增殖作用已被证实可用于肝癌及其他恶性肿瘤的治疗。根据KIF4A在有丝分裂过程中的作用,选择性地抑制 KIF4A的活性,进而抑制肿瘤细胞的生长及分裂,这有可能成为新的卵巢癌患者的治疗策略。
综上所述,我们的研究结果表明,KIF4A与卵巢癌患者的预后及细胞的生物学具有明显相关。但是,KIF4A在卵巢癌中发生和发展的具体作用及相关机制并未完全阐明,以及相应的调节机制也需在动物模型进行进一步的研究,相信在完善相关基础及临床实验后,KIF4A将有望成为卵巢癌治疗的新靶点,并改善卵巢癌患者的预后。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

