草鱼胰蛋白酶的亲和纯化及酶学性质
李 晨,高柳芳,崔晓东,韩宇航,朱丹旭,李 娇,*
(1.山西大学生命科学学院,山西 太原 030006;2.山西大学生物技术研究所,山西 太原 030006)
胰蛋白酶是一种丝氨酸蛋白水解酶,是目前应用最广泛的蛋白酶之一,其应用范围遍布于食品(面包烘烤业、果品加工业、面粉深加工等)、纺织、饲料、发酵、洗涤剂、皮革、医药以及能源开发、环境保护等行业[1]。然而传统的分离蛋白酶方法主要依据目的分子的大小、溶解度及带电荷情况等,特异性很差,不仅纯化过程费时费力,而且酶的比活力和总活力回收不理想[2],难以满足市场需求。亲和层析具有特异性强、高效、操作简单等多种优势,是目前纯化生物酶的首选方法。
目前虽然有牛和猪来源的胰蛋白酶已经商业化,然而,胰蛋白酶在自然界很多物种中普遍存在,其性质不尽相同,可用于不同领域。近些年来鱼类养殖业发展迅速,渔业生产方式已经由传统的捕捞转变成以养殖为主,我国水产品总产量多年以来一直居于世界首位[3],鱼类加工规模不断扩大。然而鱼的内脏目前还没有得到充分利用,很多时候被当作废弃物扔掉,这样既不利于环境保护,又使得渔业资源大量浪费[4]。鱼内脏是鱼加工的主要副产品之一,其中含有丰富的油脂、蛋白质、复合酶等物质,且具有很高的生理活性和营养价值[5]。目前,鱼内脏的利用途径主要包括鱼油的精制(提取DHA和EPA),如鱼子用于制成保健品或美容护肤品,鱼肝用于治疗恶性贫血,鱼肠内的大量消化酶制成酶制剂等[6]。除此之外,近年来对鱼内脏中的多种酶类(如脂肪酶)、多糖(如糖醛酸多糖)等也进行了研究[7-8]。胰蛋白酶来源于鱼类的肝胰脏、肠道和幽门盲囊,是鱼内脏主要的内源性蛋白水解酶,对其研究在国内外已有报道,如深海金枪鱼、弹丸鱼以及淡水鲈鱼、罗非鱼等[9]。
草鱼(Ctenopharyngodon idellus)是我国淡水养殖产量最高的鱼类[10],2018年产量高达550.4万 t。本实验用亲和层析法从草鱼肝胰腺粗酶液中一步纯化得到胰蛋白酶,进一步研究其理化性质及稳定性等,旨在为鱼类的综合开发、提高鱼产品附加值等提供一定的理论依据,在提高资源利用率和环境保护等方面具有重要意义。
1 材料与方法
1.1 材料与试剂
草鱼购于山西太原市田和活鲜水产市场。
牛胰蛋白酶、CNBr活化琼脂糖凝胶(CNBr-Sepharose CL-4B)、蛋白质分子质量标准品 生工生物工程(上海)股份有限公司;考马斯亮蓝R-250 北京索莱宝科技有限公司;苯甲酰-DL-精氨酰-对硝基苯氨(benzoyl-DL-arginine-p-nitroanilide,BApNA) 美国Sigma公司;其余试剂为分析纯。
1.2 仪器与设备
HH-4型恒温水浴锅 北京市长风仪器仪表公司;Biologic-LP型蛋白质纯化系统 美国Bio-Rad公司;TU-1810型紫外分光光度计 上海美谱达仪器有限公司;HC-2518R型高速冷冻离心机 安徽中科中佳科学仪器有限公司;FA-25型高速组织匀浆机 上海弗鲁克科技发展有限公司;BSA224S型精密电子天平、PB-10型精密pH计 德国Sartorius公司;THZ-C-1型恒温振荡培养箱 上海博讯实业有限公司;DYCZ-24DN型电泳仪北京六一生物科技有限公司。
1.3 方法
1.3.1 草鱼胰蛋白酶粗酶液的制备
选用新鲜的草鱼肝胰腺、鱼肠,将鱼肠纵向划开,用4 ℃水冲洗干净后再用滤纸吸干表面的水分,向肝胰腺中加入一部分肠后称质量。每克肝胰腺湿组织加3 mL pH 7.5、20 mmol/L预冷Tris-HCl缓冲液(含10 mmol/L CaCl2),用高速组织匀浆机将肝胰腺研磨成匀浆,于4 ℃静置激活5 h后,4 ℃、12 000 r/min离心30 min,取上清液,用纱布和滤纸过滤去除脂肪。向上清液中加入硫酸铵粉末,使其饱和度达到80%,在4 ℃盐析6 h后冰浴静置1 h,4 ℃、12 000 r/min离心30 min,收集沉淀。用pH 7.5、20 mmol/L Tris-HCl缓冲液(含10 mmol/L CaCl2)溶解沉淀,离心取上清液,将上清液置于透析袋中,pH 7.5、20 mmol/L Tris-HCl缓冲液磁力搅拌下于4 ℃透析脱盐,每1 h换一次透析液,共换3 次,得到草鱼胰蛋白酶粗酶液[11]。
1.3.2 BTI-Sepharose亲和材料的制备
本实验所用的BTI-Sepharose亲和层析柱是以课题组纯化的重组荞麦胰蛋白酶抑制剂(buckwheat trypsin inhibitor,BTI)为配基,CNBr-Sepharose CL-4B为载体自制的亲和材料。
用pH 9.0、250 mmol/L碳酸钠缓冲液溶解BTI,并调整BTI质量浓度为5 mg/mL。用去离子水清洗CNBr活化琼脂糖凝胶表面的溶剂后,继续用碳酸钠缓冲液浸泡并洗涤。将凝胶与BTI溶液混合,摇床振荡,25 ℃偶联6 h。然后加入pH 8.3、250 mmol/L Tris-HCl缓冲液,继续反应6 h封闭剩余的活性基团。将偶联了BTI的凝胶填料装于柱中,分别用1 mol/L NaCl溶液和蒸馏水清洗10 个柱床体积,置于4 ℃保存备用。
1.3.3 草鱼胰蛋白酶的亲和层析纯化
取3 mL粗酶液上样于用缓冲液(pH 7.5,20 mmol/L Tris-HCl,50 mmol/L NaCl)平衡好的BTI-琼脂糖亲和层析柱,流速控制为1 mL/min,充分洗去未结合蛋白后,分别用pH 5、4、3.5的100 mmol/L HAc-NaAc缓冲液依次进行洗脱。检测280 nm波长处吸光度,收集蛋白峰,测定胰蛋白酶活力并进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)鉴定。
1.3.4 草鱼胰蛋白酶活力测定
按照文献[12-13]的方法进行,并稍加改动。以BApNA为底物,在3.2 mL测活体系(100 mmol/L Tris-HCl,pH 8.0,含10 mmol/L CaCl2)中加入0.5 mL待测样品,37 ℃预热5 min后,加入17 μL 150 mmol/L底物BapNA溶液(溶剂为二甲基亚砜),继续保温10 min后,加入0.5 mL 33%醋酸溶液终止反应,在410 nm波长处测定反应体系中由产物对硝基苯胺(p-nitroaniline,pNA)所产生的吸光度。空白体系加样顺序为先加入反应终止液33%醋酸,再加入相同体积的样品溶液。
1.3.5 蛋白含量的测定
采用福林-酚法测定蛋白含量,以牛血清白蛋白为标准品,按照福林-酚蛋白浓度测定试剂盒说明书进行[14]。
1.3.6 草鱼胰蛋白酶分子质量的SDS-PAGE分析
用SDS-PAGE测定胰蛋白酶的分子质量及纯度,以低分子质量蛋白质Marker(14.4~97.4 kDa)为对照,采用4%浓缩胶,12%分离胶,浓缩胶电压为80 V,分离胶电压为120 V,采用考马斯亮蓝R-250染色液。用非变性聚丙烯酰胺凝胶电泳(Native-PAGE)鉴定纯化酶活力,以市售牛胰蛋白酶为对照,采用4%浓缩胶,7.5%分离胶,浓缩胶电压为80 V,分离胶电压为120 V。电泳后用底物酶谱法检测胰蛋白酶活力,通过对底物BApNA的水解,得到黄色对硝基苯胺产物,凝胶上显示出黄色条带。将凝胶浸入显色反应液(100 mmol/L Tris-HCl,10 mmol/L CaCl2,7.5 mmol/L BApNA,pH 8.0)中,37 ℃微摇30 min,至凝胶中出现清晰的黄色条带,立即扫描凝胶[12]。
1.3.7 草鱼胰蛋白酶催化BApNA反应米氏常数(Km)的测定
测定37 ℃时不同BApNA浓度(0.1、0.2、0.3、0.4、0.5 mmol/L)下酶催化反应的反应初速率V,并以1/V对1/[S]作图,得到Lineweaver-Burk双倒数曲线图[15]。图中横轴截距为1/Km的绝对值,纵轴截距为1/Vmax,进一步计算出动力学参数米氏常数Km和最大速率Vmax。
1.3.8 草鱼胰蛋白酶最适温度及热稳定性分析
以BApNA为底物,按照1.3.3节方法分别测定30、40、50、60、70、80、90 ℃时的酶活力,分析草鱼胰蛋白酶的最适温度。将草鱼胰蛋白酶液分别于30、40、50、60、70、80、90、100 ℃保温1 h后,冰浴冷却。按照1.3.3节方法测定胰蛋白酶的剩余活力,分析酶的热稳定性。
1.3.9 草鱼胰蛋白酶最适pH值及酸碱稳定性测定
以BApNA为底物,测定37 ℃不同pH值(6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0、10.5、11)条件下酶活力,分析酶的最适pH值。所用缓冲液为:Na2HPO4-NaH2PO4(100 mmol/L,pH 6.0~7.5),Tris-HCl(100 mmol/L,pH 8.0~9.0),Gly-NaOH(100 mmol/L,pH 9.5~10.0),NaHCO3-NaOH(100 mmol/L,pH 10.5~11.0)。
在室温下将胰蛋白酶液分别用不同pH值(2.0、4.0、6.0、8.0、10.0、12.0)的缓冲液处理1 h后,测定酶活力,分析酶的酸碱稳定性。所用缓冲液为pH 2.0(20 mmol/L Gly-HCl)、4.0(20 mmol/L NaAc-HAc)、6.0(20 mmol/L Na2HPO4-NaH2PO4)、8.0(20 mmol/L Tris-HCl)、10.0(20 mmol/L Gly-NaOH)、12.0(20 mmol/L NaHCO3-NaOH)。
1.3.10 金属离子及EDTA对草鱼胰蛋白酶活力的影响
向测活体系中加入不同量的K+、Ba2+、Mg2+、Fe2+、EDTA,使其离子终浓度为2~10 mmol/L,按照1.3.3节测定胰蛋白酶活力。以不加金属离子的酶活力为100%,分别计算加入不同浓度金属离子及EDTA后酶活力的变化。
1.4 数据处理
实验结果采用Excel进行作图及数据分析。
2 结果与分析
2.1 草鱼胰蛋白酶的分离纯化

图1 草鱼胰蛋白酶的BTI-Sepharose柱亲和层析图谱Fig.1 Elution profile of trypsin from C. idellus loaded on BTI-Sepharose column
如图1所示,峰1为上样穿透峰。上样并充分洗去未结合蛋白后,分别用pH 5、4和pH 3.5的100 mmol/L HAc-NaAc缓冲液依次洗脱层析柱,发现只有用pH 3.5的缓冲液洗脱时出现明显的A280nm蛋白峰(峰2)。胰蛋白酶活力鉴定结果表明穿透峰没有胰蛋白酶活力,而pH 3.5的缓冲液洗脱得到的峰2有活性。
图2a显示,峰2样品为单一条带(泳道2),以标准蛋白质分子质量的负对数对相对迁移率作图,根据相对迁移率计算得到草鱼胰蛋白酶的分子质量为27 kDa。
Native-PAGE活性染色结果(图2b泳道1)显示有黄色产物pNA生成,表明图1中峰2为胰蛋白酶,且达到了电泳纯。Native-PAGE中草鱼胰蛋白酶(图2b泳道1)的相对迁移率小于牛胰蛋白酶(图2b泳道2),分析与其分子质量大于牛胰蛋白酶(24 kDa)有关[16]。据报道,鱼类来源的胰蛋白酶分子质量一般在20.0~30.0 kDa范围内[11],如日本鳗鲡、金枪鱼、鳀鱼、白姑鱼胰蛋白酶的分子质量分别为21.5、24、25.6、28 kDa[17-21]。

图2 草鱼胰蛋白酶的SDS-PAGE(a)和Native-PAGE(b)图谱Fig.2 SDS-PAGE (a) and Native-PAGE (b) analysis of C. idellus trypsin
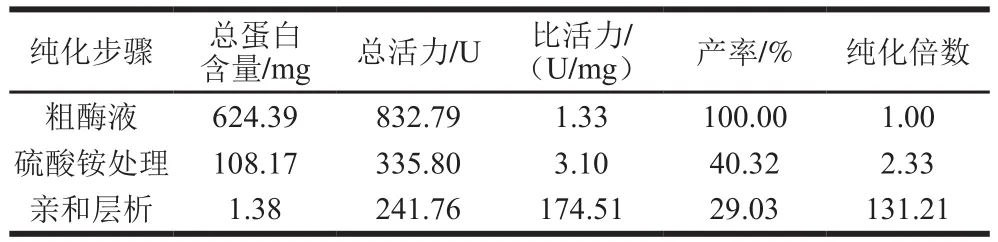
表1 草鱼胰蛋白酶纯化参数Table 1 Purification of trypsin from C. idellus
如表1所示,粗酶液经硫酸铵沉淀透析后,仅通过亲和层析一步纯化就得到胰蛋白酶纯酶,得率为29.03%,纯化倍数达到131.21 倍。由此可见,用BTI-Sepharose亲和柱仅需一步层析便可从粗酶液中纯化得到高纯度的胰蛋白酶,操作简单、效率高。
2.2 胰蛋白酶催化BApNA反应米氏常数(Km)分析

图3 草鱼胰蛋白酶的米氏常数双倒数图(以BApNA为底物)Fig.3 Kinetic properties of trypsin from C. idellus using BApNA as the substrate
如图3所示,以BApNA为底物,通过双倒数图可计算草鱼胰蛋白酶的Km为3.4×10-5mol/L,Vmax值为40.57 s-1,高于日本鳗鲡胰蛋白酶(3.1×10-6mol/L)和鲈鱼胰蛋白酶(1.12×10-6mol/L)的Km值[22],低于鲫鱼胰蛋白酶(3.6×10-2mol/L)和青鱼胰蛋白酶(2.7×10-2mol/L)的Km值[23],说明草鱼胰蛋白酶对BApNA的亲和力显著低于日本鳗鲡胰蛋白酶和鲈鱼胰蛋白酶,而明显高于鲫鱼胰蛋白酶和青鱼胰蛋白酶。
2.3 草鱼胰蛋白酶最适反应温度与热稳定性
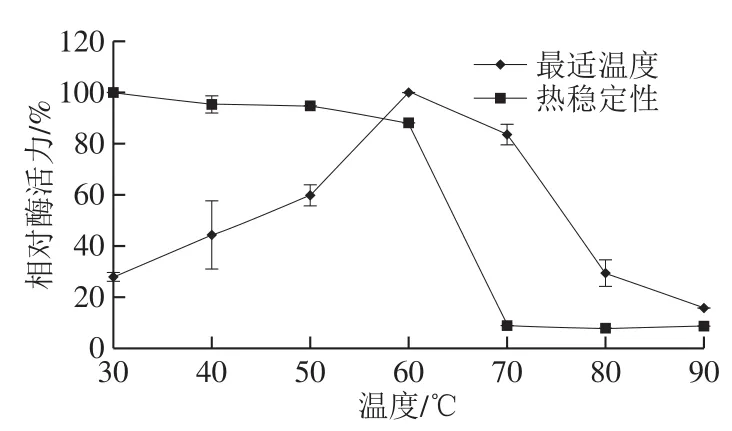
图4 草鱼胰蛋白酶的最适温度和热稳定性Fig.4 Optimum reaction temperature and thermal stability of trypsin from C. idellus
由图4可知,草鱼胰蛋白酶的最适温度为60 ℃。草鱼胰蛋白酶的最适温度与已报道的金枪鱼[18]和笛鲷[24](Lutjanidae)等胰蛋白酶相似;高于鲤鱼(Cyprinus carpio,40 ℃)、鲈鱼(Lateolabrax japonicus,40 ℃)和凤尾鱼(Coilia mystus,45 ℃)等已报道的大部分鱼类胰蛋白酶[25];低于大西洋狐鲣鱼(Atlantic bonito)胰蛋白酶,该酶的最适温度为65 ℃[26]。
在30~60 ℃水浴中加热60 min后,草鱼胰蛋白酶的剩余酶活均能保持在88%以上。当温度高于60 ℃时,其相对酶活力急剧下降到9%以下。草鱼胰蛋白酶的热稳定性与报道的鲈鱼、金枪鱼等胰蛋白酶类似。哺乳动物体内胰蛋白酶则具有较好的热稳定性,如牛胰蛋白酶在80 ℃高温条件下仍能保持较高的活性。鱼类胰蛋白酶与哺乳动物胰蛋白酶热稳定性的差异可能是由于不同物种生活环境和胰蛋白酶肽链结构的不同造成的。
2.4 草鱼胰蛋白酶的最适pH值和酸碱稳定性
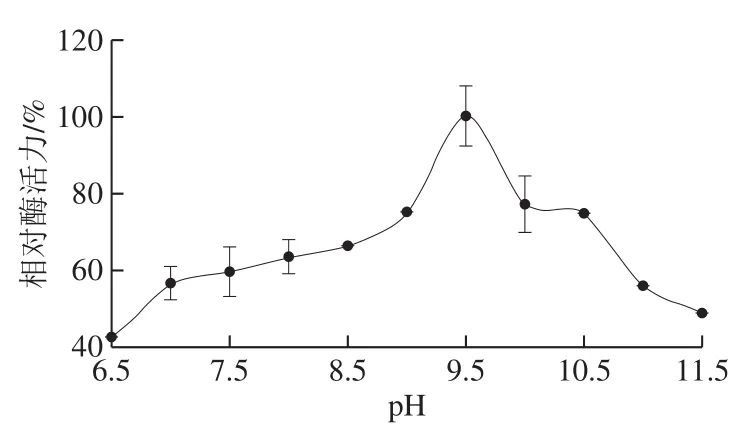
图5 草鱼胰蛋白酶的最适pH值Fig.5 Optimum reaction pH of trypsin from C. idellus
如图5所示,pH 9.5时草鱼胰蛋白酶表现出最大酶活力。当pH值为11.5时,草鱼胰蛋白酶仍然能够保持50%的酶活力。鱼类胰蛋白酶属于碱性蛋白系,在酸性条件由于活性位点电荷改变,酶不能有效与底物结合[27]。草鱼胰蛋白酶的最适pH值与白姑鱼(Argyrosomus argentatus)以及金枪鱼(Thunnus tonggol)等体内的胰蛋白酶一致,高于鲢鱼的最适pH 8.3,略高于鲤鱼(Cyprinus carpio,pH 9.0)和鳀鱼(Anchovy,pH 9.0)胰蛋白酶。
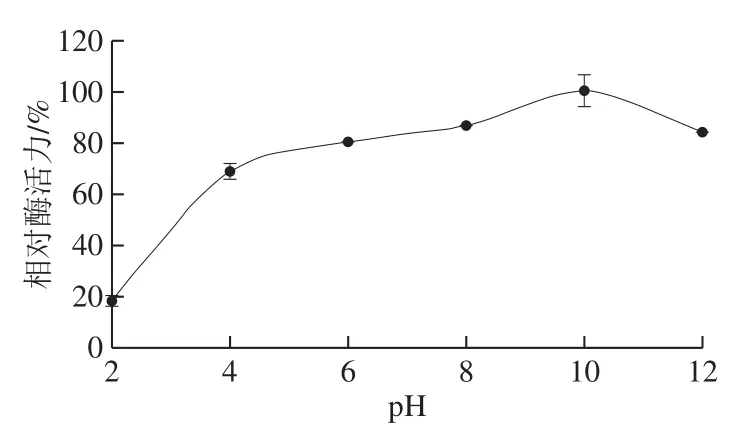
图6 草鱼胰蛋白酶的酸碱稳定性Fig.6 pH stability of trypsin from C. idellus
如图6所示,当草鱼胰蛋白酶在pH 6~12的条件下常温孵育60 min后,其相对酶活力仍能很好地保持在80%以上,当pH值小于4时,其酶活力急剧下降,表明草鱼胰蛋白酶的pH值稳定范围为6~12。该酶的pH值稳定性与鲫鱼、狭鳕鱼、金枪鱼等的胰蛋白酶相似。与鱼类来源的胰蛋白酶不同,哺乳动物如牛来源的胰蛋白酶在pH 2~3的酸性环境下仍能保持较好的稳定性。
2.5 金属离子、EDTA对草鱼胰蛋白酶活力的影响
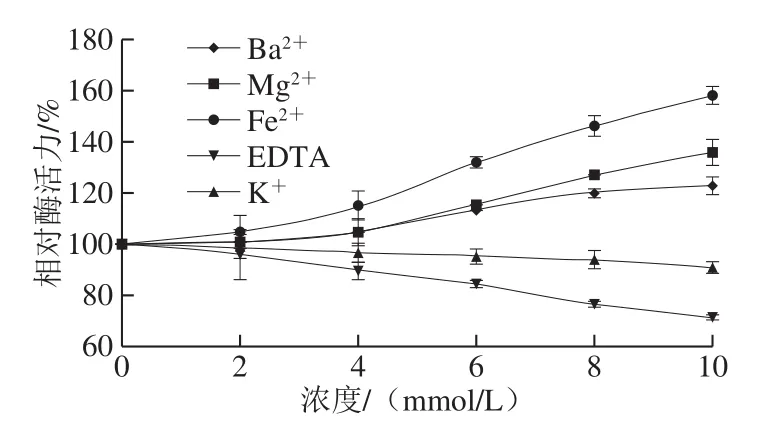
图7 金属离子与EDTA对草鱼胰蛋白酶活力的影响Fig.7 Effect of metal ion and EDTA on trypsin activity from C. idellus
如图7所示,随着Mg2+浓度的不断增加,草鱼胰蛋白酶活力呈现逐渐升高的趋势,当Mg2+浓度达到10 mmol/L时,草鱼胰蛋白酶活力较未加Mg2+的对照组提高到135.79%。由此可见,Mg2+在一定浓度范围内可激活草鱼胰蛋白酶活力。据报道,Mg2+对鳜鱼、鳀鱼、青鱼和鲫鱼胰蛋白酶活力均有一定激活作用。其原因是Mg2+与胰蛋白酶分子中的侧链氨基酸残基结合后可以稳定胰蛋白酶的分子构象,从而调节胰蛋白酶活力[28]。
随着Ba2+浓度的不断增加,草鱼胰蛋白酶活力呈现逐渐升高的趋势,当Ba2+浓度达到10 mmol/L时,草鱼胰蛋白酶活力提高到122.72%。据报道Ba2+对日本鳗鲡胰蛋白酶活力具有激活作用,而对中国明对虾胰蛋白酶活力具有强烈的抑制作用[29]。
草鱼胰蛋白酶活力随Fe2+浓度的不断增加而增强,当Fe2+浓度达到10 mmol/L时,草鱼胰蛋白酶活力提高到158.04%。杨丽媛[30]报道低浓度的Fe2+会增加碱性蛋白酶活力;5 mmol/L Fe2+可使中国明对虾胰蛋白酶活力提高到155.68%;Fe2+对菠萝蛋白酶、中性蛋白酶活力也有不同程度的激活作用[31]。
随着K+浓度的不断增加,草鱼胰蛋白酶活力呈现缓慢降低的趋势,当K+浓度达到10 mmol/L时,草鱼胰蛋白酶保持92%活力。研究表明K+对鲫鱼,青鱼胰蛋白酶也均有一定的抑制作用。
草鱼胰蛋白酶活力随EDTA浓度的增加而降低,当EDTA浓度达到10 mmol/L时,草鱼胰蛋白酶活力降低到71%。Castillo-Yáñez等[32]报道0.25 mg/mL EDTA可抑制14%的沙丁鱼胰蛋白酶活力。EDTA对青鱼、鲫鱼、大眼鲷等胰蛋白酶活力都具有很强的抑制作用,而对鳀鱼、白姑鱼、鲈鱼胰蛋白酶的抑制作用较轻。
3 结 论
本研究通过缓冲液浸提、硫酸铵沉淀和BTISepharose亲和层析,从草鱼肝胰腺中纯化得到一种分子质量为27 kDa的胰蛋白酶。鱼内脏常被作为废弃物处理,没有价值又污染环境。本实验纯化方法简单,经过常规浸提和沉淀后,只需一步层析便从草鱼肝胰腺提取液中纯化得到了电泳纯的草鱼胰蛋白酶。目前报道酶的提取纯化方法中,为了达到高的比活力,通常需要多步纯化(如离子交换色谱和凝胶色谱联合使用),每一次纯化步骤都会不可避免造成酶活力的损失。亲和层析基于亲和材料中配体分子与酶的高度特异性结合作用,操作简单,快速高效,仅需一步操作便可获得高纯度高活性的酶,在保证了高比活力的前提下,提高了酶总活力的回收。因此,本研究采用亲和层析技术制备胰蛋白酶不仅能够极大地降低生产成本,提高经济效益,而且也能为工业提取纯化其他蛋白提供参考。
草鱼胰蛋白酶与底物BApNA有较强的亲和力,最适反应温度为60 ℃,最适pH值为9.5,并有较好的热稳定性和酸碱稳定性,材料来源丰富,成本低廉,具有潜在的应用价值。Ba2+、Mg2+、Fe2+在0~10 mmol/L浓度范围内对该酶都具有一定程度的激活作用,而EDTA对酶有显著抑制作用。以上结果可为草鱼的贮藏、加工以及运输条件的改进,内源性水解酶的应用等提供理论依据。

