鱼肠道中抗氧化活性乳酸菌的筛选及鉴定
丁丽丽,吕欣然,高永悦,崔晓玲,王小咪,白凤翎,*,仪淑敏,郭晓华
(1.渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,国家鱼糜及鱼糜制品加工技术研发分中心,辽宁 锦州 121013;2.山东美佳集团有限公司,山东 日照 276815)
水产品具有高蛋白、低脂肪、味道鲜美等特点,受到广大消费者的青睐。但是,水产品极易受到脂质和蛋白氧化等影响,使水产品产生色泽变暗、弹性变差以及安全性降低等不良变化[1-3]。最终导致水产品整体质量下降,给人们健康带来危害[4-5]。
目前预防和延缓水产品氧化最主要的方式是向水产品中添加抗氧化剂。植物源抗氧化剂主要有酚类、植物多糖类、生物碱类及维生素类等植物提取物,动物源抗氧化剂主要由动物自身组织产生的内源物质(如肌肽)和动物水解蛋白质的产物两部分组成,合成类抗氧化剂主要包括丁基羟基茴香醚、特丁基对苯二酚等,这3 类抗氧化剂都存在成本高、作用机制单一等缺点[6-11]。微生物源抗氧化剂中以乳酸菌最为常见,乳酸菌作为天然抗氧化剂,具有完整的抗氧化体系及评价体系的同时还具有来源广泛、成本低廉、安全性高等优点[12-13]。相对于其他类抗氧化剂,开发微生物源抗氧化剂更具有潜在的应用价值。
从自然界乳酸菌资源中筛选具有抗氧化活性的菌株已成为研究热点。王惋等[14]通过体外抗氧化和胃肠道环境的耐受性实验,从发酵蔬菜中分离出具有较好抗氧化性、耐酸性和疏水性的植物乳杆菌(Lactobacillus plantarum)A15。李默等[15]从发酵肉制品中分离到希腊魏斯氏菌(Weissella hellenica)L23,可作为抗氧化发酵剂用于肉制品生产。唐宇[16]从发酵豆乳中分离到干酪乳杆菌(L. casei)16,该菌具有抗氧化活性,同时能提高糖苷型大豆异黄酮的转化率,使发酵后的豆乳更具营养。研究表明,抗氧化乳酸菌主要来源于发酵食品,鱼肠道来源的抗氧化乳酸菌较少。
本实验从鱼肠道的乳酸菌中筛选具有抗氧化活性的优良菌株,因其可在鱼肠道中定植且对宿主无害,在肠道内发挥抗氧化作用维持氧化还原平衡,同时还具有耐低温、有效抑制致病菌等优点,可以被广泛的应用在冷冻及鲜活水产品的抗氧化加工中[17-18]。因此,从丰富的鱼肠道微生物资源中筛选具有抗氧化活性的乳酸菌对开发水产品抗氧化制剂具有十分重要的应用价值。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
乳酸菌菌株:来源于辽宁锦州地区的草鱼、鲈鱼、刀鱼、牙鲆、大菱鲆、鲤鱼、鳙鱼。
应试菌株:志贺氏菌(Shigella Castellani)CMCC(B)51572、埃希氏大肠杆菌(Escherichia coli)CMCC 44102、铜绿假单胞菌(Pseudomonas aeruginosa)ATCC 9027、荧光假单胞菌(P. fluorescens)、地衣芽孢杆菌(Bacillus licheniformis)ACCC11091、金黄色葡萄球菌(Staphylococcus aureus)CMCC26003、蜡样芽孢杆菌(B. cereus)CMCC63301及单核细胞性李斯特菌(Listeria monocytogenes)ATCC19115均由学院微生物学与分子生物学实验室保藏;鼠李糖乳杆菌(Lactobacillus rhamnosusGG,LGG)ATCC53103 北纳创联生物技术有限公司。
1.1.2 试剂
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、亚油酸、硫代巴比妥酸(thiobarbituric acid,TBA)、邻菲罗琳、三羟甲基氨基甲烷(Tris) 美国Sigma公司。
氯化钾(质量分数为0.02%)、氯化钠(质量分数为0.8%)、磷酸二氢钾(质量分数为0.024%)、磷酸氢二钠(质量分数为0.144%)TaqPCR Master mix、细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)快速抽提试剂盒、DNA Marker、PCR扩增引物 生工生物工程(上海)股份有限公司。
1.2 仪器与设备
DYY-8C电泳仪 北京六一生物科技有限公司;超声波细胞粉碎机 宁波新芝生物科技股份有限公司;ABI stepone plus聚合酶链式反应(polymerase chain reaction,PCR)仪、5804R冷冻高速离心机 德国艾本德股份有限公司;Cheimdox XRS凝胶成像仪 美国Bio-Rad公司;UV2550紫外-可见分光光度计 岛津企业管理(中国)有限公司;IKA Vortex GENIUS 3振荡器德国IKA公司。
1.3 方法
1.3.1 乳酸菌完整细胞及无细胞提取物的制备
称取0.2 g氯化钾、8 g氯化钠、0.24 g磷酸二氢钾、1.44 g磷酸氢二钠,先溶于800 mL去离子水,调节至pH 7.2后,加去离子水定容至1 L,最后经121 ℃灭菌15 min以制备磷酸缓冲液(phosphate buffer saline,PBS)。乳酸菌以2%的接种量(终浓度为109CFU/mL)接种于MRS液体培养基,37 ℃培养24 h。将第3代活化后的菌株分为两组,一组4 ℃、6 000 r/min离心15 min,收集菌体,收集的菌体经PBS洗涤2 次,重悬于PBS中,作为乳酸菌完整细胞备用。另一组将菌悬液冰浴超声破碎(15 min变幅杆:φ6;超声开1 s;超声关2 s;功率33%),在4 ℃、10 000 r/min离心20 min,收集上清液,作为乳酸菌无细胞提取物备用。
1.3.2 抗氧化活性乳酸菌的初筛
乳酸菌的DPPH自由基清除能力,参照文献[19]并稍加改进,以鼠李糖乳杆菌LGG作阳性对照。DPPH自由基清除率公式如下:

式中:Bi为样品组吸光度;Bj为空白组吸光度;Bc为对照组吸光度。
1.3.3 抗氧化活性的乳酸菌的复筛
1.3.3.1 乳酸菌的羟自由基清除能力测定
参照文献[20]的方法稍加改进,以鼠李糖乳杆菌LGG作阳性对照。羟自由基清除率公式如下:
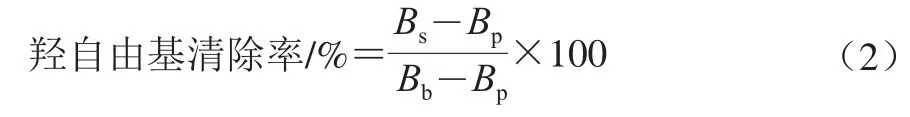
式中:Bs为样品组吸光度;Bb为对照组吸光度;Bp为空白组吸光度。
1.3.3.2 乳酸菌的抗脂质过氧化能力测定
参照文献[21]的方法稍加改进,以鼠李糖乳杆菌LGG作阳性对照。抗脂质过氧化率公式如下:

式中:B为样品组吸光度;Bo为对照组吸光度。
1.3.3.3 乳酸菌的超氧阴离子自由基清除能力测定
参照文献[22]的方法稍加改进,以鼠李糖乳杆菌LGG作阳性对照。超氧阴离子自由基清除率公式如下:

式中:B为样品组吸光度;Bo为空白组吸光度。
1.3.4 乳酸菌的抑菌活性测定
以志贺氏菌、埃希氏大肠杆菌、铜绿假单胞菌、荧光假单胞菌、地衣芽孢杆菌、金黄色葡萄球菌、蜡样芽孢杆菌及单核细胞性李斯特菌为应试菌株,采用牛津杯打孔法[23]测定乳酸菌的抑菌活性。
1.3.5 乳酸菌菌株的鉴定
1.3.5.1 生理生化鉴定
参照文献[24]对菌株进行初步的鉴定。
1.3.5.2 16S rDNA序列分析
参照文献[25]的方法稍加改进,将扩增成功的PCR产物送生工生物工程(上海)股份有限公司测序。
1.4 数据分析
2 结果与分析
2.1 抗氧化活性乳酸菌的初筛
DPPH自由基清除率是评价乳酸菌抗氧化最常见的指标,是由不成对电子氮为中心构成的一种稳定的基团,通过接受氢自由基或电子形成更加稳定的DPPH-H分子[26-27]。如果乳酸菌能将其清除则说明乳酸菌具有降低自由基的能力,也就具有一定的抗氧化性。因此,乳酸菌的抗氧化活性与DPPH自由基清除率有关,即乳酸菌的DPPH自由基清除能力越强,则说明乳酸菌的抗氧化活性越强。

表1 乳酸菌菌株对DPPH自由基的清除率Table 1 DPPH free radical scavenging activity of LAB strains
由表1可知,来自鱼肠道的48 株乳酸菌均具有DPPH自由基清除能力,清除率范围在(1.74±0.21)%~(67.29±0.42)%,31 株乳酸菌的DPPH自由基清除率高于阳性对照鼠李糖乳杆菌LGG(P<0.05),其中菌株LY-21、CY1-2、CY2-1、CY2-3、LY-17的DPPH自由基清除率显著高于其他乳酸菌包括阳性对照鼠李糖乳杆菌LGG(P<0.05),清除率分别为(64.10±0.75)%、(67.29±0.42)%、(65.14±0.43)%、(65.6±0.30)%、(61.34±0.34)%。因此,选择这5 株菌继续实验,结合其他指标进一步探究其抗氧化活性[28]。
2.2 抗氧化活性乳酸菌的复筛
2.2.1 羟自由基清除率

图1 乳酸菌菌株的羟自由基清除结果Fig.1 Hydroxyl radical scavenging effect of LAB strains
由图1可知,清除能力较强的5 株乳酸菌的完整细胞及无细胞提取物都表现出较强的羟自由基清除能力,其范围分别为(56.60±0.52)%~(60.67±1.44)%和(57.43±1.84)%~(64.27±1.26)%,且均超过阳性对照鼠李糖乳杆菌LGG(P<0.05)。其中,菌株CY1-2的完整细胞及无细胞提取物的羟自由基清除率均高于其他菌株,分别为(60.67±1.44)%和(64.27±1.26)%,并且其无细胞提取物的清除率大于完整细胞的清除率。该结果与刘少敏等[29]研究植物乳杆菌NDC 75017的羟自由基清除结果类似,这可能是由于细胞被破坏后,特定的Fe2+和Cu2+金属螯合物被释放出来,参与氧化反应,从而明显减少羟自由基的产生。
2.2.2 抗脂质过氧化率
由图2可知,5 株乳酸菌的无细胞提取物组均表现出较强的抗脂质过氧化能力,此外,菌株CY1-2和LY-21的抗脂质过氧化能力均显著高于阳性对照鼠李糖乳杆菌LGG(P<0.05)。乳酸菌的完整细胞组,菌株CY1-2的抗脂质过氧化率最高,为(40.77±0.50)%,其次是菌株LY-21,为(39.70±0.35)%。乳酸菌的无细胞提取物组,菌株LY-21的抗脂质过氧化率最高,为(56.10±0.01)%,其次是菌株CY1-2,为(51.03±0.40)%。由结果可知,相较于其他菌株,菌株CY1-2和LY-21抗脂质过氧化率较高,且其无细胞提取物的抗脂质过氧化率均高于完整细胞,这一结果与罗章等[30]研究清酒乳杆菌(L. sake)HN05的抗脂质过氧化率结果相似,这可能是由于乳酸菌细胞内存在较多的螯合Fe2+的活性物质,与脂质过氧化物反应,达到抑制脂质氧化的目的[21]。

图2 乳酸菌菌株的抗脂质过氧化结果Fig.2 Anti-lipid peroxidation effect of LAB strains
2.2.3 超氧阴离子自由基清除率
超氧阴离子自由基也可以直接作用于核酸、蛋白质等生物大分子,从而导致细胞膜受损,引起一系列的有害反应[31]。
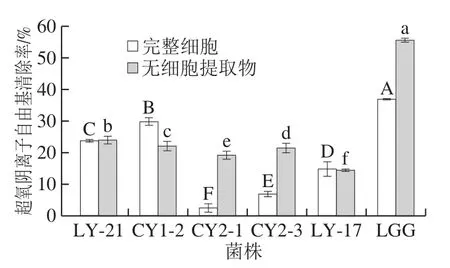
图3 乳酸菌菌株的超氧阴离子自由基清除结果Fig.3 Superoxide anion radical scavenging effect of LAB strains
由图3可知,5 株乳酸菌表现出不同差异的超氧阴离子自由基清除效果。乳酸菌的完整细胞提取物组,菌株CY1-2表现出最强的超氧阴离子自由基清除率,为(29.87±1.14)%,其次是菌株LY-21,清除率为(23.63±0.55)%。乳酸菌的无细胞提取物组,菌株LY-21的超氧阴离子自由基清除率最高,为(24.00±1.15)%,其次是菌株CY1-2,清除率为(21.97±1.47)%。且结果均小于阳性对照鼠李糖乳杆菌LGG(P<0.05),该结果与高原[31]研究的植物乳杆菌Y42结果类似,鼠李糖乳杆菌LGG分泌的抑制超氧阴离子活性物质强于实验菌株,从而表现出较强的抗氧化能力,导致实验组结果均小于对照组结果。菌株CY1-2和LY-17完整细胞的超氧阴离子自由基清除率高于无细胞提取物,该结果与郭慧芬等[20]研究的戊糖片球菌(Pediococcus pentosaceus)X31结果相类似,表明这两株乳酸菌清除超氧阴离子自由基的活性物质主要存在于细胞表面;其他菌株无细胞提取物的超氧阴离子自由基清除率均高于完整细胞,结果与高原[31]研究的植物乳杆菌Y44结果类似,表明细胞内存在某种抗氧化物质,如超氧化物歧化酶与过氧化氢酶作用产生的结果[32]。
从上述抗氧化活性指标可得出,菌株CY1-2完整细胞的羟自由基、超氧阴离子自由基清除率及抗脂质过氧化率均比其他菌株的清除率大;菌株CY1-2无细胞提取物的羟自由基清除效果强于其他菌株,抗脂质过氧化率和超氧阴离子自由基清除率仅次于菌株LY-21,结果可能与细胞表面、细胞内部存在的活性分子的差异性有关。综合以上指标,故选择分离自草鱼肠道的菌株CY1-2作为优良乳酸菌进行后续研究。
2.3 乳酸菌的抑菌结果
具有抗氧化及抑菌双重功效的乳酸菌在水产品加工领域具有非常重要的价值,因为一方面可以延缓水产品氧化,达到延长货架期的目的;另一方面又能保护水产品免受腐败菌的污染,提高水产品的安全性。因此,探究抗氧化乳酸菌CY1-2是否具有广谱抑菌活性。
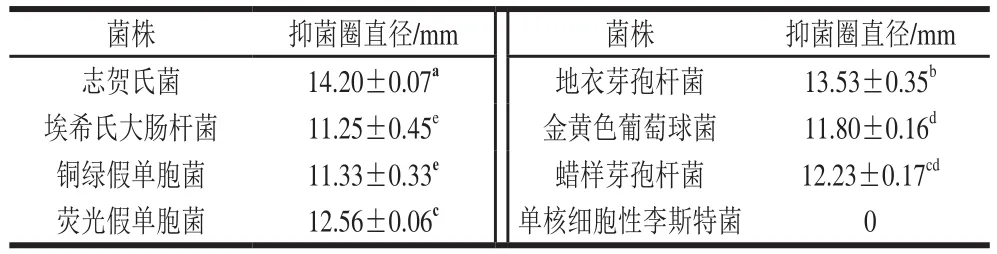
表2 菌株CY1-2对8 种细菌的抑菌结果Table 2 Inhibitory effects of strain CY1-2 against eight bacteria
由表2可知,菌株CY1-2对志贺氏菌、埃希氏大肠杆菌、铜绿假单胞菌和荧光假单胞菌等革兰氏阴性菌均具有抑菌效果,其中对志贺氏菌的抑菌效果最强,抑菌圈直径为(14.20±0.07)mm。除单核细胞性李斯特菌之外,菌株CY1-2对地衣芽孢杆菌、金黄色葡萄球菌和蜡样芽孢杆菌等革兰氏阳性菌均具有抑菌作用,其中对地衣芽孢杆菌的抑菌效果最好,抑菌圈直径为(13.53±0.35)mm。此外,吴光伟等[33]研究发现,鼠李糖乳杆菌LGG对多种革兰氏阴性菌及革兰氏阳性菌均有抑制作用。因此,菌株CY1-2作为抗氧化菌株也具有广谱抗菌活性。
2.4 菌株鉴定结果
2.4.1 生理生化鉴定结果
菌株CY1-2生理生化鉴定结果如表3所示。

表3 菌株CY1-2的糖发酵结果Table 3 Sugar fermentation characteristics of strain CY1-2
2.4.2 16S rDNA序列结果
如图4所示,核酸序列在1 000~2 000 bp之间,进一步测序,得到菌株CY1-2的目的片段序列为1 500 bp。利用BLAST软件,从GenBank中选择10 个菌株的16S rDNA基因序列,利用MEGA 7.0软件构建系统发育树,结果见图5,菌株CY1-2与L. plantarumKP317705.1亲缘关系达99%,由此确定菌株CY1-2为植物乳杆菌。
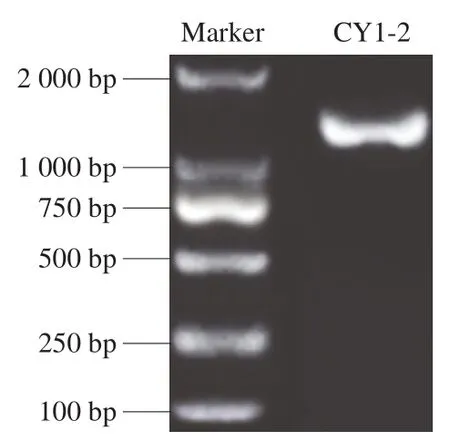
图4 菌株CY1-2的16S rDNA琼脂糖凝胶电泳结果Fig.4 Agarose gel electrophoresis of PCR amplified 16S rDNA gene of strain CY1-2

图5 菌株CY1-2基于16S rDNA的系统进化树Fig.5 Phylogenetic tree of strain CY1-2 based on 16S rDNA gene sequences
3 结 论
本研究从来自鱼肠道的48 株乳酸菌中筛选出具有较强抗氧化活性的菌株CY1-2,经生理生化反应和16S rDNA序列分析鉴定为植物乳杆菌,该菌株的完整细胞和无细胞提取物均具有较强的清除羟自由基和超氧阴离子自由基、抗脂质过氧化能力,对革兰氏阳性菌和革兰氏阴性菌均有抑菌效果,表明该菌株具有良好的抗氧化性和抑菌性。本研究对进一步开发天然水产品抗氧化剂具有一定的应用价值。

